腸道菌群和色氨酸代謝在非酒精性脂肪性肝病中的作用
鐘慶玲, 李良平
1 電子科技大學 醫學院, 成都 610054; 2 電子科技大學附屬醫院·四川省人民醫院 消化內科, 成都 610072
非酒精性脂肪性肝病(NAFLD)發病率逐年升高,全球約1/4人口患病,我國患病率高達29.2%[1]。NAFLD已成為全球慢性肝病的主要病因,到2030年,全球15歲以上人群的NAFLD患病率約為33.5%[2]。2020年2月,NAFLD和非酒精性脂肪性肝炎(NASH)更名為代謝相關脂肪性肝病(metabolic-associated fatty liver disease,MAFLD)和代謝相關脂肪性肝炎(metabolic-associated steatohepatitis,MASH),與肥胖、2型糖尿病密切相關。其發生發展機制較復雜,未充分闡明。目前包括遺傳因素和表觀遺傳因素、飲食因素、胰島素抵抗(IR)、脂毒性、促炎因子以及腸道微生物組在內的“多重打擊”學說被廣泛接受用于解釋NAFLD的代謝及分子機制[3]。本文總結腸道菌群及色氨酸代謝物與NAFLD之間復雜的作用機制,旨在為NAFLD的治療提供理論依據。
1 腸道菌群失調與NAFLD的關系
使用抗生素抑制小腸細菌過度生長可減輕肝臟脂肪變性,這為腸道菌群對NAFLD的重要性提供了早期證據[4]。目前研究發現健康人群與NAFLD患者腸道微生物群有著顯著差異。腸道菌群參與了從單純脂肪肝、脂肪性肝炎到纖維化的進程,在NAFLD不同階段,腸道菌群特征也明顯不同[5]。多項研究[6-9]發現擬桿菌門的過度生長可能在NAFLD的發生中起著關鍵作用。NASH兒童與肥胖者或健康者大腸桿菌存在明顯差異[10]。Wong等[7]發現腸道厚壁菌門減少和擬桿菌門增加的NAFLD患者,肝內甘油三酯水平降低。肝脂肪變性的改善與梭狀芽孢桿菌類、梭狀芽孢桿菌目和糞桿菌屬的降低有關。Loomba等[11]通過宏基因組測序發現,在輕中度NAFLD患者中,普通擬桿菌和真桿菌豐度最高,而在肝纖維化中普通擬桿菌和大腸桿菌豐度最高。總體而言,NAFLD患者中腸道菌群多樣性降低,肝-微生物組軸的破壞,對NAFLD的進展有重要影響[12]。腸道菌群失調使腸屏障功能及免疫穩態破壞,源自于腸道菌群的代謝產物或細菌透過腸屏障進入肝臟,啟動氧化應激、內質網應激,引起肝細胞變性壞死及凋亡[13]。糞菌移植對恢復腸道屏障完整性、減輕肝脂肪變性、內毒素血癥和肝細胞氣球樣變具有有益作用[14]。但目前的研究未能闡明腸道菌群失調影響NAFLD的具體機制以及二者間的因果關系。
2 色氨酸代謝與NAFLD的關系
腸道微生物群及其細菌產物通過腸-肝軸對NAFLD起調節作用。既往研究發現,添加色氨酸可增加大鼠肝臟脂肪酸合成,誘發肝臟脂肪變性,然而,Ritze等[15]研究表明,口服色氨酸補充劑可減輕小鼠的NAFLD。NAFLD相關肝細胞癌小鼠糞便中色氨酸代謝物吲哚丙酸(indolepopionic acid,IPA)明顯降低[16]。5-羥色胺(5-hydroxytryptamine,5-HT)由色氨酸衍生而來,選擇性5-羥色胺再攝取抑制劑(selective serotonin reuptake inhibitors,SSRI)是治療抑郁癥最廣泛的處方藥物[17]。研究[18]發現使用SSRI較未用藥者肝癌風險降低,且隨著SSRI劑量增加,發生肝癌風險降低。另一項研究[19]發現血清吲哚濃度與BMI呈負相關(R=-0.45,P<0.01),吲哚水平低者,肝臟中脂肪沉積量較高。上述研究提示色氨酸及其代謝物對于調節NAFLD可能具有潛在的保護作用[20]。
3 腸道微生物與色氨酸代謝相互作用
3.1 色氨酸的代謝途徑 色氨酸是一種必需氨基酸,多數從飲食營養攝入,僅部分來源于內源性蛋白質降解[21],在小腸吸收,絕大部分在結腸轉化為多種代謝產物,乳酸桿菌在小鼠的胃和回腸中也可分解色氨酸[20]。目前色氨酸主要通過3條途徑產生代謝物影響宿主的新陳代謝:(1)色氨酸被分解為吲哚及芳香烴受體(aryl hydrocarbon receptor,AHR)配體的代謝物;(2)在免疫細胞和胃腸上皮細胞中通過犬尿氨酸途徑代謝,該途徑的關鍵限速酶吲哚胺2,3-雙加氧酶(indoleamine 2, 3-dioxygenase,IDO),其活性受腸道菌群的調節;(3)通過腸嗜鉻細胞中的色氨酸羥化酶(tryptophan hydroxylase,TPH1)產生5-HT。詳見圖1。
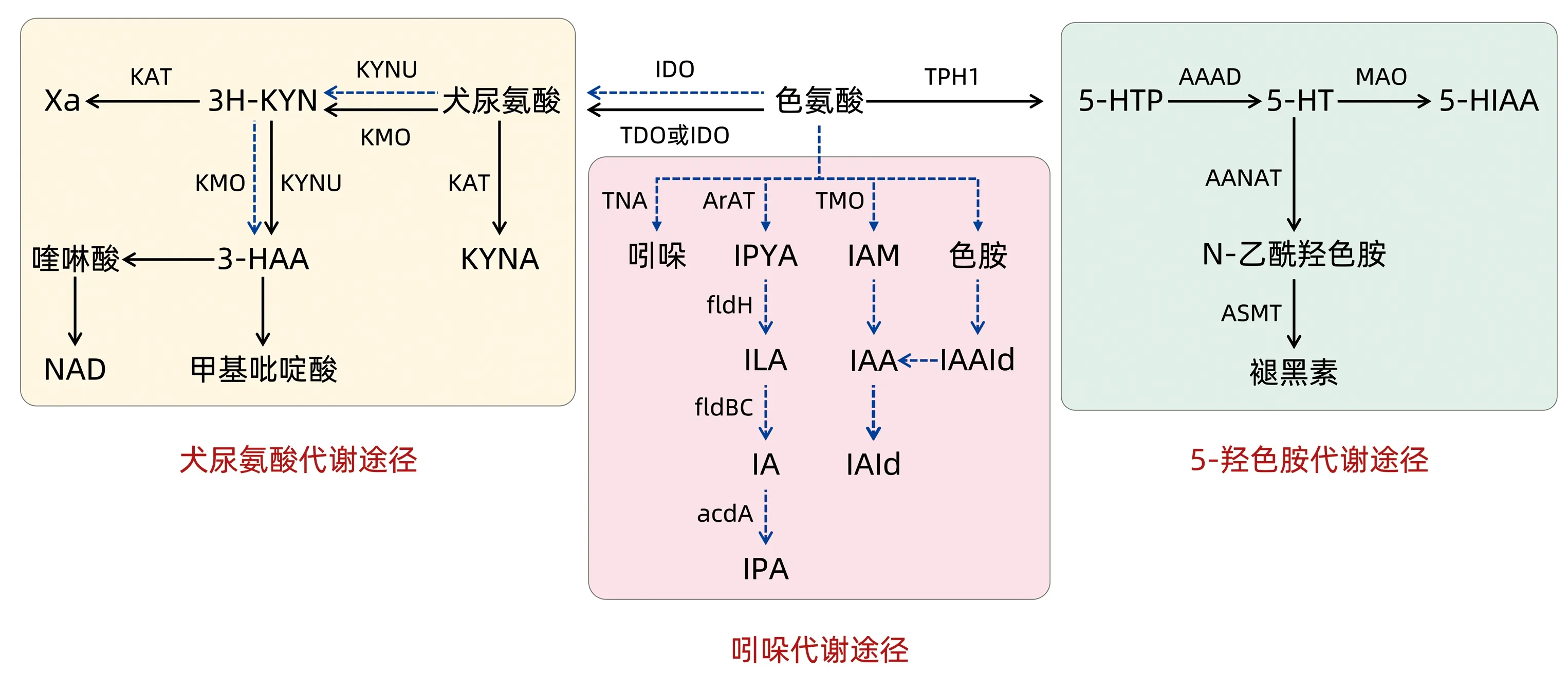
注:黑色箭頭線表示宿主途徑,藍色虛線箭頭線表示微生物途徑。TDO,色氨酸2,3-雙加氧酶;KYNU,犬尿氨酸酶;KMO,犬尿酸-3-單加氧酶;KAT,犬尿氨酸氨基轉移酶;KYNA,犬尿喹啉酸;3H-KYN,3-羥基犬尿氨酸;Xa,黃尿酸;3-HAA,3-羥基-2-氨基苯甲酸;NAD,煙酰胺腺嘌呤二核苷酸;TNA,色氨酸酶;ArAT,芳香族氨基酸轉氨酶;IPYA,吲哚-3-丙酮酸;fldH,苯醛酸脫氫酶;ILA,吲哚乳酸;fldBC,苯乳酸脫水酶;IA,吲哚丙烯酸;IPA,吲哚丙酸;TMO,色氨酸2-單加氧酶;IAM,吲哚乙酰胺;IAA,吲哚-3-乙酸;IAld,吲哚-3-甲醛;IAAld,吲哚-3-乙醛;5-HTP,5-羥色氨酸;AAAD,芳香族氨基酸脫羧酶;AANAT,芳基烷基胺N-乙酰基轉移酶;ASMT,乙酰血清素O-甲基轉移酶;MAO,單胺類氧化酶;5-HIAA,5-羥基吲哚乙酸。
3.2 腸道菌群調節色氨酸代謝 1897年色氨酸就被發現由大腸桿菌和霍亂弧菌轉化為吲哚[22]。色氨酸通過TNA分解為吲哚,該酶在多種細菌中表達[20]。腸道菌群也可調節5-HT水平[23]。Laurans等[24]發現腸道微生物群通過調節IDO的活性,影響色氨酸代謝。高脂飲食誘導的IDO-/-小鼠較野生型小鼠腸中IAA較高,表明IDO依賴的微生物群變化在IAA產生中的重要性。雙歧桿菌可以產生ILA、IPA和IAA等,同時不同菌株產生ILA的能力不同[25]。上述研究提示腸道菌群可以調節色氨酸的代謝。
3.3 色氨酸代謝產物在腸道微生物群落中的調節作用 吲哚影響孢子形成、質粒穩定性及耐藥性、生物膜形成、毒性,作為一種細胞間信號分子可能在微生物群落中發揮重要作用[26]。吲哚乙醇在真菌中被認為是群體感應分子[27],對金黃色葡萄球菌、腸沙門菌具有抗菌活性;ILA對大腸桿菌具有抑菌活性[20]。上述研究表明吲哚對細菌、真菌和病毒在內的腸道微生物群落起調節作用。
4 腸道菌群、色氨酸代謝調節NAFLD的分子機制
許多研究集中于腸-肝軸的組成,腸道屏障和腸道微生物群這兩大主要組成在肝脂質代謝、炎癥發展中起著重要作用[28]。不同器官和組織之間的串擾導致了肝臟、脂肪組織和腸道的代謝功能障礙。IR被認為是NAFLD發生的始動環節,IR使組織細胞對葡萄糖的攝取利用受阻,導致脂肪分解供能,促進甘油三脂在肝臟堆積,進而誘發脂肪變性。在此基礎上源自于腸道菌群的代謝產物或細菌透過腸屏障進入肝臟,啟動氧化應激、內質網應激,引起肝細胞變性壞死及凋亡。然而,腸道菌群產生的色氨酸代謝產物是微生物群落和宿主-微生物之間溝通的重要信號分子,可能有助于維持腸道和全身穩態。
4.1 色氨酸及其代謝物調節腸道穩態
4.1.1 AHR配體 AHR是一種廣泛表達于免疫細胞的轉錄因子,其激活改變了配體特異性的先天和適應性免疫反應。IA、IAld、色胺、3-甲基吲哚、IAA、和ILA,可作為AHR的配體。
乳酸桿菌通過IAld介導AHR激活,促進IL-22分泌,從而調節黏膜穩態[29]。保加利亞乳酸桿菌OLL1181激活AHR途徑,抑制結腸炎癥并誘導細胞色素CYP1A1的基因表達[30]。羅伊乳酸桿菌通過IAld和ILA激活AHR,促進CD4+CD8αα+雙陽性上皮內T淋巴細胞的增殖,從而發揮免疫調節作用[31]。研究[32]發現NASH小鼠中變形菌門增加與結腸中黏膜地址素細胞黏附分子(mucosal address cell adhesion molecule,MAdCAM-1)表達相關,而MAdCAM-1可介導小鼠肝臟和腸道α4β7+CD4+T淋巴細胞的歸巢。此外,ILA還能抑制輔助性T淋巴細胞(Th)17在體外的極化[33]。腸道微生物群影響中性粒細胞的遷移和功能,促進T淋巴細胞群分化為Th17細胞和調節性T淋巴細胞(Treg)[34]。腸道Th17/Treg平衡對維持腸道免疫穩定至關重要。5-HT的釋放增多影響上皮內淋巴細胞、CD4+/CD8+T淋巴細胞、B和T淋巴細胞的增殖、細胞因子的分泌,從而干擾腸道內免疫系統的平衡[35]。
4.1.2 改善腸道屏障 腸上皮屏障和腸血管屏障的破壞是NASH發病機制中的早期事件。研究[36-37]證明吲哚、IAA是維持腸道屏障的有益信號。IPA可以通過孕烷X受體調節小鼠腸屏障功能,尤其是在吲哚存在的情況下。IA一方面通過孕烷X受體介導腸道通透性的降低而影響黏膜穩態;另一方面可能通過介導AHR活化促進杯狀細胞的分化、黏液產生,保護小鼠腸上皮屏障功能、減輕炎癥反應[38]。此外IAld通過刺激IL-22的分泌,誘導信號轉導和轉錄激活因子3磷酸化,促進腸上皮細胞增殖,恢復屏障功能[39]。在細胞模型上,研究[40]發現吲哚可誘導腸上皮緊密連接組織基因的表達,改善屏障功能。
4.2 色氨酸及其代謝物調節全身穩態
4.2.1 調節肝臟脂質代謝、減輕IR,改善NAFLD 腺苷酸活化蛋白激酶(AMP activated protein kinase,AMPK)是細胞內糖脂代謝的關鍵酶,在肝臟、骨骼肌中分布較多,AMPK的生物學效應和NAFLD的發生密切相關[41]。血清IPA通過促進IL-6分泌激活AMPK,AMPK激活后,一方面抑制脂肪合成酶的活性,使肝內甘油三酯和脂質合成減少;另一方面啟動分解代謝,增加肝臟脂肪酸氧化和細胞攝取葡萄糖,避免脂肪在肝細胞內聚集[42]。升高的IPA可以促進胰島素分泌,并且減輕IR,減少2型糖尿病的患病率[40]。
胰高血糖素樣肽1(glucagon-like peptide,GLP-1)能加快肝臟脂肪酸氧化分解,減少脂肪生成,改善肝臟的糖代謝[43],并刺激胰腺β細胞分泌胰島素,提高組織細胞對胰島素的親和力。吲哚可誘導腸內分泌L細胞中GLP-1釋放,腸道內的吲哚水平增加會減少脂肪生成,并且會降低食欲,使脂肪攝入減少,肝臟脂質沉積減少,改善糖代謝[44]。還有研究[45]顯示,GLP-1上調脂肪細胞表面胰島素受體及胞內胰島素底物的數量,促進葡萄糖轉運體4(glucosetransporters 4,GLUT4)的表達,進而改善由TNFα介導的IR。
色胺是一種由產孢梭菌和胃瘤球菌產生的β-芳胺神經遞質,可誘導嗜鉻細胞釋放神經遞質5-HT[19],5-HT促進胃排空并增加飽腹感,可調節食欲、進食量及能量平衡[46]。miR-181具有控制代謝適應性、脂肪細胞功能和胰島素信號相關基因表達等功能[47]。腸道菌群-miR軸失調導致小鼠出現肥胖、IR、白色脂肪組織炎癥。吲哚會下調白色脂肪組織中miR-181的表達,減輕IR,增加能量消耗,避免肥胖的發生[47]。GLUT4是參與細胞糖代謝的關鍵分子,肥胖患者常伴有IR,可能是由于GLUT4基因表達下降,影響組織細胞對葡萄糖的轉運[40]。
綜上,色氨酸代謝產物可通過激發AMPK對脂肪的雙向調節作用、增加GLP-1釋放,調節肝臟脂質代謝、減少肥胖的發生、改善IR,降低NAFLD發生。
4.2.2 減少炎癥因子的表達、腸源性內毒素入肝,干預NAFLD的發生 TNFα是調控肝臟脂質合成的一種細胞因子。肥胖時脂肪組織和肌肉組織釋放出大量的TNFα并伴有IR[40]。TNFα通過激活脂肪分解的限速酶激素敏感性脂肪酶,使游離脂肪酸生成增加,導致肝臟內脂質沉積,為NAFLD的發生奠定了病理基礎[48]。IPA作為AHR激動劑,促進IL-10和IL-10受體表達,使IL-6、TNFα的表達降低[32],明顯改善嚙齒類動物和NAFLD患者的肝臟炎癥及脂質沉積[48]。
脂多糖(LPS)是一種位于革蘭陰性細菌細胞壁中具有生物活性的內毒素,當細菌壞死后,LPS隨血液循環入肝。LPS與肝組織Toll樣受體(TLR)結合,誘發內毒素血癥和肝臟炎癥[49]。LPS-TLR軸誘導肝巨噬細胞過度激活在NAFLD過程中起關鍵作用。NAFLD患者存在內毒素血癥[50]。一項體外實驗發現在LPS刺激前給予吲哚可減輕肝臟炎癥并改善膽固醇代謝,表明吲哚不僅能夠維持腸屏障完整性,防止腸道內毒素進入肝臟[36],同時減輕肝臟內LPS的有害作用[51]。TLR4的激活可觸發下游氨基末端激酶和核因子-κB (NF-κB)通路,促進TNFα、IL-6、IL-1β等促炎因子的分泌,在嚙齒動物模型中加速轉化為NASH[19]。肝臟慢性炎癥導致肝細胞處理脂質的能力減弱,出現脂質堆積、過氧化和肝脂肪變性,加重NAFLD。
此外,色氨酸代謝物能調節肝巨噬細胞的免疫狀態。肝臟巨噬細胞對LPS敏感性的增加可能通過增強促炎因子的釋放、免疫細胞的募集和活性氧的激活介導。IAA通過減輕氧化應激、炎癥反應、F4/80+巨噬細胞浸潤和肝臟活性氧的釋放,對肝損傷產生保護作用[51]。色胺和吲哚-3-乙酸激活AHR或上調果糖-2,6-雙磷酸酶3可降低巨噬細胞炎癥指標,減少由脂肪酸和LPS刺激生成的促炎性細胞因子,抑制細胞向趨化因子遷移,從而減輕炎癥反應[19]。
綜上,色氨酸代謝產物可通過降低TNFα、NF-κB的水平、減少腸源性內毒素、調節肝巨噬細胞的免疫,抑制炎癥反應,從而避免肝臟受到多種因素攻擊,有效預防NAFLD的發生。
5 小結與展望
NAFLD是慢性且復雜的疾病,腸道細菌數量及種類的變化、不同類群的相對豐度、其代謝功能差異及上述因素的綜合效應在NAFLD發生發展中的作用未完全闡明;遺傳背景、基因易感性對腸道菌群的影響及在NAFLD中的機制需進一步探索。腸道微生物-代謝產物-肝軸領域的大部分證據都來自動物實驗和細胞模型,具體作用機制仍在探討。不同研究中色氨酸及其代謝物在人糞便、血液和尿液中的變化存在差異,靶向腸道菌群、色氨酸代謝物治療具有潛在的臨床價值,有望成為NAFLD相關的無創生物標志物及治療靶點,未來需要更多的動物及臨床研究進行探討。
利益沖突聲明:所有作者均聲明不存在利益沖突。
作者貢獻聲明:鐘慶玲負責撰寫論文;李良平負責指導撰寫文章并最后定稿。

