葡聚糖結合蛋白的原核表達及檢測深部真菌感染的應用
朱李茹,黃友明,章宏祥,周發友,唐曉磊*
(1.湖北文理學院附屬醫院 襄陽市中心醫院 醫學檢驗部, 湖北 襄陽 441021;2.皖南醫學院第二附屬醫院 轉化醫學中心, 安徽 蕪湖 241000)
內源性和外源性的真菌侵襲并突破了機體的皮膚黏膜屏障,從而導致了深部臟器的感染統稱為侵襲性真菌感染(invasive fungal infection, IFI),其發生概率呈上升趨勢[1-2]。其主要原因大致為危險因素的增加和患者免疫力的低下,如腫瘤放化療患者、人類免疫缺陷病毒感染群體、先天性免疫功能不全者等。抗生素的不規范使用也大大增加了侵襲性真菌感染的概率,中樞神經系統的真菌感染尤為兇險[3-4],且其診斷較為困難[5]。
臨床通常以臨床癥狀結合影像學、實驗室檢查為手段對其進行鑒別。最早實驗室IFI檢查手段,如真菌培養、涂片查找真菌病原體以及通過血清學實驗查找;在2009年首次報道了PCR技術檢測真菌的實驗性研究[6]。但迄今真菌病原體的檢出周期及檢出率均不能滿足臨床的需求;此外,血清相關抗體的檢查并不能夠完全反映機體屆時的感染狀態。因此非培養的快速診斷實驗室檢測技術對IFI診斷更有意義。針對臨床真菌類型,其標志物主要分為兩類:酵母型真菌感染標志物[如:抗甘露聚糖抗體、抗酵母菌芽管抗體、核酸檢測及(1,3)-β-D-葡聚糖檢測]和曲霉菌感染標志物[如:半乳甘露聚糖、曲霉菌流式檢測、曲霉菌核酸檢測及(1,3)-β-D-葡聚糖檢測]。因此,對真菌特異性抗原的檢測臨床主要以G試驗為主[7]。然而飲食、藥物、醫療操作以及標本質量均會對G-Test法檢測結果產生較大的影響[8]。
鑒于以上所述,本研究通過基因克隆手段獲得美洲鱟來源的葡聚糖結合蛋白(glucans binding protein, GBP)的葡聚糖結合活性片段,并以其為(1,3)-β-D-葡聚糖特異性配基,從而實現對臨床體液標本中(1,3)-β-D-葡聚糖的定量[9]。旨在能夠通過免疫學手段,克服其他外界因素對(1,3)-β-D-葡聚糖檢測的影響,從而完成IFI輔助診斷。
1 材料與方法
1.1 研究對象和材料
1.1.1 研究對象: 篩選皖南醫學院第二附屬醫院2017年2月至2019年10月期間IFI患者和健康體檢人員各48名。清晨空腹用促凝管抽全血4 mL,3 500 r/min離心15 min收獲血清,冷凍于-80 ℃凍存備用。侵襲性真菌感染患者納入標準:1)近期有放化療、激素類藥物應用、侵入性治療史、免疫抑制劑應用史,且伴有高熱、寒戰等顯著感染癥狀;2)真菌培養和/或涂片呈陽性;3)G試驗陽性4)白介素6(IL-6)或降鈣素原(procalcitonin,PCT)至少1項陽性。符合上述任意3項者,臨床確診為侵襲性真菌感染[10]。本研究納入48例IFI成年患者(男/女=15/9、年齡分布為29~73歲),其中36例來源于呼吸系統患者,9例來源于腫瘤放化療患者;3例來源于燒傷患者。
1.1.2 試劑:pET30a-GBP252-668質粒合成于上海生物工程公司;大腸桿菌BL21(DE3)菌株由本實驗室保存;(1,3)-β-D-葡聚糖(Elicityl公司);抗組氨酸標簽單克隆抗體(北京中杉金橋生物公司);辣根過氧化物酶標記試劑盒、無蛋白封閉液、TMB顯色液和終止液(濟南泰天和生物公司);Ni-agarose純化柱(QIAGEN公司);十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝膠制備試劑盒和卡那霉素(kanamycin,Kan)(北京索萊寶科技有限公司);蛋白分子質量marker和DNA梯度marker[賽默飛科技(中國)有限公司];苯甲基磺酰氟(PMSF)和蛋白酶抑制劑cocktail,異丙基-β-d-硫代半乳糖苷(isopropyl-β-d-thiogalactoside, IPTG)(阿拉丁生化科技股份有限公司);其余化學試劑(國藥化工集團公司)。
1.2 方法
1.2.1 GBP252-668表達質粒的鑒定: 根據質粒信息,使用NedⅠ和HindⅢ雙限制性快速內切酶對pET30a-GBP252-668酶切進行鑒定,總反應體積20 mL,體系如下:pET30a-GBP252-668質粒10 mL,NedⅠ和HindⅢ限制性內切酶各1 mL,10×緩沖液2 mL,dd H2O 6 mL;于37 ℃水浴10 min,95 ℃ 5 min加熱終止反應,行1%瓊脂糖凝膠電泳鑒定。同時將pET30a-GBP252-668質粒行測序鑒定。
1.2.2 GBP252-668蛋白的表達及純化: 將表達質粒轉入大腸桿菌BL21,42 ℃水浴90 s熱沖擊,通過卡那霉素(kanamycin, Kan)抗性LB固體培養基篩選并挑取陽性單克隆接種于液體LB培養基5 h后,加入IPTG濃度0.8 mmol/L,25 ℃ 誘導過夜;10 000×g,離心15 min獲得菌體,預冷無菌PBS洗滌菌體2次,離心收集菌體。-80 ℃凍融2~3次,加入溶菌酶至終濃度10 mg/mL,4 ℃過夜, 超聲裂菌10 min。4 ℃ 10 000×g離心30 min收集上清,行SDS-PAGE分離后考馬斯亮蘭染色鑒定。將裂解的上清與Ni-NAT純化柱置于4 ℃混勻器上連續混勻2 h,期間加入苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)和蛋白酶抑制劑Cocktail。結合后的Ni-NAT純化柱依次分別使用咪唑緩沖液(含咪唑濃度20、30、50、80、200 mmol/L)進行洗滌、洗脫。洗脫液再次經SDS-PAGE分離后行考馬斯亮蘭染色鑒定。
1.2.3 GBP雙夾心法的體系構建: 將獲得的高純度GBP252-668蛋白精確定量后行辣根過氧化物酶標記。以不同濃度的GBP包被和不同濃度的GBP-HRP進行檢測。以含10% DMSO的PBS溶液為陰性對照;將(1,3)-β-D-葡聚糖用含10%二甲基亞砜磷酸鹽緩沖液稀釋至200 ng/L作為陽性對照。將測得的包被濃度(coatingconcentration, CC)和檢測濃度(detection concentration, DC)構建的GBP252-668雙夾心法用于人血清基質的檢測,即以健康人血清作為陰性標本,以加入終濃度200 ng/L(1,3)-β-D-葡聚糖的健康人血清作為陽性標本,作6個復孔,驗證本實驗所建立的方法學的檢測效能。
1.2.4 兩種方法臨床檢測效能比對: 將96份人血清標本分別行GBP252-668雙夾心法檢測和G-Test檢測。GBP252-668雙夾心法同時設置5個濃度梯度:0、50、100、200和400 ng/L,作標準曲線。并對雙夾心法與G-Test法測得的(1,3)-β-D-葡聚糖結果使用ROC曲線分析其檢測效能。
1.3 統計學分析
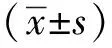
2 結果
2.1 GBP表達質粒的鑒定
重組質粒pET30a-GBP252-668雙酶切產物,兩條條帶分別依次位于1 000 bp與2 000 bp之間以及5 000 bp與6 000 bp之間,與插入目的基因大小(1 251 bp)和pET30a載體片段(5 422 bp)大小相符,見圖1。測序結果與Genbank (編號為:NM_001314167.1)比對完全一致,無錯配、突變。

1.plasmid pET30a-GBP252-668; 2.plasmid pET30a-GBP252-668 was digested by restriction enzyme Ned Ⅰ and Hind Ⅲ; M.DNA marker圖1 GBP重組表達質粒pET30a-GBP252-668的雙酶切鑒定Fig 1 Identification of recombinant plasmid pET30a- GBP252-668 using restriction enzyme digestion
2.2 重組GBP252-668蛋白的表達及純化
經IPTG誘導表達,在分子質量40 ku與50 ku之間有一條顯著高表達蛋白條帶,與預測重組目的蛋白分子質量46 774(約46.77 ku)相符(圖2);經Ni-agarose純化,獲得了純度較高的重組GBP蛋白(圖3);經由抗-His標簽單克隆抗體檢測,在40 ku與50 ku之間有條帶(圖4)。

M.protein marker; 0.the E.coli BL21 containning recombinant plasmid pET30a-GBP252-668 was induced without IPTG; 1.the E.coli BL21 containning recombinant plasmid pET30a-GBP252-668 was induced with IPTG at 25 ℃ for 16 hours; 2.the E.coli BL21 containning recombinant plasmid pET30a-GBP252-668 was induced with IPTG at 37 ℃ for 16 hours; arrow indicated the recombinant target protein圖2 SDS-PAGE分析重組GBP252-668蛋白的表達Fig 2 Analysis of recombinant GBP252-668 protein expression by SDS-PAGE

M.protein marker; 1.the supernatant of lysis bacteria with IPTG-induced at 25 ℃ for 16 hours; 2.the residual from lysis bacteria with IPTG-induced was affinity by Ni-agarose; 3, 4, 5, 6 and 7.the supernatant of Ni-agarose were washed with different concentrations of imidazole buffer in turn, 20, 30, 50, 80, and 200 mmol/L; arrow indicated the recombinant target protein圖3 十二烷基硫酸鈉聚丙烯酰胺凝膠電泳分析純化的重組GBP252-668蛋白Fig 3 Analysis of purified recombinant GBP252-668 protein by SDS-PAGE

圖4 免疫印跡法分析純化的重組GBP252-668蛋白Fig 4 Analysis of purified recombinant GBP252-668 protein by Western blot
2.3 GBP雙夾心法體系的構建
棋盤法顯示,其最佳包被GBP濃度和HRP標記的GBP工作液分別為 0.8 g/L和1.6 g/L(表1);該方法對以人血清作為基質的陰性標本和陽性標本進行檢測,數據顯示其陽性標本與陰性標本吸光度值(absorbance,A)比值約為7,能夠顯著區分陰性與陽性(圖5)。
2.4 兩種方法的臨床檢測效能比對
通過制定標準曲線擬合算法,對待測標本中的(1, 3)-β-D-葡聚糖定量分析(圖6);納入48名IFI患者和48名健康人作為待測對象(表2);兩種方法檢測結果使用ROC曲線進行擬合,算得GBP雙夾心法其靈敏度(sensitivity)和特異度(specificity)分別為91.67%(95%CI:80.02%~97.68%)和89.58%(95%CI:77.34%~96.53%);G試驗的敏感性和特異性分別為91.67%(95%CI:80.02%~97.68%) 和79.17%(95%CI:65.01%~89.53%);GBP雙夾心法ROC曲線面積為0.9282(95%CI:0.8679~0.9884);G試驗的ROC曲線面積為0.9128(95%CI:0.8548~0.9695)(圖7)。
3 討論
近年來,臨床深部真菌感染日益嚴重,真菌培養、涂片是IFI的實驗診斷金標準,但由于周期較長且標本的獲取不易或容易污染,因此以(1,3)-β-D-葡聚糖為標志物的G-Test目前應用更為廣泛[11-13]。眾所周知,(1,3)-β-D-葡聚糖是絕大多數真菌細胞壁的主要骨架成分(新型隱球菌屬、毛口菌屬除外),隨著真菌的分裂生長及機體吞噬細胞的吞噬消化,其骨架成分被釋放入血,對外周血中(1,3)-β-D-葡聚糖檢測可以作為深部真菌感染的輔助診斷指標。目前G-Test法通過動態濁度的變化推算(1,3)-β-D-葡聚糖含量。而這一級聯催化過程以及待測標本的質量嚴重影響檢測結果。鑒于G-Test檢測手段的不足,本研究通過克隆表達(1,3)-β-D-葡聚糖的特異性配基——GBP252-668蛋白,利用該配基與靶標(1,3)-β-D-葡聚糖的特異性識別與結合能力進行血清學檢測,以評估機體侵襲性真菌感染狀況。葡聚糖結合蛋白(GBP)為一類能夠特異性結合葡聚糖的蛋白的統稱。有研究表明不同物種來源的GBP能夠高效識別并結合不同結構的葡聚糖[14]。在我們前期的預實驗中發現,美洲鱟的GBP較之其他物種的GBP顯示出較高的結合力。分析美洲鱟來源的GBP mRNA編碼668個氨基酸肽鏈,其包含3個區域:第1位氨基酸到第20號氨基酸為信號肽;第27位氨基酸到第253號氨基酸為葡聚糖水解酶活性片段;第252位氨基酸到第668號氨基酸為葡聚糖活性結合片段。因此本研究純化獲得了重組GBP252-668 蛋白并構建雙GBP夾心法檢測系統,其具有高檢測靈敏度、寬線性范圍等特點。

表1 棋盤法確立雙GBP夾心法的包被和檢測試劑工作濃度Table 1 Concentrations of GBP for coating and detection were established by chessboard method

表2 納入研究對象的96名人員的基本信息比較Table 2 Comparison of basic information from 96 donors in this research

*P<0.01 compared with blank control圖5 構建的GBP雙夾心法對血清基質中(1,3)-β-D-葡聚糖的分析Fig 5 Analysis of (1,3)-β-D-glucans in serum matrix

圖6 GBP雙夾心法測定血清 (1,3)-β-D-葡聚糖標準曲線Fig 6 Stander curve of (1,3)-β-D-glucans in serum using GBP sandwich method n=6)

圖7 兩種方法對96例血清(1,3)-β-D-葡聚糖檢測效能的ROC曲線Fig 7 ROC of two methods for (1,3)-β-D-glucans detection efficiency n=96)
本研究使用該方法和G-Test法對臨床血清標本進行檢測的性能比對,結果顯示兩種方法的靈敏度較為一致,而夾心法特異度高于臨床現行的G-Test法。分析可能原因如下[8]:1)原理:夾心法的特異性優于級聯催化法;2)血清標本的質量對夾心法影響較小;3)特定結構的靶標物質使配基法檢測更為特異;4)本次探索的夾心法操作步驟簡單,極大減少了操作過程中的誤差。
(1,3)-β-D-葡聚糖作為目前深部真菌感染公認的標志物,其在臨床確診前提前5~10 d檢測出陽性[15-16],且當病情惡化為嚴重膿毒癥時,這一過程中該標志物的水平會持續升高。這一現象提示了對(1,3)-β-D-葡聚糖的動態監測,或可用于監測臨床深部真菌感染的治療效果。而本次研究所入選研究對象均為嚴重深部真菌感染的患者,其病程長短不一,因此本次無法精確評估該系統預測真菌感染的價值。本方法檢測的入選研究對象(IFI患者和健康體檢者),其靈敏度和特異度分別為91.67%(95%CI:80.02%~97.68%)和89.58%(95%CI:77.34%~96.53%),ROC曲線面積為0.9282(95%CI:0.8679~0.9884)。特異度高于本次檢測的G-Test法。同比國外學者報道的G-Test法,均有所增高[17]。
綜上所述,本研究初步實現了通過分子克隆技術模擬美洲鱟體內天然存在的特異性葡聚糖識別配基,并驗證該重組配基具有識別、結合(1,3)-β-D-葡聚糖的能力,并應用于臨床標本檢測。本次實驗所構建檢測方法,有望開發為一種新型的侵襲性真菌感染的檢測試劑盒,進而為臨床IFI鑒別診斷提供數據支持。

