2型糖尿病人群心血管危險因素與頸動脈內中膜厚度的關系
劉彬彬 馬寧 賈曉嬌 王曉明 王赫楠 王菲 陸強
大血管病變是糖尿病病程發展的主要結局,糖尿病患者心腦血管疾病的高發病率和死亡率與動脈粥樣硬化(atherosclerosis,AS)有關,動脈粥樣硬化是其血管病變的病理基礎[1]。動脈硬化的發生、發展過程緩慢,早期不易被發現,動脈血管壁功能和結構的改變在血糖升高的早期就已發生[2]。頸動脈硬化可間接反映冠狀動脈、腦動脈及其他部位動脈硬化的程度和范圍[3],頸動脈內中膜厚度(cIMT)增厚可作為早期動脈硬化的判定標準[4],可預測糖尿病患者心腦血管疾病發生的概率,早期篩查cIMT對于糖尿病患者減少心腦血管并發癥具有重要的臨床意義。目前已知的動脈硬化危險因素包括血糖、血壓、血脂、血尿酸、吸煙、飲酒、肥胖,尤其腹型肥胖等[5]。本研究將重點討論,不同時點的血糖以及哪種肥胖參數對cIMT的影響更大,以便為動脈硬化疾病的防治提供依據。
1 資料與方法
1.1 一般資料 納入2020年11月至2021年3月在秦皇島市第一醫院內分泌科住院的2型糖尿病患者82例(2型糖尿病組),非糖尿病健康對照人群171例,來自同期本院體檢中心體檢人群,年齡20~62歲。排除標準:惡性腫瘤、血液系統疾病、急慢性感染性疾病、嚴重心肝腎功能不全、應激情況、已明確的心血管疾病及應用他汀類藥物患者、糖尿病急性并發癥及其他內分泌代謝性疾病。本研究經秦皇島市第一醫院倫理委員會批準,受試對象均簽署知情同意書。
1.2 分組 (1)根據是否診斷為糖尿病分為2型糖尿病組和對照組。糖尿病診斷參照《中國2型糖尿病防治指南2020年版》[6](FPG≥7.0 mmol/L、OGTT 2 h血糖≥11.1 mmol/L以及既往診斷2型糖尿病患者),對照組按照有無糖尿病史行饅頭餐試驗或75 g口服葡萄糖耐量試驗除外糖尿病。(2)依據內臟脂肪面積是否≥100 cm2將2型糖尿病患者分為肥胖組與非肥胖組,肥胖組59例,非肥胖組23例[7]。(3)將2型糖尿病患者根據2009年《血管超聲檢查指南》[8]標準: cIMT≥1 mm為頸動脈內膜增厚;局限性cIMT≥1.5 mm 定義為頸動脈斑塊,分為增厚組和非增厚組。
1.3 方法 (1)由經過培訓合格的研究者應用標準技術方法測量身高、體重、血壓。每位受試者靜坐休息15 min后測量坐位血壓。測量體重時只穿內衣、脫鞋,精確至 0.1 kg;測量身高時脫鞋,應用測距儀,精確至0.1 cm,并計算體重指數(BMI)。記錄吸煙史、飲酒史。測量臀圍、頸圍、腰圍,腰圍測量:腋中線肋弓下緣與髂棘連線中點水平。(2)受試者禁食水8 h后行OGTT(空腹口服75 g無水葡萄糖,溶于250~300 ml水中,5~10 min內飲完),分別于空腹及服糖后0.5 h、1 h、2 h、3 h采集肘靜脈血,測定空腹、0.5 h、1 h、2 h、3 h血糖及胰島素,檢測三酰甘油(TG)、膽固醇(TC)、高密度脂蛋白膽固醇(HDL-c)、低密度脂蛋白膽固醇(LDL-c)、尿酸(UA)、糖化血紅蛋白(HbA1c)。(3)腹內脂肪的測量:所有受試者于空腹狀態下由專人采用GE公司(Signa EXCITE 1.5 THD Echo Speed) MRI進行腹部掃描,仰臥位體位,取得屏氣狀態下腰椎4/5范圍內的脂肪組織圖像,利用腹內脂肪分割系統(GE Healthcare AW Volume viewer 3.1)量化內臟脂肪面積(cm2)。(4)頸動脈內中膜厚度測量:采用PHILIPS IU22型彩色超聲診斷儀,探頭頻率為8~12 MHz。自頸動脈起始處縱向掃查,依次探測雙側頸總動脈、頸總動脈分叉部、頸內動脈和頸外動脈,二維圖像觀察血管壁、管徑、內中膜厚度、有無斑塊形成,測量部位在頸總動脈分叉點水平,頸總動脈選擇近心端距分叉部約1 cm 處,獲清晰血管圖像后,于舒張末期測定cIMT厚度,雙側取平均值。
2 結果
2.1 不同組別臨床資料和血生化指標比較
2.1.1 2型糖尿病與非糖尿病人群比較,年齡、吸煙史、飲酒史、1 h胰島素、有無斑塊差異無統計學意義(P>0.05)。收縮壓、舒張壓、體重、BMI、臀圍、腹圍、頸圍、血糖(空腹、0.5 h、1 h、2 h、3 h)、胰島素(空腹、0.5 h、2 h、3 h)、HbA1c、UA、TC、TG、LDL-c、內臟脂肪面積、cIMT均高于對照組(P<0.05),HDL-c低于對照組(P<0.05)。見表1。
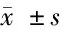
表1 2型糖尿病組與對照組人群各指標水平比較
2.1.2 2型糖尿病人群中,與非肥胖組人群比較,肥胖人群的收縮壓、舒張壓、體重、BMI、臀圍、腹圍、頸圍、1 h血糖、胰島素(空腹、1 h、3 h)、UA、TG、內臟脂肪面積、cIMT均增高,HDL-c減低(P<0.05)。2組比較,血糖(空腹、0.5 h、2 h、3 h)、胰島素(0.5 h、2 h)、HbA1c、TC、LDL-c、有無斑塊差異無統計學意義(P>0.05)。見表2。
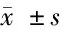
表2 2型糖尿病人群中肥胖與非肥胖組各指標水平比較
2.1.3 2型糖尿病人群中,與非增厚組相比,增厚組收縮壓、體重、血糖(1 h、3 h)、胰島素(空腹、1 h)、HbA1c、UA、有無斑塊比例均增高(P<0.05),余項指標差異無統計學意義(P>0.05)。見表3。
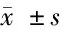
表3 2型糖尿病人群中增厚組與非增厚組各指標水平比較
2.2 單因素相關分析結果顯示 2型糖尿病人群中體重、BMI、臀圍、腹圍、頸圍、內臟脂肪面積、各時點血糖(空腹、0.5 h、1 h、2 h、3 h)均與頸動脈內膜厚度呈正相關(P<0.001),但各時點胰島素(空腹、0.5 h、1 h、2 h、3 h)水平與cIMT無關(P>0.05)。見表4。
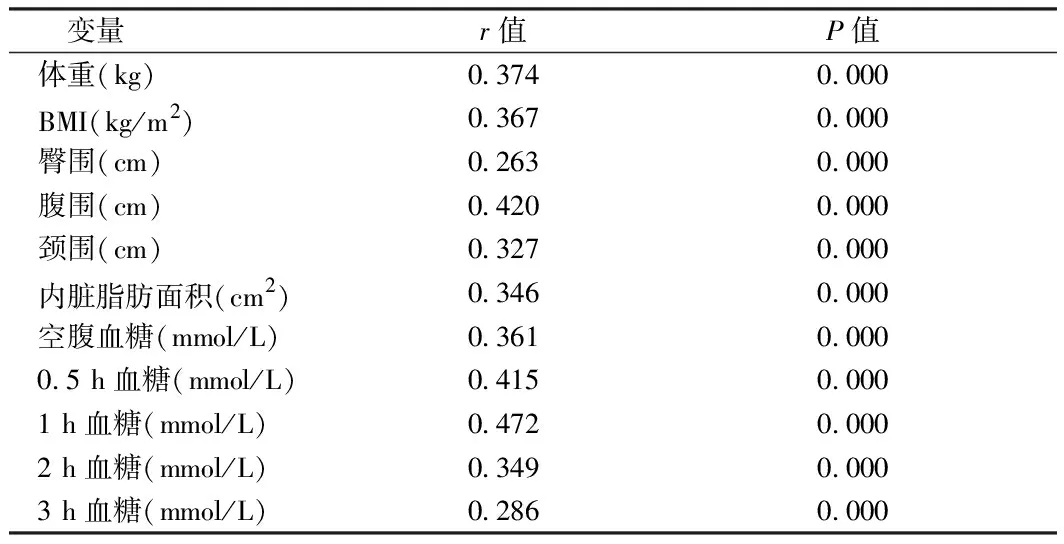
表4 2型糖尿病人群不同時點血糖及不同肥胖指標與頸動脈內膜厚度的單因素相關分析
2.3 多元線性回歸分析結果
2.3.1 以cIMT為因變量,校正年齡、吸煙史、飲酒史,以各時點血糖(空腹、0.5 h、1 h、2 h、3 h)為自變量的多元線性回歸分析結果顯示,各時點血糖比較,1 h血糖對cIMT的影響更大。回歸方程:R2=0.234,F=71.992,P=0.000。見表5。

表5 多元線性回歸分析
2.3.2 以cIMT為因變量,校正年齡、吸煙史、飲酒史,以體重、BMI、頸圍、腰圍、臀圍、腹部脂肪面積為自變量的回歸分析結果顯示,不同肥胖參數比較,內臟脂肪面積對cIMT的影響更大。回歸方程:R2=0.211,F=19.493,P=0.001。見表6。

表6 多元線性回歸分析
3 討論
在全球范圍內,大約32.2%的2型糖尿病患者受心血管疾病的影響[9]。與非糖尿病人群相比,糖尿病患者死亡和心血管風險明顯增加[10,11]。心血管疾病是2型糖尿病患者死亡的首要原因,其病理生理基礎是動脈粥樣硬化性病變。CIMT已被作為早期AS及心血管疾病檢測的首要指標,尤其是對無癥狀而存在心血管疾病危險因素的2型糖尿病患者[12]。早在血糖升高初期,較之正常糖耐量人群,空腹血糖受損者就已經具有伴隨一生的心血管事件風險,特別是在男性中,風險可與2型糖尿病患者一致。在此基礎之上,超重和肥胖更增加了這一風險[13]。因此,早期發現和預防糖尿病患者動脈粥樣硬化對于降低糖尿病大血管并發癥的風險至關重要。
我們在2型糖尿病和健康對照組之間對比了血壓、血脂、尿酸、各時點血糖和胰島素、一些肥胖指標、CIMT等,均有異常表現。單因素相關分析結果顯示,2型糖尿病人群中體重、BMI、臀圍、腹圍、頸圍、內臟脂肪面積、各時點血糖(空腹、0.5 h、1 h、2 h、3 h)水平均與cIMT呈正相關(P<0.001),但各時點胰島素(空腹、0.5 h、1 h、2 h、3 h)水平與cIMT無關(P>0.05)。
高血糖不斷激活炎癥細胞,附著在血管內皮細胞引起血管內皮損傷,刺激血管內皮不斷變得不光滑和增厚[14]。空腹血糖和餐后2 h高血糖與糖尿病慢性并發癥關系密切,是目前使用的診斷治療糖尿病的國際指導方針。但新近一項Meta分析研究發現,餐后血糖與CIMT關系更密切,與不利的心血管結局相關,與空腹血糖關系不大[15]。本研究在校正了年齡、吸煙史、飲酒史后,以糖尿病人群各時點血糖為自變量比較,發現糖負荷后1 h血糖(1hPG)對cIMT的影響最大,與Esposito等[16]的研究一致,并且Succurro等[17]提出甚至在糖耐量正常階段,糖負荷后1 h血糖 (1hPG)就可識別早期動脈粥樣硬化,較之2 h血糖更加敏感。
一項在歐洲長達10年的大樣本前瞻性研究表明內臟脂肪是心血管疾病風險升高的獨立危險因素,特別是在男性[18]。相比于內臟脂肪面積,其他肥胖簡易測量指標如體重、BMI、腰圍、臀圍、頸圍、腰臀比、腰圍身高比值等均對于預測CIMT有一定貢獻或與之相關,對此眾說紛紜,見仁見智。BMI作為傳統分類肥胖的簡易指標,在對CIMT的影響并非直接,而是通過其他危險因素來間接影響CIMT[19]。有研究顯示腰圍在預測CIMT方面比其他肥胖參數更敏感[20],Gayathri等[21]的研究認為腰臀比與CIMT呈顯著正相關。本研究多元線性回歸分析認為腹內脂肪面積與其他肥胖參數相比較,對于CIMT的影響更大。
肥胖和高血糖對CIMT影響的分子機制尚未明確。從內皮的角度來看,肥胖人群一氧化氮(NO) 的低水平生物利用度會導致內皮依賴的血管舒張的損傷,隨之內皮型一氧化氮合酶(eNOS) 改變,氧化應激、炎癥增強,動脈粥樣硬化負擔增加[22]。肥胖人群脂肪組織釋放大量的游離脂肪酸(NEFAs),激素,促炎細胞因子,導致胰島素抵抗,抑制葡萄糖運輸和磷酸化。增加的NEFAs提供了激活絲氨酸/蘇氨酸激酶級聯反映的基礎(由脂肪酸代謝產物誘導如神經酰胺、甘油二酯、脂酰輔酶A),導致胰島素受體底物1和2 (IRS-1和IRS-2)的磷酸化。這些受體底物可以激活磷酸肌醇3-激酶(PI3K)/蛋白激酶B(AKT)/eNOS通路,減少胰島素受體信號傳導,并且減弱葡萄糖運輸。高血糖狀態會抑制內皮細胞胰島素與胰島素受體結合,激活轉導的方式是促動脈粥樣硬化效果而不是拮抗該反應。
在高血糖和胰島素刺激下的內皮細胞,促動脈粥樣硬化的通路似乎更容易激活。事實上,由AKT活化的eNOS在Ser1177位點的磷酸化,導致了NO的生成,但也激活了磷酸化SHC轉運蛋白的磷酸化,從而激活 MAPK通路,導致內皮素1 (ET-1)表達增加,影響有絲分裂,細胞增殖[23]。
基于上述多重發病機制,糖尿病患者的臨床管理不能局限于血糖的控制,而更應著眼于心血管等獲益方向,在控制血糖的同時,控制頸動脈粥樣硬化病變進展,使相關不良事件的發生率下降。目前大量試驗已證實GLP-1Ra可通過抑制單核細胞粘附內皮血管、阻滯巨噬細胞浸潤、減緩血管損傷后的內膜增厚、對動脈粥樣硬化的病理過程產生影響,使心血管獲益[18-21]。此外,SGLT-2抑制劑,前蛋白轉化酶枯草溶菌素9(PCKSK9)抗體,RNA治療,針對不同組件免疫炎性反應的藥物制劑,和阻斷RAGE信號通路的新型小分子藥物,也將會是具有潛力的糖尿病和心血管疾病新療法[24]。

