宮頸癌手術患者FOXF2與凋亡基因表達的相關性及意義
謝加瓊 徐蕾 何蔚
宮頸癌是女性最常見的惡性腫瘤性疾病之一,其惡性程度較高、符合手術指征的患者術后復發轉移率不低[1,2]。積極尋找宮頸癌患者手術后復發的機制并降低復發轉移率是目前臨床研究的重點之一。siRNA干擾叉頭框轉錄因子F2(FOXF2)是FOX轉錄因子家族的重要成員之一,發現其與胚胎及組織發育、上皮間質轉化等相關,通過調節細胞極性而維持組織穩態[3,4],其在不少腫瘤組織中呈低表達并加快腫瘤發生發展。FOXF2與宮頸癌的研究也有部分開展,如細胞研究發現siRNA干擾FOXF2可促進SiHa細胞的體外轉移及增殖能力[5],提示低表達的FOXF2促進宮頸癌進展。本次研究討論FOXF2與宮頸癌手術預后的關系,旨在為后續宮頸癌患者的預后早期評估及干預等提供新途徑。
1 資料與方法
1.1 一般資料 選取2017年1月至2019年1月在西南醫科大學附屬醫院和成都醫學院第一附屬醫院接受手術治療的118例宮頸癌患者的組織標本為宮頸癌組,年齡38~72歲,平均(53.34±15.28)歲。同期100例宮頸息肉患者行息肉切除術并將其宮頸組織標本作為對照組,年齡37~67歲,平均(52.39±12.27)歲。2組患者的性別比、年齡差異無統計學意義(P>0.05),具有可比性。術中所有組織標本凍存于液氮罐中保存,術前告知患者相關事宜并簽署知情同意書,研究方案獲本院倫理委員會審核批準。
1.2 納入與排除標準
1.2.1 納入標準:①宮頸癌病灶組織標本均術后病理證實為原發性宮頸癌;②術前未接受放化療等保守治療;③臨床資料完整且完成隨訪。
1.2.2 排除標準:①合并其他原發惡性腫瘤性疾病;②合并嚴重自身免疫性疾病者;③合并嚴重心肝腎功能不全者;④妊娠或者哺乳期女性。
1.3 qRT-PCR法測定宮頸組織中FOXF2與凋亡基因表達量 將病灶組織剪碎、碾磨并加入細胞裂解液,提取總RNA。參照逆轉錄試劑盒說明逆轉錄為互補cDNA,以U6為內參設計引物、使用SYBR Green Master Mix試劑盒對目標基因引物在PCR儀96微孔板上進行擴增。引物序列如下:U6上游引物5’-CGCGCAACGGAATCCCA-3’,下游引物5’-GTGCAGG
GTCCGAGGT-3’; FOXF2上游引物5’-TCGAAGCTGA
CCTGAAGTG-3’,下游引物5’-TCAAGCTGCTGAGCTG
AG-3’;Caspase-3上游引物5’-CTAGCTAAGCTGAGCG
TGA-3’,下游引物5’-TCGAAGCTGACGTGAGTCGA-3’;Bax上游引物5’-TCGAAGCTAGCTGAGCTGA-3’, 下游引物5’-AGCTGAGCTTAGCGTAG-3’; Bcl-2上游引物5’-ACTGAGCGGATGCGGTAG-3’, 下游引物5’-TCGAATCGAGCTGGAATCG-3’。反應條件:95℃預變性5min→94℃變性30 s→58℃退火30 s,共38個循環。
1.4 預后隨訪 術后第2天開始對所有入組的宮頸癌患者進行長期隨訪,具體隨訪方式包括門診復診及電話,隨訪內容包括B超、腫瘤標志物、宮頸檢查等,以2021年1月或者該日期前患者確診復發轉移的時間作為隨訪終點,記錄患者的無病生存率(DFS)。
1.5 臨床資料收集 收集所有入組宮頸癌患者的臨床資料,包括年齡、月經狀態、腫瘤直徑、組織學分類、FIGO分期、分化程度、肌層浸潤、脈管侵犯、淋巴結轉移。
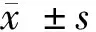
2 結果
2.1 2組組織中FOXF2及凋亡基因表達量比較 宮頸癌組病灶組織中FOXF2、Caspase-3、Bax mRNA的表達量低于對照組正常組織,Bcl-2 mRNA的表達量高于對照組正常組織,差異均有統計學意義(P<0.05)。見表1。
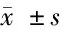
表1 宮頸癌組、對照組組織中FOXF2及凋亡基因表達量比較
2.2 宮頸癌病灶組織中FOXF2及凋亡基因表達量的相關性分析 Pearson檢驗顯示,宮頸癌病灶組織中FOXF2 mRNA表達量與Caspase-3、Bax mRNA的表達量呈正相關(P<0.05),與Bcl-2 mRNA的表達量呈負相關(P<0.05)。見表2。

表2 FOXF2 mRNA與Caspase-3、Bax及Bcl-2 mRNA表達量的相關性
2.3 宮頸癌患者無病生存率與FOXF2表達的關系 118例宮頸癌患者隨訪期出現復發轉移36例并歸于復發轉移組,其余82例歸于未復發轉移組。復發轉移組病灶組織中FOXF2 mRNA的表達量為(1.65±0.21)、未復發轉移組病灶組織中FOXF2 mRNA的表達量為(1.83±0.24)。復發轉移組病灶組織中FOXF2 mRNA的表達量低于未復發轉移組,差異有統計學意義(P<0.05)。根據所有宮頸癌患者病灶組織中FOXF2 mRNA表達量的中位數1.69,將其分為高FOXF2組、低FOXF2組各59例。高FOXF2組的中位無病生存時間為38個月、低FOXF2組的中位無病生存時間為32個月。Kplan-Meier生存曲線顯示,高FOXF2組患者的無病生存情況優于低FOXF2組患者(P<0.05)。見圖1。

圖1 FOXF2表達水平與宮頸癌患者無病生存時間的關系
2.4 宮頸癌患者術后復發轉移的單因素分析 復發轉移組、未復發轉移組患者的年齡、月經情況、腫瘤直徑、組織學分類的分布差異無統計學意義(P>0.05);FIGO分期、分化程度、肌層浸潤、脈管侵犯、淋巴結轉移、FOXF2表達量的分布差異有統計學意義(P>0.05)。見表3。

表3 宮頸癌患者術后復發轉移的單因素分析 例
2.5 宮頸癌患者術后復發轉移的COX回歸分析 以宮頸癌患者術后復發轉移情況作為終點事件(0=未復發轉移,1=復發轉移),將單因素分析中具有差異的指標包括FIGO分期、分化程度、肌層浸潤、脈管侵犯、淋巴結轉移、FOXF2表達量納入COX回歸模型進行危險因素分析,結果顯示:FIGO分期Ⅲ期、低分化、肌層浸潤、脈管侵犯、淋巴結轉移、組織中FOXF2表達量低表達是宮頸癌患者術后復發轉移的獨立危險因素(P<0.05)。見表4。

表4 宮頸癌患者術后復發轉移的COX回歸分析
3 討論
宮頸癌侵襲性較強,研究顯示存在盆腔轉移的宮頸癌患者術后復發率高達70%[6,7]。FOXF2屬于間質特異性轉錄因子,在泌尿道、消化道、呼吸道等器官高表達并參與細胞外基質合成等多個生命過程,其在多個惡性腫瘤組織中均存在異常表達,如魯昌坤等[8]的研究發現FOXF2轉錄因子通過抑制p21Cip1 CDK調控早期胃癌能量代謝;王云檢等[9]指出miRNA-182可通過靶向調控FOXF2促進肝細胞癌細胞的侵襲轉移。基礎研究初步明確FOXF2參與宮頸癌的發生發展[5],文中檢測宮頸癌組織及良性宮頸組織中FOXF2及凋亡基因的表達情況,發現宮頸癌組織中FOXF2表達下調、與既往研究結論吻合;促凋亡基因Caspase-3、Bax表達下調而抗凋亡基因Bcl-2表達上調,這與惡性腫瘤細胞程序性凋亡進程受阻的特點吻合。相關性分析更指出,宮頸癌組織中FOXF2表達量與促凋亡基因表達量呈正相關,與抗凋亡基因表達量呈負相關,提示FOXF2基因表達下調可能通過減輕對凋亡基因的表達調控最終促進腫瘤進展。
宮頸癌患者術后復發轉移情況與其最終死亡結局密切相關,在分析術中宮頸癌組織FOXF2表達與患者無病生存情況的關系中發現,FOXF2低表達宮頸癌患者的無病生存時間相對較短,提示FOXF2表達情況與宮頸癌患者的術后復發轉移間存在一定關系。宮頸癌患者的術后復發轉移是一個復雜的多因素參與的過程,既往關于其復發危險因素的分析已經開展較多,文中再次將包括宮頸癌組織FOXF2表達量在內的臨床資料納入COX回歸模型,分析發現:組織中FOXF2表達量低表達、FIGO分期Ⅲ期、低分化、肌層浸潤、脈管侵犯、淋巴結轉移是宮頸癌患者術后復發轉移的獨立危險因素。FOXF2表達量對宮頸癌復發轉移的影響與王慶偉等[10]的研究結果相似,其認為FOXF1在乳腺癌組織中低表達可能與患者預后有關。關于組織中FOXF2表達量低表達誘導宮頸癌患者術后復發轉移的具體機制不明,Liu等[11]的研究指出FOXF2通過Wnt/β-catenin信號通路抑制TGF-β1誘導的人原代子宮內膜基質細胞纖維化。組織中低表達的FOXF2可能也通過上述相似途徑影響術后微小殘留癌細胞的復發轉移并最終左右生存結局。He等[12]的研究顯示多種因素可調節FOXF2水平,調節FOXF2水平是治療腫瘤的理想化方法,關于FOXF2調控在后續宮頸癌治療及預后改善中的作用研究有待后續研究明確。FIGO分期、低分化、肌層浸潤、脈管侵犯、淋巴結轉移等臨床病理特征對宮頸癌患者術后復發轉移的影響已在既往較多研究[13]中被明確,本文結果與其一致。
綜上所述,宮頸癌患者術中病灶組織中FOXF2低表達,可能通過影響凋亡基因表達而促進患者術后復發轉移。FOXF2基因在后續宮頸癌預后優化中的實踐價值有待更多研究明確。

