上調miR-210對糖尿病足模型大鼠的干預效果及作用機制研究
聶興 王雪鷹 安靜思
糖尿病足屬于糖尿病中一種嚴重的慢性并發癥,主要是由于糖尿病導致患者血管、神經發生病變,因此增加了治療的難度[1]。有研究指出,在糖尿病足發病過程中,創面組織中的氧化應激、炎性反應會被持續激活,影響創面修復,也是導致糖尿病足患者久病不愈的主要原因,嚴重的會造成患者截肢[2,3]。目前臨床中關于糖尿病足的發病機制尚不明確。微小核糖核酸(miRNA)屬于一種高度保守的非編碼小分子RNA,在血管新生調節中起到重要的參與作用。有研究指出,miR-210過表達有助于毛細血管狀結構產生,通過介導血管內皮生長因子(VEGF)有助于內皮細胞遷移[4]。目前臨床中治療糖尿病足主要通過全身綜合治療原則,給予擴血管、抗凝、降糖、抗菌、改善微循環等,必要情況下進行介入治療以及骨髓造血干細胞移植等,雖然取得的治療效果顯著,能降低患者的致殘率和致死率,但是產生的不良反應較多[5,6]。本文研究上調miR-210對糖尿病足模型大鼠的干預效果及相關作用機制。
1 材料與方法
1.1 材料 選取健康、清潔級SD雄性大鼠40只,體重220~260 g,均由河北醫科大學提供,動物合格證號:SYXK(冀)2020-002。鼠齡為6~8周。所有大鼠給予常規飼養,自由飲水,黑/白光照交替12 h,溫度為20~25℃,濕度為40%~50%。
1.2 方法
1.2.1 糖尿病足模型建立:40只大鼠隨機選取10只為空白組,剩余30只參考唐乾利等[7]建立糖尿病足模型,采用1%的STZ(60 mg/kg)給予腹腔注射,建立糖尿病模型,1周后大鼠血糖>16.7 mmol/L說明模型建立成功,成功27只。使用圖章在空白組和模型組大鼠足部部位印矩形標記(3 mm×7 mm),使用剪刀將大鼠全層皮膚剪除后,剪至筋膜,建立糖尿病足模型。
1.2.2 分組及干預:27只模型大鼠隨機分為模型組、陰性對照組、miR-210上調組,每組9只。miR-210上調轉染miR-210實現,100nM轉染miRNA抑制劑轉染miR-210,分為miR-210上調組,陰性對照組使用100nM轉染miRNA抑制劑轉染無意義序列干預,均由廣州銳博公司提供。模型組、空白組2組均給予等體積的0.9%氯化鈉溶液干預。4組均連續干預5 d。
1.2.3 miR-210檢測:取大鼠尾部靜脈血3 ml,3 000 r/min離心10 min,取得上層血清,放置-20℃凍箱內備用。采用實時熒光定量PCR檢測:將采集到的100 μl血清加300 μl Trizol震蕩混勻靜置10 min,加80 μl氯仿再次震蕩混勻靜置5 min,離心后凝膠離心至管底,加100 μl DEPC水。將標本混合液15 000 r/min,離心處理15 min。提取上清至液轉移到含糖原EP管中,加等體積預冷異丙醇,混勻,-20℃靜置2 h。提取白色沉淀加1 ml的75%乙醇,混勻后充分洗滌RNA沉淀,4℃ 7 500 g,離心處理5 min,摒棄上清液。加80 μl DEPC水對RNA沉淀進行溶解,-80℃保存。采用逆轉錄試劑盒(TaqMan? miRNA Reverse Transcription Kit)逆轉成cDNA,嚴格按照操作說明書進行操作。采用THUNDERBIRD qPCR Mix PCR試劑盒進行實時熒光定量PCR檢測,以外源性cel-mir-39-3p作參照,采用2-ΔΔCT法對miR-210表達水平分析。
1.2.4 創面愈合率統計:觀察各組大鼠干預后3 d、5 d 創面愈合情況,通過滌綸投影膜將大鼠創面覆蓋,掃描大鼠創面大小,經過圖像分析儀計算創面愈合率。創面愈合率=(原始創面面積-殘余創面面積)/原始創面面積×100%。
1.2.5 病理組織觀察:干預后5 d大鼠麻醉處死后,采集大鼠足部組織,提取后采用0.9%氯化鈉溶液沖洗后,將粘附在其表現的異物清除干凈,干凈紗布將表面水分吸干后制備切片,置于2,3,5-三苯基氯化四氮唑(TTC)溶液中,染色15 min后使用0.9%氯化鈉溶液沖洗干凈,計算大鼠心肌梗死面積。之后切片經過二甲苯脫蠟后,梯度乙醇水化,蘇木精染色5 min,流水沖洗后給予伊紅染色30 s,觀察。
1.2.6 炎性因子、血管內皮活性相關因子水平檢測:酶聯免疫吸附法(ELISA)檢測:提取標本包被液,對TGF-β 0.1 ml進行適當稀釋,進而加到聚苯乙烯反應板各孔中。加蓋 4℃ 24 h保存。次日使用洗滌液進行3次全方位洗滌,甩干;各孔內加不同稀釋倍數的待檢標本0.1 ml,同時增加陽性和陰性對照,置于43℃溫箱60 min,移去液體。同上述法則洗滌3次,甩干;各孔內加稀釋IL-18、TNF-α、VCAM-1、ET、NO、NOS 0.1 ml,置43℃溫箱60 min。移去液體,同前法洗3次,甩干;各孔加底物液0.1 ml,置黑暗處20 min;各孔內加2 mol的IL-18、TNF-α、VCAM-1、ET、NO、NOS 0.05 ml,終止反應。試劑盒購自北京北方生物技術研究所,試驗操作嚴格根據說明書的步驟進行。
1.2.7 VEGF-PI3K/AKT-eNOS表達檢測:采用免疫印跡(Western blot)將標本提取液,通過1 000 r/min離心處理后提取沉淀,滴加裂解液、反復凍融后,120 000 r/min離心處理,提取上清液,采用酶標儀檢測VEGF、SDF1α、AKT、eNOS蛋白濃度,保存。滴加10%的分離膠,封閉,吸干水分,給予5%的濃縮膠灌注,凝固后,將其在電泳槽中固定,加5 μl Marker、變性蛋白樣品,電泳干預30 min,待蛋白分離膠底,結束電泳;轉膜成功后將硝酸纖維素膜(Nitrocellulosefilter membrane,NC)膜在5%的脫脂奶粉中封閉固定1 h,加一抗(Notch1、Hes1、HIF-1α 1∶1 000)孵育,經過震蕩洗膜后加二抗(Notch1、Hes1、HIF-1α 1∶10 000),孵育,再次震蕩洗膜,使用紅外熒光成像系統對結果給予分析。以GAPDH為內參。
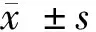
2 結果
2.1 4組大鼠miR-210表達比較 模型組、陰性對照組、miR-210上調組miR-210表達均低于空白組;陰性對照組、miR-210上調組miR-210表達高于模型組;miR-210上調組miR-210表達高于陰性對照組(P<0.05)。見表1。
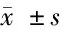
表1 4組大鼠miR-210表達比較
2.2 4組大鼠創面愈合率比較 模型組、陰性對照組、miR-210上調組干預后3 d、干預后5 d創面愈合率均低于空白組;陰性對照組、miR-210上調組干預后3 d、干預后5 d創面愈合率高于模型組;miR-210上調組干預后3 d、干預后5 d創面愈合率高于陰性對照組(P<0.05)。4組干預后5 d創面愈合率均高于4組干預后3 d(P<0.05)。見表2。
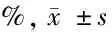
表2 4組大鼠創面愈合率比較
2.3 4組病理組織觀察 干預后5 d,空白組創面組織中,具有豐富的毛細血管,管腔大,與創面呈垂直分布未發現中性粒細胞浸潤;模型組創面組織有大量的炎性細胞,含有豐富的中性粒細胞,而新生毛細血管數量少,且管腔較小;陰性對照組和miR-210上調組創面組織中可見有不同數量的毛細血管,管徑較正常增加,炎性細胞浸潤減輕,其中miR-210上調組改善最明顯。見圖1。
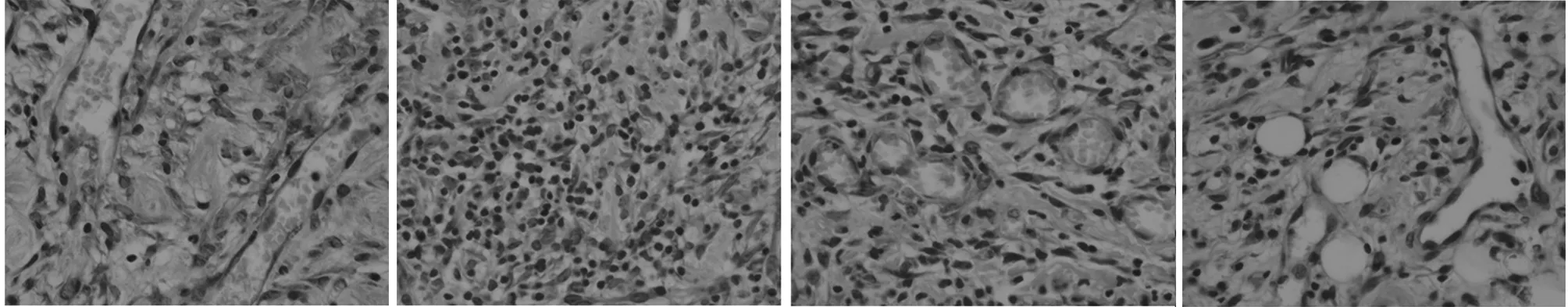
圖1 4組病理組織觀察(HE染色×200)
2.4 4組炎性因子相關指標比較 干預后5 d,模型組、陰性對照組、miR-210上調組IL-18、TNF-α、VCAM-1水平均高于空白組;陰性對照組、miR-210上調組IL-18、TNF-α、VCAM-1水平低于模型組;miR-210上調組IL-18、TNF-α、VCAM-1水平低于陰性對照組(P<0.05)。見表3。
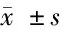
表3 4組炎性因子相關指標比較
2.5 4組大鼠血管內皮活性相關因子水平比較 干預后5 d,模型組、陰性對照組、miR-210上調組ET水平均高于空白組,NO、NOS水平低于空白組,差異有統計學意義(P<0.05);陰性對照組、miR-210上調組ET水平低于模型組,NO、NOS水平高于模型組,差異有統計學意義(P<0.05);miR-210上調組ET水平低于陰性對照組,NO、NOS水平高于陰性對照組,差異有統計學意義(P<0.05)。見表4。
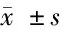
表4 4組大鼠血管內皮活性相關因子水平比較
2.6 4組大鼠VEGF-PI3K/AKT-eNOS表達比較 干預后5 d,模型組、陰性對照組、miR-210上調組VEGF、SDF1α、AKT、eNOS表達均高于空白組;陰性對照組、miR-210上調組VEGF、SDF1α、AKT、eNOS表達低于模型組;miR-210上調組VEGF、SDF1α、AKT、eNOS表達低于陰性對照組(P<0.05)。見表5,圖2。
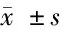
表5 4組大鼠VEGF-PI3K/AKT-eNOS表達比較
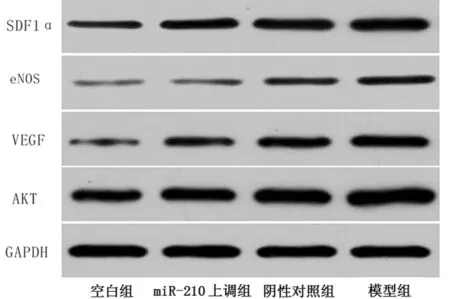
圖2 4組大鼠VEGF-PI3K/AKT-eNOS表達比較
3 討論
糖尿病足發病的主要原因是因為患者長時間高血糖,引起血管病變,導致嚴重的缺血性及發生,大部分患者伴隨側枝血管形成能力損傷[8]。糖尿病足患者主要的臨床表現是患者肢體末端疼痛,伴有感染、潰瘍、壞疽等發生,嚴重影響患者精神和身體健康[9]。因此臨床中選擇科學的治療手段對患者來說至關重要。
miRNAs可以與靶基因miRNA結合,參與基因調節過程,在對氧化應激反應以及炎性反應中發揮著重要的作用[10]。miR-210是miRNAs成員之一,在腎損傷、糖尿病以及糖尿病合并血管并發癥患者中表達升高,是糖尿病腎病早期診斷的主要生物標志物[11,12]。有研究證實,通過抑制miR-210能避免血管生成,減少內皮細胞遷移[13]。郭勇英等[14]研究也認為,在持續的高血糖狀態下,干細胞移植能實現miR-210表示上調,在毛細管狀結構形成、內皮細胞遷移中發揮著重要作用。
本研究結果顯示,模型組miR-210表達最低,提示在糖尿病足模型中miR-210表達降低。傷口愈合屬于一種復雜的細胞反應過程,其中角質細胞、內皮細胞、巨噬細胞、成纖維細胞等均會被激活,會釋放大量的生長因子、趨化因子、細胞因子等,對糖尿病足治療起到一定的協調和維持作用[15,16]。本研究指出,上調miR-210能提高糖尿病足模型大鼠創面愈合率,從而加快大鼠創面愈合速度。
糖尿病足創面常常有大量的氧自由基生成,對氧化應激反應有一定的介導作用,同時還能促進炎性細胞活化,在創面中浸潤,釋放大量的炎性細胞因子,對創面修復起到一定的消極影響[17]。IL-18、TNF-α屬于一種常見的炎性因子,具有促炎作用,導致炎癥級聯被放大。VCAM-1屬于一種黏附細胞因子,對炎性細胞、內皮細胞黏附有介導作用,參與炎性細胞在創面中黏附、浸潤過程[18]。本文研究結果指出,上調miR-210能降低糖尿病足大鼠IL-18、TNF-α、VCAM-1水平,從而抑制炎性反應。
研究證實高糖高脂參與血管內皮損傷過程,主要是因為長時間受高血糖的影響,血管內皮細胞會伴隨慢性、免疫性損傷,導致血管中活性物質分泌紊亂,釋放大量的ET、血栓素,舒血管物質NO、NOS因子大量減少,導致血管收縮功能失衡,內皮細胞損傷,大量血小板聚集黏附,血液供應不足[19,20]。本研究證實,上調miR-210能降低模型大鼠ET水平,抑制NO、NOS水平,從而改善糖尿病足大鼠血管內皮損傷。SDF1α、NO均屬于血管內皮祖細胞(EPCs)遷移、運動成員,有助于EPCs向傷口部位遷移,促進傷口部位新生血管產生,加快傷口愈合[21]。本研究顯示,上調miR-210能降低模型大鼠VEGF、SDF1α、AKT、eNOS表達,從而將VEGF-PI3K/AKT-eNOS信號通路激活,參與糖尿病足模型大鼠創面愈合調節過程。
綜上所述,上調miR-210能提高糖尿病足模型大鼠創面愈合率,抑制炎性反應,改善血管內皮活性,其作用機制可能與VEGF-PI3K/AKT-eNOS信號通路有關,為臨床糖尿病足靶向治療提供理論依據。

