TFE3對膽汁淤積分子調控作用的整合生物信息學分析
遲乃玉, 郭瀚澤, 李佳芮, 朱瑩瑩, 遲 彥
(1.大連大學 生命科學與技術學院,遼寧 大連 116622;2.遼寧師范大學 生命科學學院 七鰓鰻研究中心,遼寧 大連 116081)
膽汁淤積一般由膽汁酸形成、分泌和排泄障礙所導致,膽汁不能正常地流入十二指腸,反而進入血液循環,隨著時間增加導致肝損傷、肝纖維化、肝硬化、肝功能衰竭和肝癌等疾病發生,對人類生命健康造成極大威脅[1].關于膽汁淤積發生的分子機制目前還未完全闡明.生理條件下,膽汁酸的兩親特性促進了脂類及脂溶性維生素的消化吸收.另外,膽汁酸還可以作為信號分子,同細胞內核受體法尼醇X受體(Farnesoid X receptor,FXR)及細胞表面受體相互作用,參與信號轉導,調節細胞生物學過程[2].但在病理條件下,過多的膽汁酸,尤其是疏水膽汁酸在肝臟中的積累,導致氧化應激和線粒體損傷,最后導致炎癥因子的釋放,引發炎癥反應.炎癥因子進一步招募中性粒細胞和其他免疫細胞,從而損傷肝實質細胞,導致肝纖維化、肝硬化,最后導致肝衰竭[3].
自噬是響應細胞壓力應激而對細胞產生的適應性保護反應,其通過降解細胞內受損的細胞器、未折疊蛋白等對細胞進行質量控制,從而減少壓力應激下細胞損傷,促進細胞的存活[4-5].自噬對于膽汁淤積性疾病發揮重要調節作用.有研究顯示在膽汁淤積性疾病,如:原發性膽汁性膽管炎(Primary biliary cholangitis, PBC)、原發性硬化性膽管炎(Primary sclerosing cholangitis,PSC)、繼發性硬化性膽管炎(Secondary selerosing cholangitis,SSC)以及遺傳性膽汁淤積肝組織中,LC3和P62水平顯著升高[6];CFTR基因突變導致的囊性纖維化和遺傳性膽汁淤積癥,同樣發現P62陽性聚集物的形成[7];膽結石病人受損的肝臟中,LC3和P62水平顯著增加[8],以上均表明在膽汁淤積性肝病中,自噬水平顯著降低.利用雷帕霉素抑制mTOR信號通路激活自噬,可以清除肝組織中P62包涵體的形成[9].激活自噬降低了肝損傷,抑制自噬則加重了肝組織損傷[10],這些均表明自噬對于保護膽汁淤積性疾病起到重要作用.
轉錄因子結合IGHM增強子3(TFE3)是調節自噬的重要轉錄因子.TFE3為MIT/TFE(Microphthalmia-associated transcription/transcription factor E)家族成員,位于細胞核內,含有同DNA結合的bHLH-zip保守結構域[11].當受饑餓刺激后移位入細胞核,獨立或協同TFEB,與核內具有CLEAR(Coordinated lysosomal expression and regulation)序列的基因啟動子序列結合,啟動相應基因表達,促進了自噬和溶酶體生成.不僅如此,TFE3還作為響應細胞各種應激狀態下的感受器,在感受線粒體、內質網以及溶酶體應激下迅速入核,啟動啟動子上同樣具有CLEAR序列的基因表達,進而抵御細胞器的壓力,維持細胞正常功能和穩態[11].膽汁淤積性疾病,膽汁酸抑制自噬流的發生,并且由于疏水膽汁酸去污特性,破壞了脂膜結構,造成線粒體活性氧增加,內質網Ca2+離子釋放,從而啟動線粒體和內質網應激,啟動線粒體自噬,促進細胞凋亡發生而抵御細胞器的壓力[12].由此推測,TFE3作為促進自噬、響應細胞器壓力的感受器,可能通過誘發自噬、啟動細胞適應性保護反應而在膽汁淤積疾病過程中發揮重要的保護作用.但目前關于TFE3對膽汁淤積疾病的保護分子機制還未有報道.
本研究擬利用生物信息學手段,首先對膽道閉鎖GEO(Gene expression omnibus)數據庫進行加權基因共表達網絡分析(Weighted gene co-expression network analysis, WGCNA),篩選出與疾病呈負相關的模塊.模塊內基因再與膽汁淤積GEO數據庫差異表達基因以及TFE3下游靶基因共同取交集,獲得TFE3可能調節的對于膽汁淤積性疾病具有抑制作用的候選基因.最后利用JASPAR數據庫分析TFE3與候選基因啟動子CLEAR序列結合的可能性.該研究首次從生物信息學角度全面解析了TFE3對膽汁淤積性疾病保護作用的調節機理,為以TFE3為新靶點,開發防治膽汁淤積性肝病的藥物提供理論依據.
1 材料與方法
1.1 GEO數據庫
從NCBI(https:∥www.ncbi.nlm.nih.gov/)下載GEO數據庫(GSE46960,GSE152494、GSE169072).GSE46960為人膽道閉鎖數據庫,使用的基因平臺為[HuGene-1_0-st]Affymetrix Human Gene 1.0 ST Array[transcript(gene)version],包括64個膽道閉鎖患者樣本和17個對照.GSE152494、GSE169072為體外膽汁酸處理細胞的數據庫,所使用的基因平臺均為GPL570[HG-U133_Plus_2]Affymetrix Human Genome U133 Plus 2.0 Array,均分別有3個對照和3個處理組樣本.
1.2 WGCNA分析
WGCNA是一種使用基因表達數據構建無標度網絡的系統生物學方法[13].首先,對數據庫GSE46960內的基因表達情況及離群值進行質量檢驗,之后利用R語言中的 WGCNA包進行分析,根據主要連接關系和皮爾森相關性建立相關矩陣,利用WGCNA包內的“pick Soft Threshold”函數計算軟閾值β,選擇適當的β值使構建的網絡更符合無標度網絡的標準.將鄰接矩陣轉化為拓撲重疊矩陣(Topological overlap matrix,TOM),并基于此進行基因層次聚類,得到基因層次聚類樹.對系統聚類樹進行動態切割,以模塊內最少基因數為30的參數將基因分組為模塊,對模塊特征基因(Module eigengenes,MEs)進行聚類,以便將相似的模塊合并,計算基因顯著性(Gene significance,GS)和模塊顯著性(Module membership,MS),以分析模塊與臨床信息的關聯程度.
1.3 差異表達基因的篩選
從NCBI的GEO數據庫下載探針文件和平臺文件.使用Perl語言腳本將基因探針注釋為基因名稱,再使用R語言中的“limma”包獲取差異表達基因,設置篩選條件為P-value<0.5,|lb(Fold Change)|>1.0,得到差異表達基因數據集.
1.4 TFE3下游靶基因篩選
GTRD(http://gtrd.biouml.org/)從SRA(Sequence read archive)、GEO等公共數據庫中收集轉錄因子相關的Chip-seq數據,采用標準流程進行peak calling分析,并基于已有的轉錄因子motif數據,預測轉錄因子的結合位點[14].TFE3下游靶基因預測主要由GTRD完成,共預測12 062個TFE3潛在的靶基因.
1.5 靶基因上游轉錄因子預測
通過UCSC(https:∥genome-asia.ucsc.edu/index.html)數據庫獲得潛在靶基因的啟動子,并將啟動子輸入JASPAR[15](http:∥jaspar.genereg.net/),評估TFE3對潛在靶基因啟動子的結合能力.
2 結 果
2.1 WGCNA分析
利用R語言的WGCNA包,根據皮爾森相關性建立相似矩陣.再通過“pick Soft Threshold”函數計算軟閾值(powerβ)(圖1A).結果顯示當選定軟閾值為16時,相關系數R2>0.9,此時該閾值對應的網絡平均連接度接近0,說明該網絡近似無標度網絡(圖1B).最后,將鄰接矩陣轉化為拓撲重疊矩陣(TOM),計算相應的相異度(dissTOM).基于相異度進行基因層次聚類,獲得基因聚類樹(圖2A).對得到的系統聚類樹進行動態切割,以模塊內最少基因數為30的參數將基因分組為不同模塊(圖2B).為了進一步分析模塊,計算了模塊內特征基因(Module eigengenes,ME)的差異性,并以此進行聚類以合并相似模塊,最終共獲得21個模塊(圖2C).還計算了每個模塊與臨床特征的相關性,當相關性r>0.6,P-value<0.5時,認為與疾病顯著相關.共發現有7個與膽道閉鎖顯著相關的模塊,其中,4個模塊與疾病呈負相關,3個模塊與疾病呈正相關(圖2D).選取與疾病呈負相關模塊內基因進行下一步分析.

圖1 軟閾值β的選擇及無尺度網絡的構建

圖2 模塊的構建及與臨床性狀相關熱圖
2.2 差異表達基因的獲取
為了尋找膽汁淤積后的差異表達基因,篩選膽汁酸處理組差異于非處理組的基因.在GSE152494數據庫中獲得101個下調差異表達基因和58個上調差異表達基因(圖3A),GSE169072數據庫中獲得68個下調表達基因和54個上調表達基因(圖3B).
圖3 差異表達基因火山圖
2.3 膽汁淤積負相關相關基因篩選
膽道閉鎖發生后通常會產生膽汁淤積,為篩選到與膽汁淤積呈負相關的差異表達基因,將WGCNA分析得到的4個與疾病呈負相關模塊的基因與上述兩個體外膽汁酸處理細胞模擬膽汁淤積的數據庫的差異表達基因取交集,共獲得27個基因(圖4A).

圖4 TFE3靶基因的篩選
2.4 TFE3負調控膽汁淤積的可能靶基因篩選
為篩選TFE3負調控膽汁淤積的靶基因,將上述27個基因與通過GTRD預測的受TFE3調控的潛在靶基因取交集,共獲得了14個基因(圖4B).為驗證TFE3對這些潛在靶基因的調控,利用UCSC數據庫獲得14個基因的啟動子序列.導入JASPAR網站預測TFE3與這些基因啟動子的結合位點,并將結合分值高于9.0認定為TFE3潛在靶基因.共篩選出補體4結合蛋白(Complement componet 4 binding protein,C4BPB)、補體9(Complent 9,C9)、二氫乳清酸脫氫酶(Dihydroorotate dehydro-genase,DHODH)、羥酸氧化酶2(Hydroxyacid oxidase 2,HAO2)、3-羥基-3-甲基-輔酶A合成酶1(3-hydroxy-3-methylglutaryl-CoA synthase 1,HMGCS1)和甾醇C5去飽和酶(Sterol-C5-desatur-ase,SC5D)6個基因(表1).
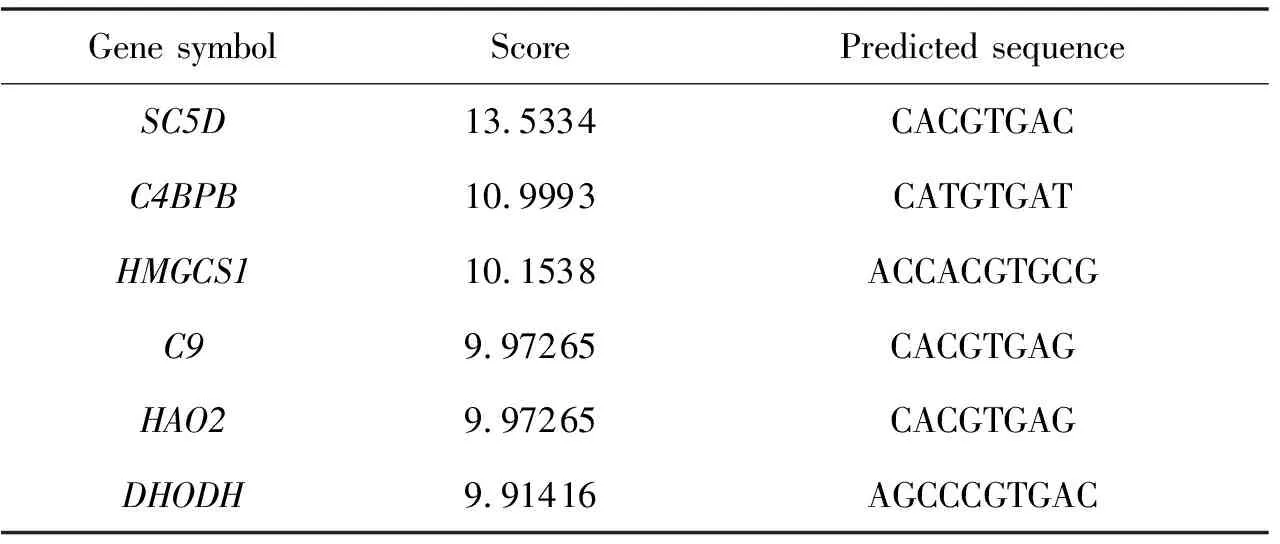
表1 JASPAR預測TFE3的結合位點
3 討 論
目前,對膽汁淤積的治療尚無特別有效的手段.熊去氧膽酸(Ursodeoxycholic acid,UDCA)及其衍生物是唯一經美國FDA(Food and drug administration)批準的、世界公認的治療膽汁淤積的藥物.但是,熊去氧膽酸對約1/3~2/3的膽汁淤積病人,如原發性膽管硬化性膽汁淤積治療效果不佳或無效,甚至可能導致病情惡化.尋找新的靶點治療膽汁淤積性疾病顯得尤為重要.本研究期望通過生物信息學手段,全面解析TFE3保護膽汁淤積性肝病的分子機理,為以TFE3為新靶點,開發防治膽汁淤積性肝病的藥物提供理論依據.膽道閉鎖是造成膽汁淤積的重要病因.首先對膽道閉鎖GEO數據庫的基因進行了WGCNA分析,篩選到4個與疾病呈顯著負相關的模塊,4個模塊基因共為2 658個.為進一步篩選到與膽汁淤積性肝病呈負相關的差異表達基因,又將上述基因與兩個混合膽汁酸處理肝細胞的GEO數據庫中差異表達基因取交集,獲得27個基因.為篩選到TFE3可能參與負向調節膽汁淤積的靶基因,將這27個基因與GTRD數據庫中TFE3下游靶基因取交集,得到14個候選基因.最后,利用JASPAR數據庫分析,共有6個基因的啟動子上具有CLEAR序列,并且能被TFE3所識別.經過整合生物信息學分析,表明這6個基因可能是TFE3調節的靶分子,TFE3可能通過調節這6個靶基因在膽汁淤積性疾病中發揮保護作用.經HPA(Human protein atlas)數據庫(https:∥www.proteinatlas.org/)分析,發現這6個基因均是在肝組織中特異表達.
研究認為,在肝臟中積累的疏水性膽汁酸能夠產生較強的免疫反應,促炎因子的分泌會進一步影響膽汁酸核受體及其所調控的膽汁酸轉運蛋白的活性,進而導致膽汁酸代謝紊亂,加重了膽汁淤積[16-17].補體系統是免疫系統中進化較為保守的組成部分,除其廣泛被熟知的抗菌作用外,補體系統激活的片段還與免疫細胞表面受體相互作用,在天然和適應性免疫方面發揮重要調節作用[18].有報道顯示,在肝臟疾病,如非酒精性肝炎(Nonalcoholic steatohepatitis,NASH)、肝癌(Hepatocellular carcinoma,HCC)中補體系統異常激活,而降低補體系統的活化對于疾病起到一定抑制作用[18].C4BP是由肝臟合成并分泌到血液循環中的血漿糖蛋白,其通過與凋亡或壞死細胞結合阻止了由于補體激活而產生的炎癥,是補體經典途徑和凝集素途徑的主要可溶性抑制劑.也有研究報道口服石斛酚可抑制補體C9水平進而抑制了C5b-9復合物的形成,從而降低了肝臟氧化應激和炎癥反應[19].鑒于膽汁淤積性肝病免疫反應的失調,因此推測TFE3可能通過調節補體系統,如C4BP以及C9的活性調節膽汁淤積性肝病.
肝臟膽汁酸的合成及分泌是調節肝細胞內膽固醇平衡的重要手段[18].而膽汁淤積情況下,胞內膽固醇平衡就被打破,膽汁淤積病人往往具有高膽固醇血癥的并發癥[20-21].在膽汁淤積的情況下,調節膽固醇的平衡對于抵抗膽汁淤積的損傷可能具有重要意義.3-羥基-3-甲基-輔酶A合成酶1(3-hydroxy-3-methylglutaryl-CoA synthase 1,HMGCS1)是膽固醇前體甲羥戊酸的合成酶,甾醇C5去飽和酶(Sterol-C5-desaturase,SC5D)負責將7-膽甾烯醇轉化為7-脫氫膽固醇.兩者均為膽固醇合成過程中的關鍵酶.通過生物信息學分析,HMGCS1以及SC5D可能是TFE3的新靶基因,TFE3可能通過調控HMGCS1以及SC5D基因而抵御膽汁酸過多積累造成的膽固醇失調.
肝細胞富含線粒體,而線粒體是ROS的主要來源,因此,肝細胞易于受ROS的攻擊.在病理條件下,過多的膽汁酸干擾線粒體呼吸鏈和電子傳遞過程,使得氧化呼吸鏈解偶聯,導致大量ROS的產生.ROS進一步刺激線粒體通透性轉換孔使其不可逆開放,最后導致大量物質進入線粒體,線粒體腫脹,引起線粒體膜損傷,ATP水解,釋放細胞色素C,導致肝細胞凋亡[12,22].同時,ROS的產生也會激活線粒體和內質網應激,導致炎癥因子的釋放,引發炎癥反應.因此,過多膽汁酸損傷線粒體而產生大量ROS可能是膽汁淤積性疾病的主要病理事件.二氫乳清酸脫氫酶(Dihydroorotate dehydrogenase,DHODH)是嘧啶核苷酸從頭合成途徑的限速酶,定位于線粒體內膜.2013年,Fang等研究顯示DHODH通過與線粒體內膜呼吸鏈復合物相互作用而影響線粒體功能.缺失DHODH降低了線粒體膜電位,增加了線粒體活性氧的大量產生[23].DHODH可能起到了線粒體抗氧化防御的作用.羥酸氧化酶2(Hydroxyacid oxidase 2,HAO2)是一種肝臟特異性過氧化物酶體酶,可氧化乙醇酸鹽生成乙醛酸,同時生成H2O2,下調其表達對于降低氧化損傷具有重要作用[24].DHODH以及HAO2啟動子上均有CLEAR序列,因此,推測TFE3可能通過調控DHODH以及HAO2而對膽汁酸造成的線粒體損傷起到一定保護作用.

