羅湖病毒(TiLV)RT-qPCR方法的建立
徐淑菲,朱黃鑫,曾韻穎,劉啟霖,方成俊,林雙慶,孔凡德*
(1.廈門海關(guān)技術(shù)中心,福建 廈門361026;2.東山海關(guān)綜合技術(shù)服務(wù)中心,福建 漳州363401)
羅非魚是很多發(fā)展中國家的主要食用蛋白質(zhì)來源,也是許多漁民和養(yǎng)殖者的重要經(jīng)濟來源,是全球養(yǎng)殖產(chǎn)量最高的單一品種。羅非魚養(yǎng)殖已成為保障全球糧食安全和滿足人類營養(yǎng)需求的重要產(chǎn)業(yè),從20世紀(jì)50年代開始,我國羅非魚養(yǎng)殖已經(jīng)形成苗種繁育、養(yǎng)殖生產(chǎn)、加工出口相對完整的產(chǎn)業(yè)鏈,成為全球最大的羅非魚養(yǎng)殖國家。但是我國養(yǎng)殖羅非魚主要以小養(yǎng)殖戶為單位[1],高溫高密度精養(yǎng)池塘經(jīng)常發(fā)生大面積疾病。雷燕等[2]2017年報道了國內(nèi)養(yǎng)殖羅非魚首次檢出羅湖病毒(Tilapia lake virus,TiLV),引起了國內(nèi)相關(guān)部門的重視,但未見官方報道。
TiLV是2012年Eyngor M等[3]首次發(fā)現(xiàn)的危害羅非魚的一種新型的RNA病毒,由10個獨特的基因片段組成,直徑55~75 nm,目前仍未確定其分類地位,但極有可能隸屬于正黏病毒科,與流感病毒同屬一科。2018年Senapin S等[4]從無明顯臨床癥狀、無死亡的成年羅非魚和魚苗中檢測出TiLV,提示TiLV可能像傳染性鮭貧血病毒(ISAV)一樣存在著變異株。
國外已經(jīng)在病毒的細胞培養(yǎng)、組織病理學(xué)、RT-PCR、nested RT-PCR、semi-nested RT-PCR、SYBR quantitative RT-PCR、原位雜交等檢測技術(shù)方面進行了研究,并建立了相應(yīng)的檢測方法。因為分子生物學(xué)方法具有快速、靈敏、簡便的特點,大多數(shù)國家都采用其對TiLV進行監(jiān)測和診斷。現(xiàn)有檢測TiLV的分子生物學(xué)方法大多是針對假設(shè)蛋白基因片段而建立,如Tsofack J K等[5]根據(jù)基因片段3(Genebank序列號KJ605629)建立了巢氏RT-PCR方法;Dong H T等[6]建立的半巢氏RT-PCR方法也是根據(jù)片段3建立的;Pitchaporn W等[7]建立的實時熒光定量RT-PCR(Reverse transcription-quantitative real-time PCR,RT-qPCR)方法根據(jù)片段3設(shè)計引物探針,GenBank序列號為KU751816.1、MF574205.1、MF582636.1、MF502419.1、KX631923.1;劉助紅等[8]同樣是根據(jù)基因片段3(Genebank序列號KJ605629)建立了RT-LAMP方法。TiLV基因片段3編碼假設(shè)蛋白,基因片段1編碼RNA聚合酶,目前已有大量關(guān)于基因片段3的研究論文,但通過基因片段1進行檢測的研究論文很少。本研究根據(jù)TiLV基因片段1的保守序列設(shè)計3套特異性引物和探針,并探討建立RT-qPCR方法的可行性,為進一步監(jiān)控及預(yù)防TiLV提供技術(shù)支撐。
1 材料與方法
1.1 材料
1.1.1 樣品的采集和處理
采集羅非魚成魚的肝、脾、腎和腦組織,并于-80℃凍存?zhèn)溆谩?/p>
1.1.2 主要試劑和儀器
主要試劑:MagSi Total RNA Kit,OMEGA公司產(chǎn)品,貨號M7930-02;QuantiNova Probe RT-PCR Kit,QIAGEN公司產(chǎn)品,貨號為208354,包括2×Probe RT-PCR Master Mix、QN Probe RT-Mix、RNase-free water。
主要儀器:熒光定量PCR儀(德國耶拿,型號qTOWER3G)、磁珠純化系統(tǒng)(杭州奧盛,型號Auto-Pure32A)、臺式冷凍離心機(Beckman公司,型號Allegra64R)。
1.1.3 引物
檢測TiLV的RT-qPCR的引物和探針:
引物TiLV-qF:5’-CCCACTTACACAACGAGGAATGA-3’(5 μmol/L);
引物TiLV-qR:5’-GGTGGCAATCCCAAGTCAGTAG-3’(5 μmol/L);
探針TiLV-qP:VIC-CTCCCCACATGCCTG-MGB(5 μmol/L)。
1.1.4 擴增片段基因序列(97 bp)
擴增片段基因序:cccacttacacaacgaggaatgaggacttcctccccacatgcctgggagggaagactgtaattagctttcaatctctact gacttgggattgccacc。
合成的TiLV的標(biāo)準(zhǔn)質(zhì)粒和慢病毒序列相同(976 bp),均包含該97 bp擴增片段基因序列。
1.1.5 反應(yīng)體系
若無特殊說明,均按照表1反應(yīng)體系進行試驗。

表1 反應(yīng)體系
1.1.6 反應(yīng)條件
反應(yīng)條件:反轉(zhuǎn)錄45℃ 20 min;預(yù)變性95℃ 5 min;擴增95℃ 15 s,退火延伸溫度 1 min,40個循環(huán)。熒光收集設(shè)置在退火延伸時進行。若無特殊說明,均按照此反應(yīng)條件進行試驗。
1.1.7 核酸濃度
本文使用到的核酸濃度:TiLV質(zhì)粒,5 ng/μL;TiLV慢病毒,25 ng/μL。
1.2 方法
1.2.1 RNA的提取
按照MagSi Total RNA Kit操作說明書進行RNA提取。
1.2.2 檢測TiLV的RT-qPCR方法的建立及優(yōu)化
1)檢測TiLV的RT-qPCR的引物、探針的最佳濃度研究
將原始濃度為5 μmol/L的探針TiLV-qP、原始濃度為10 μmol/L的引物TiLV-qF和TiLV-qR,分別進行10倍梯度稀釋。
A組:6個熒光定量PCR管中均加入使用濃度為5 μmol/L的探針TiLV-qP 1 μL(對應(yīng)的終濃度0.25 μmol/L),A1~A6管分別加入使用濃度分別為10、5、2.5、1.25、0.625、0.312 5 μmol/L的引物TiLV-qF和TiLV-qR各1 μL(對應(yīng)的終濃度分別為0.5、0.25、0.125、0.062 5、0.031 25、0.015 625 μmol/L);B組:6個熒光定量PCR管中均加入使用濃度為2.5 μmol/L 的探針TiLV-qP 1 μL(對應(yīng)的終濃度為0.125 μmol/L),B1~B6管分別加入使用濃度分別為10、5、2.5、1.25、0.625、0.312 5 μmol/L的引物TiLV-qF和TiLV-qR各1 μL;C組:6個熒光定量PCR管中均加入使用濃度為1.25 μmol/L 的探針TiLV-qP 1μL(對應(yīng)的終濃度為0.062 5 μmol/L),C1~C6管分別加入使用濃度分別為10、5、2.5、1.25、0.625、0.312 5 μmol/L的引物TiLV-qF和TiLV-qR各1 μL;D組:6個熒光定量PCR管中均加入使用濃度為0.625 μmol/L 的探針TiLV-qP 1 μL(對應(yīng)的終濃度為0.031 25 μmol/L),D1~D6管分別加入使用濃度分別為10、5、2.5、1.25、0.625、0.312 5 μmol/L的引物TiLV-qF和TiLV-qR各1 μL(表2)。反應(yīng)條件按照1.1.6進行。
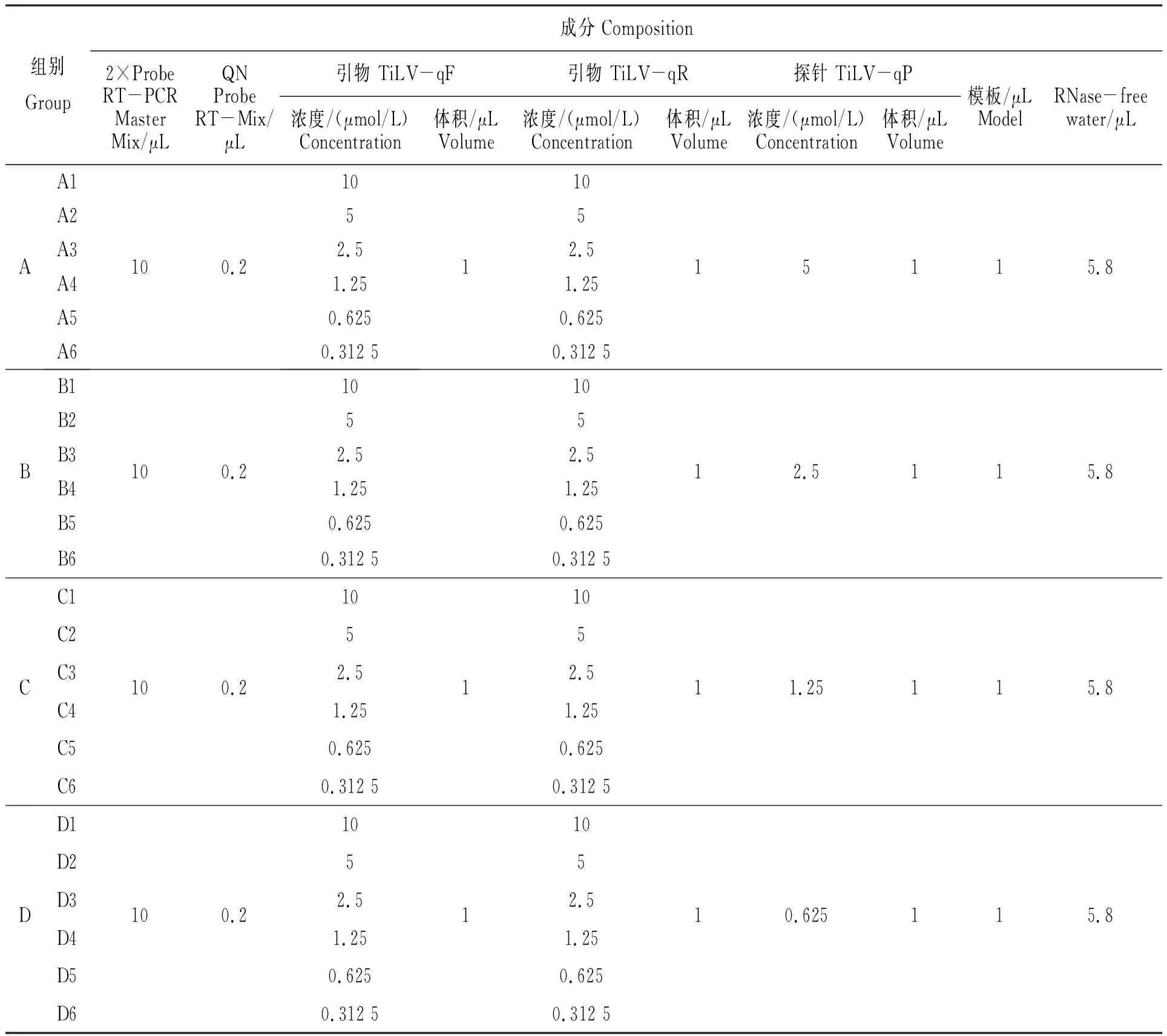
表2 檢測TiLV的RT-qPCR的引物探針最佳濃度各組分情況表
2)檢測TiLV的RT-qPCR方法的最佳退火溫度和重復(fù)性研究
將原始濃度為5 μg/mL的TiLV質(zhì)粒進行10倍梯度稀釋,依次為5×10-2~5×10-7μg/mL。除了模板外,其他按照優(yōu)選的反應(yīng)體系配制試劑,將按梯度稀釋的TiLV質(zhì)粒分裝到6組(每組重復(fù)3次)共18個熒光PCR反應(yīng)管中。
第1組至第6組的熒光PCR反應(yīng)管分別加入5×10-2~5×10-7ng/μL梯度稀釋的TiLV質(zhì)粒各1 μL。第1~6組分別按照退火溫度50、55、60、65、70℃進行RT-qPCR。反應(yīng)條件:反轉(zhuǎn)錄45℃ 20 min;預(yù)變性95℃ 5 min;擴增95℃ 15 s,退火延伸溫度分別為50、55、60、65、70℃1 min,40個循環(huán)。熒光收集設(shè)置在50、55、60、65、70℃退火延伸時進行。
1.2.3 繪制檢測TiLV的RT-qPCR方法的標(biāo)準(zhǔn)曲線
除模板按照優(yōu)選的反應(yīng)體系配制試劑外,其余將原始濃度為5 μg/mL的TiLV質(zhì)粒進行10倍梯度稀釋,分別為5×10-1~5×10-6μg/mL,并分裝到6組(每組重復(fù)4次)共24個熒光PCR反應(yīng)管中,添加體積為1 μL。反應(yīng)條件按照1.1.6(其中,退火延伸溫度根據(jù)1.2.2試驗獲得)進行。最后繪制檢測TiLV的RT-qPCR方法的標(biāo)準(zhǔn)曲線。
1.2.4 檢測TiLV的RT-qPCR方法的靈敏度試驗
除了模板按照優(yōu)選的反應(yīng)體系配制試劑外,其余將原始濃度為5 μg/mL的TiLV質(zhì)粒進行10倍梯度稀釋,分別為5×10-1~5×10-8μg/mL,平均分裝到8個熒光PCR反應(yīng)管中,添加體積為1 μL(TiLV質(zhì)粒終濃度分別為2.5×10-2~2.5×10-9ng/μL)。反應(yīng)條件按照1.1.6(其中,退火延伸溫度根據(jù)1.2.2試驗獲得)進行。
1.2.5 檢測TiLV的RT-qPCR方法的特異性試驗
按照優(yōu)選的反應(yīng)體系(模板除外)配制試劑,平均分裝到13個熒光PCR反應(yīng)管中,第1~13管分別加入TiLV質(zhì)粒、TiLV慢病毒、真鯛虹彩病毒(RSIV)、錦鯉皰疹病毒(KHV)、流行性造血器官壞死病毒(EHNV)、金魚造血器官壞死病毒(GFHNV)、流行性潰瘍綜合征(EUS)、鯉春病毒血癥病毒(SVCV)、傳染性造血器官壞死病毒(IHNV)、傳染性鮭魚貧血病(ISA)、鮭魚甲病毒(SAV)、病毒性出血性敗血癥(VHSV)、RNase-free water各1 μL。反應(yīng)條件按照1.1.6(其中,退火延伸溫度根據(jù)1.2.2試驗獲得)進行。
1.2.6 應(yīng)用
將建立的檢測TiLV的RT-qPCR方法應(yīng)用于300份羅非魚、石斑魚等樣品的TiLV的檢測。羅非魚臨床樣品從福建省養(yǎng)殖場采集,包括詔安縣梅川雙田水庫養(yǎng)殖場、漳州市常山基祥水產(chǎn)養(yǎng)殖場、詔安縣紅坑水庫養(yǎng)殖場、福建銘興食品冷凍有限公司四都水庫養(yǎng)殖場、三姑娘水庫養(yǎng)殖場、嶺下溪水庫養(yǎng)殖場、石厝底水庫養(yǎng)殖場、梅州水庫養(yǎng)殖場。石斑魚樣品來自本實驗室日常檢疫留樣。
2 結(jié)果與分析
2.1 檢測TiLV的RT-qPCR方法的優(yōu)化
優(yōu)化結(jié)果見圖1、2。正常Ct值的范圍是15~35,本組試驗結(jié)果表明,第A至D組分別對應(yīng)圖1-A至圖1-D。圖1-A的TiLV-qP終濃度為0.5 μmol/L時,擴增靈敏度最高,且Ct值在正常范圍內(nèi),因此優(yōu)選圖1-A;A圖中A1、A2 Ct值均為20.5,A3 Ct值為21.2,選擇Ct值更小的A1、A2;擴增曲線A2的引物濃度更低,從節(jié)省試劑角度考慮,優(yōu)選擴增曲線A2。因此最佳的引物TiLV-qF、TiLV-qR、探針TiLV-qP終濃度均為0.25 μmol/L(對應(yīng)的使用濃度均為5 μmol/L)。
注:A~C的TiLV-qP終濃度分別為0.25、0.125、0.062 5、0.031 25 μmol/L(對應(yīng)的使用濃度分別為5、2.5、1.25、0.625 μmol/L) ;A1~A6、B1~ B6、C1~C6、D1~ D6的 TiLV-qF/qR終濃度分別為0.5、0.25、0.125、0.062 5、0.031 25、0.015 625 μmol/L(對應(yīng)的使用濃度分別為10、5、2.5、1.25、0.625、0.312 5 μmol/L)。
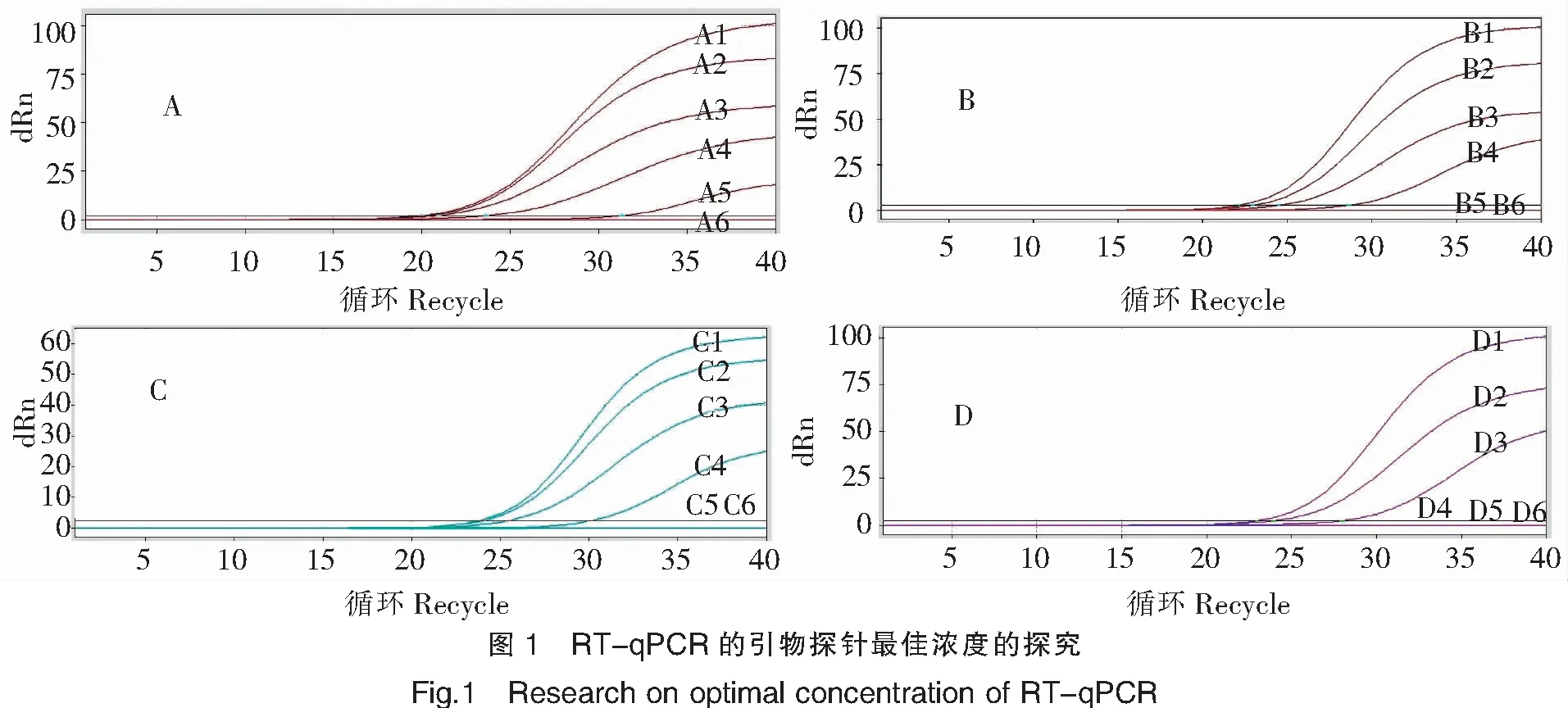
圖2試驗結(jié)果顯示,退火溫度55~60℃,同等核酸濃度擴增曲線Ct值基本一致,且重復(fù)性好;退火溫度65~70℃,靈敏度降低。通常熒光PCR退火溫度選擇60℃,因此本RT-qPCR最佳退火溫度選擇60℃,且重復(fù)性好。
注:A~E的退火溫度分別為50、55、60、65、70℃。1~6代表加入反應(yīng)體系中的質(zhì)粒初始濃度(5×10-1~5×10-6 ng/μL)。
2.2 檢測TiLV的RT-qPCR方法的標(biāo)準(zhǔn)曲線
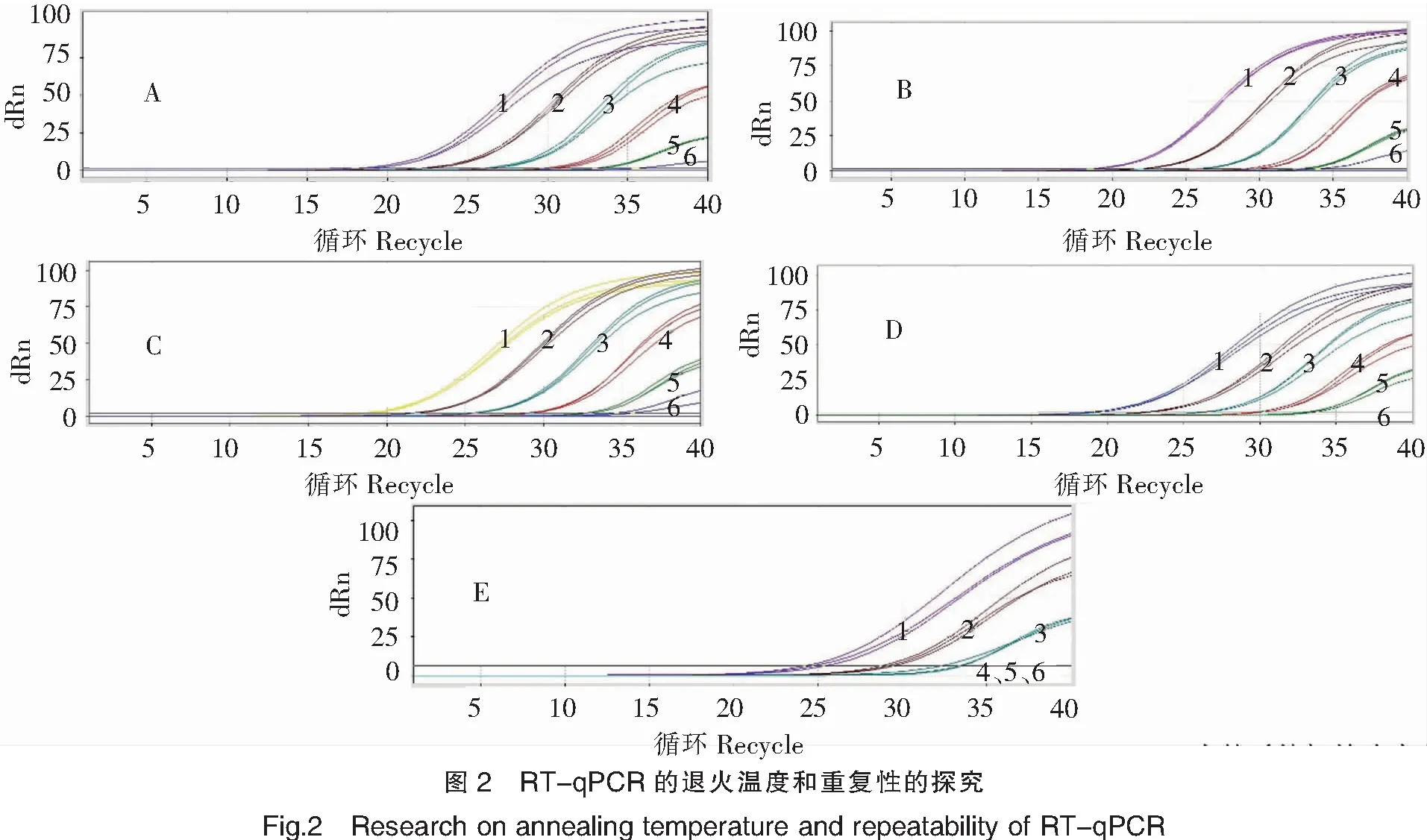
繪制的標(biāo)準(zhǔn)曲線結(jié)果見圖3。圖3顯示R2為0.997 45,PCR擴增效率為0.91,擴增效果極好,說明此引物探針的設(shè)計和濃度比例以及反應(yīng)條件均最佳,可用于樣品中TiLV的絕對定量分析。
注:1~6的TiLV質(zhì)粒終濃度分別為2.5×10-2~2.5×10-7 ng/μL(對應(yīng)的質(zhì)粒使用濃度為5×10-1~5×10-6 ng/μL)。
2.3 檢測TiLV的RT-qPCR方法的靈敏度分析
靈敏度分析結(jié)果見圖4。圖4試驗結(jié)果顯示,本文建立的檢測TiLV的RT-qPCR方法可檢測至第7管,TiLV核酸終濃度為2.5×10-8ng/μL,靈敏度為2.5×10-8ng/μL。
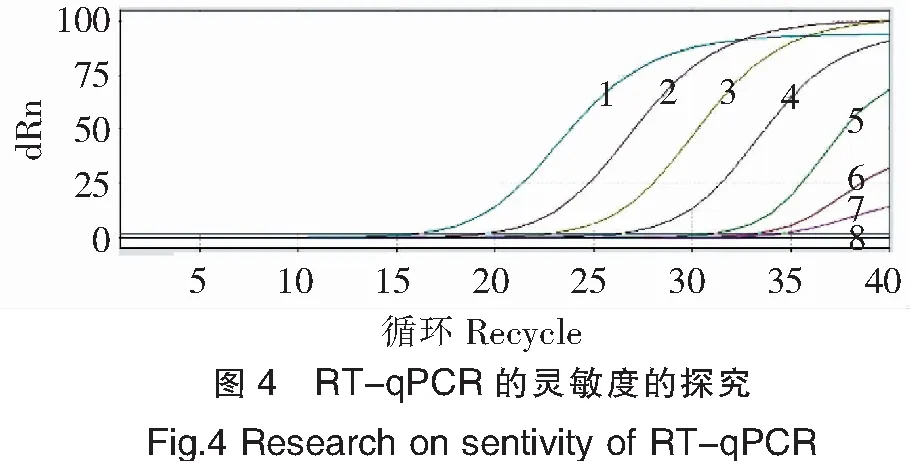
注:1~8的TiLV質(zhì)粒終濃度分別為2.5×10-2~2.5×10-9ng/μL(對應(yīng)的使用濃度分別為5×10-1~5×10-8 ng/μL)。
2.4 檢測TiLV的RT-qPCR方法的特異性分析
特異性結(jié)果見圖5。試驗結(jié)果顯示本文建立的檢測TiLV的RT-qPCR方法只能擴增出TiLV質(zhì)粒和TiLV慢病毒,其他常見的水生動物病毒均無擴增曲線,說明該方法特異性好。

注:1.TiLV質(zhì)粒;2.TiLV慢病毒;3.真鯛虹彩病毒(RSIV);4.錦鯉皰疹病毒(KHV);5.流行性造血器官壞死病毒(EHNV);6.金魚造血器官壞死病毒(GFHNV);7.流行性潰瘍綜合征(EUS);8.鯉春病毒血癥病毒(SVCV);9.傳染性造血器官壞死病毒(IHNV);10.傳染性鮭魚貧血病(ISA);11.鮭魚甲病毒(SAV);12.病毒性出血性敗血癥(VHSV);13.陰性對照。
2.5 檢測TiLV的RT-qPCR方法的驗證與應(yīng)用
將本試驗建立的檢測TiLV的RT-qPCR方法應(yīng)用于300份日常檢測樣品及水庫樣品的檢測,結(jié)果均未檢出TiLV。 并采用本團隊建立的同時檢測TiLV和病毒性神經(jīng)壞死病毒(Viral nervous necrosis virus,VNNV)的雙重RT-PCR方法和檢測TiLV的RT-LAMP方法進行驗證,顯示三種方法對所有樣品的檢測結(jié)果均一致,均未檢出TiLV。
3 討論
3.1 TiLV基因分析
TiLV共10個基因片段,基因片段1編碼RNA聚合酶,基因片段2~10編碼假設(shè)蛋白,與以往的蛋白沒有相似性,因此其功能不明確[7]。目前本研究團隊從Genbank中查詢到31個TiLV病毒毒株的基因片段1的序列,包括毒株TH-2013、TH-2014、TH-2015、TH-2016-CN、TH-2016-CU、TH-2017、TH-2018-K、TH-2018-N、TH-2019、BD-2017、BD-2017-181、BD-2019-E3、BD-2019-E1、WVL18053-01A、WVL19031-01A、WVL19054、CL、F3-4、TV1、TV2、TV3、TV4、TV5、TV6、TV7、Til-4-2011(基因片段1的GenBank登錄號:NC_029926、KU751814)、NBC02、NBC03、NBC04、NBC06、EC-2012)。本文根據(jù)基因片段1的保守序列,設(shè)計3套引物和探針,并從中優(yōu)選出引物和探針的最佳濃度。
3.2 國內(nèi)TiLV監(jiān)測情況
全國水產(chǎn)技術(shù)推廣總站每年都進行TiLV的專項檢測工作,海關(guān)系統(tǒng)也有TiLV的專項監(jiān)測任務(wù),本實驗室參與了福建省水產(chǎn)技術(shù)推廣總站采樣和病毒檢測工作,至今未檢出一例,其他地區(qū)也未有報道。
本實驗室自2017年就開始收集羅非魚樣品,至今已收集300多份,利用本文建立的RT-qPCR方法檢測,結(jié)果均為陰性。但這并不能說該方法無效,綜合文獻報道及每年海關(guān)、水產(chǎn)技術(shù)推廣站的監(jiān)測結(jié)果,研究團隊認為目前國內(nèi)羅非魚感染TiLV的可能性極低,但監(jiān)控預(yù)防工作不可松懈。
4 結(jié)論
本文建立了檢測TiLV的RT-qPCR方法,優(yōu)化的20 μL反應(yīng)體系包括:2×Probe RT-PCR Master Mix 10 μL,QN Probe RT-Mix 0.2 μL,5 μmol/L的引物TiLV-qF、TiLV-qR、探針TiLV-qP各1 μL,模板1 μL,補充RNase-free water至20 μL;優(yōu)化的反應(yīng)條件:反轉(zhuǎn)錄45℃ 20 min;預(yù)變性95℃ 5 min;擴增95℃ 15 s,60℃ 1 min,40個循環(huán);熒光收集設(shè)置在60℃退火延伸時進行。該方法能夠檢測出TiLV質(zhì)粒和TiLV慢病毒,對其他病毒無擴增條帶,說明方法特異性好,靈敏度為2.5×10-8ng/μL。

