膽囊腺肌增生癥的診療策略
吳鋼,蔡端
(復旦大學附屬華山醫院 普外科,上海 200040)
膽囊腺肌增生癥(adenomyomatosis,ADM)是一種以膽囊腺體和肌層慢性增生,同時伴有膽囊黏膜上皮細胞肥大并內陷進入肌層間隙內,繼而形成羅-阿竇(Rokitansky-Aschoff sinuses,RAS)為特征的獲得性、非炎癥性和非腫瘤性良性疾病。RAS與膽囊腔相通,常內含膽汁、膽泥及結石等[1-2]。在膽囊息肉(gallbladder polyps,GP)的分類中,ADM被劃分為假性息肉或非腫瘤性息肉。ADM通常在體檢或因其他原因行膽囊切除術后偶然發現。隨著腹部影像學技術的發展和普及,ADM的檢出率越來越高,其患病率約為1.0%~9.0%,大型尸檢系列報告的患病率為7.0%[3-4]。ADM的確切發病機制尚不清楚[5],通常無癥狀,少數患者可有隱匿性腹痛、上腹部不適或急、慢性膽囊炎等非特異性表現。50歲以后患病率增加,男女比例約為0.7∶1[6],實驗室檢查通常無特異性相關指標用于鑒別診斷[5-8]。
ADM曾被懷疑是一種癌前期病變,但是,最近大多數的研究認為ADM是膽囊的良性病變[6-7]。由于常并發膽囊炎和膽囊結石,而其臨床癥狀又與膽囊結石、膽囊炎極為相似,所以增加了對該病的識別和決策治療方法的難度[9]。一部分ADM影像學的鑒別診斷仍然比較困難,其表現又經常與早期膽囊癌(gallbladder cancer,GBC)難以鑒別,而GBC是一種惡性程度極高的疾病,5年生存率不到5.0%,這兩種膽囊疾病的治療和預后完全不同,因此,鑒別ADM與早期GBC尤為重要[3,10]。術前鑒別診斷ADM與GBC,極大影響了手術時機和治療方式的選擇。目前在針對ADM的治療上還缺乏公認的循證醫學指南,而且外科手術的指征和手術時機仍有較大爭議,這個難題給臨床提出了巨大的挑戰,經常導致對ADM的過度手術或者GBC的延誤治療[11]。
1 膽囊腺肌增生癥(ADM)的分型
根據ADM的大體特征,目前比較公認是分為三型(見圖1)。(1)局限型:常見于膽囊底部,因此又稱為基底型,病灶局限性增厚,呈半球狀向膽囊腔內隆起,類似于息肉。此型較少見于體部或頸部。病變范圍大小不等,厚度可達0.5~1.2 cm。病變底部中心常出現“臍凹征”,并與膽囊腔相通。ADM病灶以外其余部分的膽囊壁通常無明顯異常,而且膽囊的大體形態保持基本不變[7,12];(2)節段型:膽囊壁向腔內環形增厚,在體部或體、頸交界處形成環形狹窄,形似葫蘆或沙漏。ADM的病灶將膽囊腔分隔為兩個相互連接而又通而不暢的腔室:狹窄近端的頸部膽囊腔和狹窄遠端的體部膽囊腔,與頸部的膽囊壁相比體部的膽囊壁往往明顯增厚。而ADM形成的環形狹窄可以導致膽囊體部腔室內的膽汁淤滯,是形成結石的重要原因[3-4];(3)彌漫型:膽囊壁彌漫性增厚,散在分布增生、擴張的RAS。膽囊壁黏膜面凹凸不平,膽囊腔縮小。黏膜和黏膜肌層不規則,導致整個膽囊呈囊腫狀。也有局限型和節段型的混合型,但是非常罕見[7,13]。
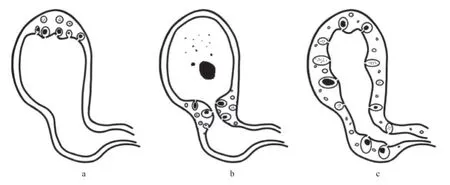
圖1 膽囊腺肌增生癥分型:a:局限型;b:節段型;c:彌漫型
殷雷等[6]報告在納入研究的有準確分型的1 191例ADM中,596例為局限型(50.0%),其中80.3%位于膽囊底部,252例為節段型(21.2%)和343例為彌漫型(28.8%)。而節段型和彌漫型更易并發結石[13]。Nishimura等[14]的研究發現156例ADM中54例為膽囊底部局限型(34.6%),99例為節段型(63.5%)和3例為彌漫型(2.0%)。Morikawa等[15]報告的93例經病理診斷為ADM的病例中,局限型44例(47.3%),節段型26例(28.0%)和彌漫型23例(24.7%)。
2 膽囊腺肌增生癥(ADM)的診斷
ADM的術前診斷依賴影像學檢查,其病理學基礎是膽囊黏膜、肌層過度增生導致膽囊壁增厚,膽囊壁內形成的大量RAS,并發膽泥淤積、膽固醇結晶及結石形成。由于ADM通常無癥狀,而一部分ADM面臨的最大挑戰是術前難以鑒別GBC。因此,準確診斷的意義在于防止誤診/漏診其他膽囊疾病,特別是GBC,以免最終導致治療錯誤[10,16]。
2.1 超聲
超聲(ultrasonography,US)因操作方便、價格低廉和結果準確等優勢,已成為診斷膽囊疾病的首選方法。ADM的超聲圖像特征主要包括:(1)膽囊壁局灶性或彌漫性增厚(>3 mm),局限型ADM類似于息肉突入膽嚢腔內,節段型通常累及膽囊體部遠端三分之一,而彌漫型則表現為膽囊壁彌漫性增厚;(2)膽囊壁受累部分內彌漫性、卵圓形或串珠狀壁內小憩室(1~10 mm),即RAS,是ADM的特征性表現;(3)病灶處膽囊壁內可見強回聲斑、小結石,后方出現彗星尾征(comet-tail)及閃爍征(twinkling),在橫切面上可見“鉆戒征”(diamond ring)[17-18]。但是,在多數情況下上述US特征性表現并不一定都存在,特別是當RAS比較小的時侯(<3 mm),以致US診斷ADM的準確率低于70.0%[19]。由于US 本身對操作者的依賴性、繼發于氣體或結石形成的偽影、肥胖患者及膽囊充盈不足等原因,一部分ADM與慢性膽囊炎、腺瘤性息肉、膽泥或者GBC等的鑒別診斷相當困難[7-8,12]。超聲造影(contrast-enhanced ultrasonography,CEUS)可以清晰地顯示組織微循環灌注情況,增強了組織對比能力,提高了RAS和膽囊壁完整性的顯示程度。ADM在動脈期不均勻增強,內部有小的非增強空間,病變周圍膽囊壁的黏膜層和漿膜層在增強時形成兩條高回聲線,在靜脈期較小的非強化間隙更清晰可見,CEUS聯合常規US可以提高ADM的診斷準確性[20]。
內鏡超聲(endoscopic ultrasound,EUS)可以提供高質量的膽囊圖像,提高了經腹US的敏感性,尤其對于肥胖患者可識別常規腹部US無法發現的ADM,尤其是對GBC的鑒別診斷,有研究認為其靈敏度與磁共振(magnetic resonance imaging,MRI)相當。由于EUS的高成本和侵入性等,臨床上并未將其作為一線常規檢查[3,8]。
2.2 CT
ADM的CT表現為局灶性或彌漫性、非特異性膽囊壁增厚和強化,局限性ADM可見膽囊底部局灶性腫塊,動脈期病變區域黏膜層及黏膜下層明顯強化,增厚的膽囊壁內由于RAS內襯一層菲薄的強化上皮,周圍環繞著低強化的肥大肌層,可以顯示特征性的“念珠征”(rosary sign),有助于鑒別局限性ADM和GBC[21-22]。只有當存在較大(至少3 mm)的RAS時,才有可能明確診斷ADM。而增強時在增厚的膽囊壁內增強層的點狀外邊界上,可以看到模糊的灰色增強點,呈現“棉球征”(cotton ball sign),尤其是RAS較小時更敏感[7]。增強CT的“棉球征”和“念珠征”在診斷ADM 的陽性率分別為74%(25/34)和44%(15/34),在鑒別ADM和GBC時棉球征顯示出比念珠征更高的敏感性和特異性[23]。
由于CT沒有足夠的分辨率用于區分US所見的憩室樣病灶和結石[10,18],盡管CT可用于US可疑GBC時、特別膽囊壁明顯增厚時的進一步檢查方法,但是對ADM和GBC的鑒別診斷仍然有限[24-25]。CT診斷ADM的總體準確率為61.8%~75.0%,識別RAS的能力為38.0%~43.0%[3]。
2.3 MRI
MRI較US及CT具有多參數、多方位成像和更高的組織密度分辨率等優勢,在ADM的診斷中顯示出特有的優勢。ADM的膽囊壁增厚和RAS很容易被顯示出來,而RAS顯示高T2和低T1信號,可以在MRI上表現出特征性的“珍珠項鏈征”(pearl necklace sign),其特異性92.0%~98.0%[26]。在磁共振胰膽管造影(magnetic resonance cholangiopancreatography,MRCP)中,該征象更為明顯[7]。MRI結合MRCP能夠更加清晰顯示RAS,以及膽囊壁厚度、膽囊壁是否光整及是否出現鈣化和肝膽交界是否清晰等,可以明顯提高診斷準確率[3]。
2.4 影像學檢查的選擇
在ADM的初始診斷中US是首選的檢查方式,由于RAS內的膽固醇結晶或結石的顯示對ADM的診斷非常重要,就此而言US比MRI或CT具有一定的優勢,US技術的不斷進步將進一步提高其準確性[27-29]。
當US可疑ADM時,CT和MRI有助于進一步的鑒別診斷。CT對鑒別以膽囊壁增厚為主的病例時有一定的優勢,對鑒別ADM和GBC有幫助[10,20]。Yoshimitsu等[30]的研究顯示US、CT和MRI診斷ADM的綜合準確率分別為66.0%、75.0%和93.0%。而當ADM沒有特征性的影像學表現時,鑒別ADM和GBC相當困難。US聯合MRI是推薦的診斷ADM的影像學檢查方法[26]。
3 膽囊腺肌增生癥(ADM)與膽囊癌(GBC)的關系
目前關于ADM與GBC的相關性仍然存在一些爭議。GBC主要有隆起型和厚壁型,前者更容易區分良性和惡性腫瘤,主要是根據病變的大小、基底、血流特征和快速生長等。相反,在膽囊壁增厚的情況下,鑒別良、惡性病變有時非常困難[8]。雖然有報告ADM與GBC兩者同時存在,但是目前尚無研究能夠提供ADM與GBC之間分子生物學相關聯的實驗證據。Morikawa等[15]在93 例經組織學證實的ADM中,3 例標本中發現早期GBC。而有研究報告p53、bcl-2和EGFR等指標在ADM和慢性膽囊炎患者體內水平較低且無顯著性差異,但在GBC患者體內表達水平較高,且與ADM患者有顯著差異;另外,ADM的DNA含量與正常膽囊黏膜相似,而與GBC具有統計學差異[31]。因此,目前絕大多數研究者認為將ADM作為癌前期病變的循證醫學證據不足[7,21]。
ADM自身是一種良性上皮增生性病變,但可能通過繼發于ADM的膽囊持續性炎癥引起DNA損傷、刺激組織修復性增殖、形成富含細胞因子和生長因子的基質土壤,誘發、促進或影響致癌敏感性,最終間接導致GBC的發生[25]。
4 膽囊腺肌增生癥(ADM)的治療
目前在針對ADM的治療上還缺乏公認的循證醫學指南,而且外科手術的指征和手術時機仍然不斷在探索之中。對ADM一經發現即手術治療的策略,往往可能是一種過度治療,并可能帶來不必要的風險。反之,漏診GBC又會導致嚴重的后果。ADM應根據其分型,采取個性化、差異化的治療策略。如果手術治療,術中必須送冰凍病理,根據結果決定手術方式。
4.1 局限型ADM
對于局限型ADM,無論其大小,目前尚無證據證實其發生GBC的風險增加。因此,不建議對無癥狀的局限型ADM進行手術治療[4]。而當ADM合并無癥狀的膽囊結石時,并不需要改變上述治療策略,因為對大多數無癥狀的膽囊結石本身來說,并不能作為膽囊切除術的依據[7]。而一些作者建議對>10 mm的ADM行膽囊切除術,類似于對>10 mm GP的治療策略,理由是>10 mm的GP惡性風險增加[8,32]。但是,目前尚無文獻支持這一策略,特別是當影像學提供ADM的明確診斷,并能夠與其他GP明確鑒別時。當然,對無癥狀的局限型ADM需要進行隨訪,以對病變大小和生長速度進行密切觀察。
對有癥狀的局限型ADM,無論是否伴有膽囊結石應手術治療。需要強調的是術前必須排除腹痛的其他病因,在沒有禁忌證的情況下首選腹腔鏡膽囊切除術(laparoscopic cholecystectomy,LC),術后可以使癥狀完全消失。在組織學確認ADM后,無需特殊的隨訪和后續治療[4]。膽囊部分切除術由于保膽術后殘珠膽囊的結石復發率高,而且GBC的高危因素并未完全去除,因此,不建議對局限型ADM實施病灶切除或膽囊部分切除術[33]。
4.2 節段型ADM
節段型ADM狹窄遠端的膽囊體部腔內膽汁淤積和腔內高壓是形成膽囊結石的重要原因,也是RAS的小憩室內常并發膽泥、結晶和小結石的致病因素。節段型ADM中膽囊結石的發病率高于其他兩型,也顯著高于無ADM的患者。ADM行膽囊切除患者的結石患病率為51.9%~78.0%[34]。文獻報告節段型ADM可能誘發GBC,大多數學者認為GBC的發生與膽囊結石的存在、黏膜慢性炎癥等改變有關,并非ADM本身癌變[4]。Yoon等[29]的報告證實GBC和節段型ADM之間存在關聯,特別是老年人,約6.4%~6.6%的節段型ADM患者與GBC共存,GBC幾乎均發生在遠端的膽囊體部腔內,而且這一類GBC的患者往往分期更晚,預后更差[12]。
既然大多數研究者認為ADM并非癌前期病變,理論上ADM不需要特殊治療,除非有癥狀,而且不論是否合并結石。但是,考慮到節段型ADM與GBC具有一定的關聯性,共存GBC時又難以鑒別,所以,對節段型ADM患者無論是否有癥狀,無論是否合并膽囊結石均應手術治療。當高度懷疑GBC時,不建議行腹腔鏡手術[5,7]。
4.3 彌漫型ADM
針對無癥狀彌漫型ADM應對患者的年齡、性別、是否并發膽囊結石、種族、腫瘤家族史和胰膽管匯合異常等腫瘤風險因素進行個體化綜合評估。Ootani等[34]報告彌漫型ADM與GBC之間并沒有明確的關聯,預防性膽囊切除術的必要性值得進一步研究。彌漫型ADM膽囊壁彌漫增厚、膽囊腔容積減少,可造成膽囊收縮功能及濃縮功能的進一步下降,有文獻報告在彌漫型GBA中發現上皮化生現象[7]。為了明確ADM的診斷,對彌漫型ADM、尤其是無法排除GBC時,進行預防性膽囊切除術有其合理性。術前必須向患者清楚地解釋“預防”GBC和膽囊切除術并發癥之間的利益/風險平衡。此外,還應考慮患者遵守影像學隨訪的意愿,并評估膽囊切除術的預期益處,因為膽囊切除術本身的并發癥不容忽視,除特殊禁忌證外首選LC。特別是,當在判別增厚的膽囊壁內是否存在腫瘤病灶有困難,診斷存在疑問時,更應考慮手術治療,以避免漏診GBC。需要注意的是,在已知ADM的背景下,影像學檢查容易漏診早期GBC[15]。
4.4 術前無法明確診斷的ADM
盡管目前有完善的影像學診斷方法,但對于在US、CT及MRI/MRCP等檢查后,仍然無法明確診斷的疑似ADM病例,影像學檢查往往只能提示膽囊病灶的一些非特異性的表現,例如膽囊壁增厚和不典型強化等,而這些更常見于其他良性膽囊疾病。GBC和ADM均可見局灶性或者彌漫性膽囊壁增厚,而ADM僅占所有膽囊壁增厚(>3 mm)病例的25.0%[23]。因此,對有任何診斷上可疑GBC時,膽囊切除術是合理的。外科醫師應在手術室切開膽囊標本仔細觀察、進行初步的大體判斷,并應告知病理科醫師相關臨床情況,以便提供快速明確的組織學結果。如果膽囊壁增厚是由ADM引起的,則無需進一步治療,但如果是由GBC引起的,則應即刻改行根治性手術[7]。Morikawa等[15]的報告指出盡管對初步診斷為ADM的患者進行了定期隨訪,但仍發現一部分ADM患者最終證實為晚期GBC。導致這種結果的可能原因包括ADM缺乏特異性的癥狀,以及基于影像學和血清腫瘤標記物癌胚抗原(carcinoembryonic antigen,CEA),糖鏈抗原-199(cancer antigen 199,CA199)等均陰性[2]。
另一種情況是患者因膽囊的其他良性疾病接受膽囊切除術,術后病理發現ADM,這類患者無需后續治療。
4.5 ADM合并胰膽管匯合異常
一些研究報告了A D M 與胰膽管匯合異常(anomalous biliopancreatic junction,ABPJ)之間的關系,胰管與膽總管通常在十二指腸Vater壺腹部匯合,而一部分ADM患者的胰管與膽總管在十二指腸壁外匯合。當存在ABPJ時,Oddi括約肌失去控制功能,導致胰腺分泌物反流入膽囊,引起膽囊慢性炎癥[35]。而慢性炎癥的持續刺激,可以引發膽囊黏膜萎縮、肌層結締組織增生并形成RAS等病理變化,即ABPJ也是形成ADM的重要致病因素。同時,ADM除了自身發展變化外,又進一步觸發慢性炎癥,而慢性炎癥本身就是一種重要致癌因素[5]。因此,無論是否有無癥狀、是否合并原發性膽管囊狀擴張,ADM與ABPJ并存時應預防性行膽囊切除術,因為這是已知的GBC的高危因素,而且該手術指征與ADM的類型無關[7]。
5 膽囊腺肌增生癥(ADM)的隨訪
對于病情穩定且無可疑GBC的ADM患者,尤其是在沒有癥狀和膽囊結石的情況下,超聲在隨訪中具有特殊的價值。ADM的大小可能會隨著時間的推移而增大,這種變化并不視為惡性腫瘤的表現[3]。有研究者建議3~6個月隨訪一次,但這種隨訪監測應持續多長時間沒有定論[7]。考慮到膽囊切除術的風險和術后諸多的臨床癥狀,可以實施隨訪的患者有可能從中受益[4]。
6 小結
綜上所述,超聲是膽囊腺肌增生癥(ADM)首選的診斷方法,必要時行MRI檢查。無癥狀的局限型ADM無需手術,定期隨訪。膽囊切除術適用于有癥狀的和并發ABPJ的所有類型ADM,適用于節段型ADM和有選擇的彌漫型ADM,并適用于ADM與厚壁型膽管炎診斷有疑問特別是GBC無法鑒別的病例。進一步研究ADM的發病機制,提高診斷的準確性,對于獲得理想、明確的治療策略至關重要。