滲透微型實驗探究 助力高中化學教學
呂春華 廣西南寧市邕寧高級中學
實驗探究能激發學習者的興趣,增強其對所學知識的理解。為獲得良好的實驗探究效果,應注重對實驗內容進行適當創新,通過微型實驗的滲透,在鞏固所學的同時,更好地鍛煉學習者分析問題能力以及探究能力。教學實踐中應做好對實驗原理的認真分析,在對教學經驗認真總結的基礎上,通過實驗器材的合理選取組裝,創設情境新穎的微型實驗,更好地吸引學習者的注意,真正地達到激活高中化學課堂,順利完成教學目標的目的。
一、滲透Cl2相關的微型實驗
Cl2是高中化學中的重要物質,其中Cl2的性質是學習者必須掌握的內容。Cl2能夠與金屬單質、非金屬單質、水、堿等發生反應。另外,氯氣具有較強的氧化性,可氧化很多物質。實踐中為使學習者更好地理解與掌握Cl2與其他物質氧化性的強弱關系,應注重相關微型實驗的滲透,課堂上通過展示微型實驗,引導學習者認真分析實驗現象,探究實驗結論。
例如,課堂上可按照如圖1所示裝置組裝實驗器材,開展微型實驗以制取Cl2,并探究Cl2性質。已知Cl2氧化性強于HIO3,要求學習者認真觀察實驗操作,分析實驗現象,開展探究活動。
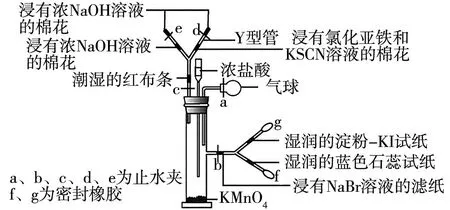
圖1
(1)加入濃鹽酸的儀器還可使用______代替。
(2)加入濃鹽酸后試管中發生的化學反應方程式為______。
(3)將濃鹽酸緩慢加入試管中,將b關閉,將c、d、e打開,使產生的Cl2緩慢充入上方Y型管,看到的實驗現象是_____;關閉c打開b,使Cl2緩慢進入右側Y型管中,實驗現象是_____。
(4)實驗中若通入的氯氣較多,淀粉-KI試紙逐漸變為無色,原因可能為_______。
(5)該裝置_____(填寫“能”或“不能”)證明氧化性Cl2>Br2>I2,原因為____,為防止污染空氣,實驗結束時的操作為_______。
制取Cl2依據的化學原理為2KMnO4+16HCl(濃)2MnCl2+2KCl+5Cl2↑+8H2O,用分液漏斗向試管中加入濃鹽酸,當生成Cl2時,打開c、d、e,關閉b,因Cl2具有漂白作用,可使潮濕的紅布條褪色。同時,Cl2具有較強氧化性,可發生反應Cl2+Na2S2NaCl+S↓,2Cl2+FeCl22FeCl3,因此,含有硫化鈉溶液的棉花中出現黃色固體,而浸有FeCl2和KSCN溶液的棉花變紅。當關閉c打開b時,因發生反應Cl2+2NaBr2NaCl+Br2,使得濾紙呈現紅棕色,Cl2與水生成HCl和HClO,使得藍色石蕊試紙先變紅后褪色。Cl2+2KI2KCl+I2,I2遇到淀粉呈現藍色。當進入Y型管中的Cl2變多,Cl2繼續和I2發生反應生成HIO3,試紙逐漸變成無色。由實驗現象可知,該微型實驗可得出Cl2的氧化性較溴、碘強,但無法證明溴的氧化性強于碘。實驗結束后,為防止多余的Cl2污染空氣,應將關閉b,打開a、c,擠壓氣球,讓NaOH溶液吸收Cl2。
該微型實驗既制取了Cl2又檢驗了Cl2的性質,而且兼顧尾氣處理,一舉多得。因該微型實驗情境新穎,很好地激發了學習者的探究欲望,達到了預期的課堂教學效果。
二、滲透濃硫酸相關的微型實驗
濃硫酸具有吸水性、脫水性、強氧化性等性質,是硫元素非常重要的化合物。因該部分內容較多,為使學習者更好地掌握濃硫酸的性質,并能根據相關的化學反應現象正確判斷濃硫酸對應的化學性質,教學實踐中注重為學生展示相關的微型實驗,激發學習者思考探究,更加牢固地掌握所學知識。
例如,課堂上采用圖2微型實驗裝置探究濃硫酸和蔗糖的碳化產物,并要求學習者思考相關問題,其中a、b都是氣球,已知CO氣體通入氯化鈀溶液,溶液變為黑色。
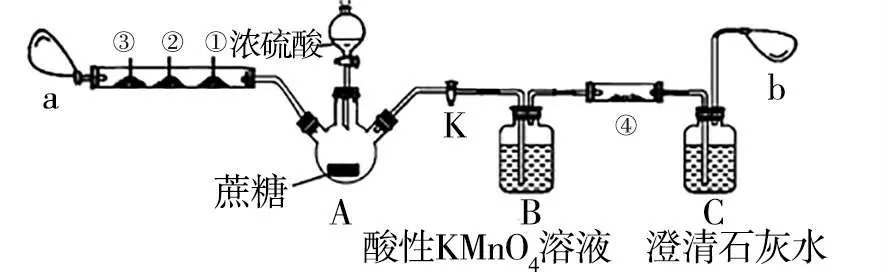
圖2
實驗步驟:其一,檢驗裝置氣密性;其二,將滴有酸性高錳酸鉀溶液的濾紙、滴有品紅溶液的濾紙、浸有氯化鈀溶液的濾紙和浸有溴水的濾紙分別放入到①②③④處;其三,夾好止水夾K,向蔗糖上滴加3~4滴蒸餾水,加入濃硫酸發生反應,其中③中的濾紙變成了黑色;其四,將K打開,使氣體緩慢進入B和C中,一段時間后④處濾紙顏色無變化,C中澄清石灰水變渾濁。
(1)盛濃硫酸的儀器名稱為_____,實驗體現了濃硫酸的哪些性質:______。
(2)實驗中向蔗糖上滴水的目的是______。
(3)若反應產物中兩種碳的氧化物相同條件下具有相同的體積,則蔗糖碳化后發生的反應方程式為______。
(4)步驟四操作的目的是_____。
(5)若用滴加酸性高錳酸鉀溶液的試紙替代B,且置于雙通玻璃管后,分析其給實驗帶來的影響:_____。
觀察微型實驗裝置可知,盛濃硫酸的儀器為分液漏斗,實驗中濃硫酸和蔗糖發生反應,并且生成CO,體現了濃硫酸的吸水性、脫水性以及強氧化性。向蔗糖上滴水稀釋濃硫酸時放出熱,可增加反應速率,使得蔗糖快速脫水。實驗中澄清石灰水變渾濁表明生成了二氧化碳氣體,且CO和CO2在相同條件下的體積相同,根據氧化還原反應知識可得出對應的化學反應方程式為2C+3H2SO4(濃)。因產物中有SO2產生,因此,使其產物通過酸性高錳酸鉀溶液,除去生成的SO2,得出生成的產物中確實含有二氧化碳的結論。若使用滴有酸性高錳酸鉀溶液的試紙,因其含有高錳酸鉀的量較少,無法保證將產物中的二氧化硫除盡,對二氧化碳的檢驗造成干擾。
該微型實驗既進行了濃硫酸與蔗糖的反應,驗證了濃硫酸的性質,又適當地拓展了教學內容,鍛煉了學習者的探究與分析問題能力,教學效果顯著。
三、滲透CuO相關的微型實驗
CuO是學習者較為熟悉的銅的氧化物。高中化學教學中應注重圍繞CuO開展相關的微型實驗探究活動,從學習者熟悉的物質入手,逐漸地過渡到高中化學知識的學習與探究中,降低學習者學習陌生感,給學習者留下深刻的實驗印象,使其更好地把握所學知識本質。
例如,在課堂上使用圖3所示微型實驗進行氫氣還原氧化銅的實驗。實驗時將銅絲1下端彎曲一小圓環,并用鐵錘錘擊成帶小孔的小匙。將銅絲2一端彎曲成螺旋狀。已知乙醇、乙醛的沸點分別為78.5 ℃、20.8 ℃,銅作催化劑時乙醇被氧化的反應溫度為550 ℃。而后要求學習者結合所學以及理解回答如下問題:
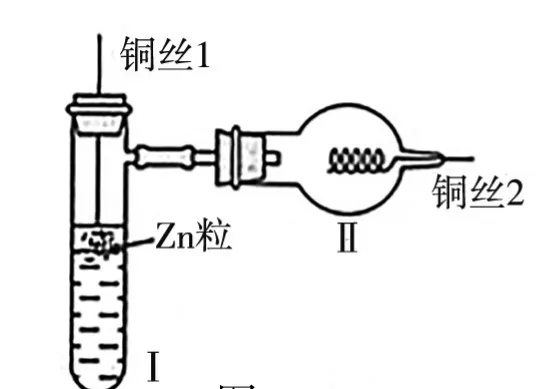
圖3
(1)試管Ⅰ中先加入的試劑為____。
(2)Ⅱ中銅絲的具體操作為_____;Ⅰ、Ⅱ中實驗現象分別為_____、______。
(3)實驗處理銅絲1的目的是______、______,處理銅絲2的目的是_______。
(4)使用圖4裝置進行實驗,其中X為乙醇,稍微加熱,銅絲操作和銅絲2相同,發現銅絲由黑變紅,過一會兒在干燥管內有乙醛生成;而如果持續進行加熱,銅絲不按銅絲2操作,將光亮螺旋銅絲深入同樣位置,等待較長時間后沒有生成乙醛,可能的原因為_______。

圖4
觀察微型實驗裝置可知Ⅰ中的裝置是制取H2,因使用Zn粒,因此,試管中應先加入稀硫酸或鹽酸。為保證實驗安全性,應待Ⅰ中的反應進行一段時間,將裝置中的空氣排凈,而后將銅絲在酒精燈上加熱至紅熱迅速深入到Ⅱ中。其中Ⅰ中的實驗現象為Zn粒逐漸溶解,溶液中出現較多氣泡;Ⅱ中銅絲由黑色逐漸變成亮紅色。處理銅絲1的目的是銅和酸形成原電池,提高氫氣產生速率,并且隨時提高Zn粒終止反應,便于控制實驗。將銅絲2彎曲成螺旋狀,可提高銅絲局部溫度,增強化學反應速率。若持續加熱X,乙醇會將裝置中的空氣排凈,無法生成CuO,不能進行氧化反應,因此,沒有乙醛生成。
該微型實驗以H2還原氧化銅為背景,結合高中化學知識對實驗內容進行適當拓展,給學生帶來似曾相識的感覺,驅使其主動地進行探究,既鞏固了所學知識,又鍛煉了分析問題能力。
四、滲透SO2有關的微型實驗
SO2是重要的氣體,相關知識點多且是測試的熱門考點,掌握SO2的性質是學習的重點。教學實踐中為防止學習者產生枯燥感,牢固掌握SO2的性質,應注重采用微型實驗替代傳統實驗,以達到降低實驗難度、節省實驗藥品的目的,提升實驗教學效果。
例如,為探究SO2的性質,使用硬質玻璃管做如圖5所示微型實驗(夾持儀器已省略)。同時,要求學習者積極聯系所學,回答以下問題:
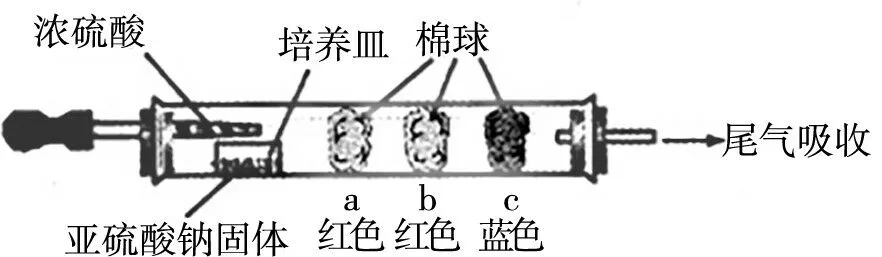
圖5
(1)寫出反應中生成SO2的反應方程式:______。
(2)棉球a的實驗現象為先變白,加熱后變紅,則其上蘸有的試劑為____,得出的結論為_____。
寧德市 (118°32’-120°43’E,26°18’-27°40’N)位于長江三角洲、珠江三角洲、臺灣省三大經濟區的中間位置,總面積1.35萬平方公里,以山地、丘陵為主,海岸線長度1046公里,占全省域的27.88%,海域面積4.46萬平方公里。2016年人口數 3.52×106人,國內生產總值(GDP)1.62×1011元。全市生態環境質量保持優良水平,2017年環境空氣質量達標天數比例97.7%,飲用水水源地水質達標率為100%,斷面功能率達標100%。由白水洋、太姥山、白云山三大景區組成的“寧德世界地質公園”被聯合國教科文組織正式列入世界地質公園網絡名錄。
(3)棉球b蘸有含酚酞的NaOH溶液,則對應的實驗現象為____,發生的離子方程式為_____。
(4)棉球c蘸有I2和淀粉的混合溶液,對應的實驗現象為_____,發生的化學反應為_____,得出的結論為_____。為了研究SO2的性質,需要首先制取SO2,根據微型實驗裝置中提供的試劑可知,該實驗使用濃硫酸與亞硫酸鈉固體反應,對應的化學反應方程式為H2SO(4濃)+Na2SO3Na2SO4+SO2↑+H2O。二氧化硫能夠使品紅溶液褪色,加熱后又恢復原來的顏色,因此,棉球a蘸有的試劑應為品紅溶液,得出的結論為二氧化硫具有漂白性;含酚酞的氫氧化鈉溶液呈紅色,但是當二氧化硫與氫氧化鈉溶液發生反應,溶液堿性降低,棉球漸變為白色,對應的離子方程式為SO2+2OH-SO32-+H2O。二氧化硫因具有還原性可與碘發生反應SO2+I2+2H2O2HI+H2SO4,棉球c的藍色逐漸變弱。
該微型實驗使用的器材較少,但研究的內容并不少,既制取了SO2,同時又驗證了SO2的漂白性、還原性以及與堿反應的性質。不僅如此,通過加裝尾氣處理裝置,將剩余的SO2全部吸收,避免了空氣污染。通過該微型實驗開展教學活動,給學生留下深刻影響,使其搞清楚了SO2相關性質以及具體表現。
五、滲透電化學有關的微型實驗
電化學是高中化學的重點知識。學習該部分知識的關鍵在于深入理解原電池以及電解池原理,并能夠從氧化還原反應視角解釋不同電極下發生的電極反應。教學實踐中為使學習者更好地把握電化學的本質,抓住分析問題的關鍵,應結合教學內容在課堂上設計與展示相關微型實驗,并預留相關空白時間,要求學習者積極思考與探究相關問題。
例如,課堂上使用如圖6所示微型實驗裝置開展相關探究活動,實驗時先將K1閉合,K2斷開,兩極均出現了氣泡;一段時間后,將K1斷開,K2閉合,電流表有偏轉。據此回答問題:
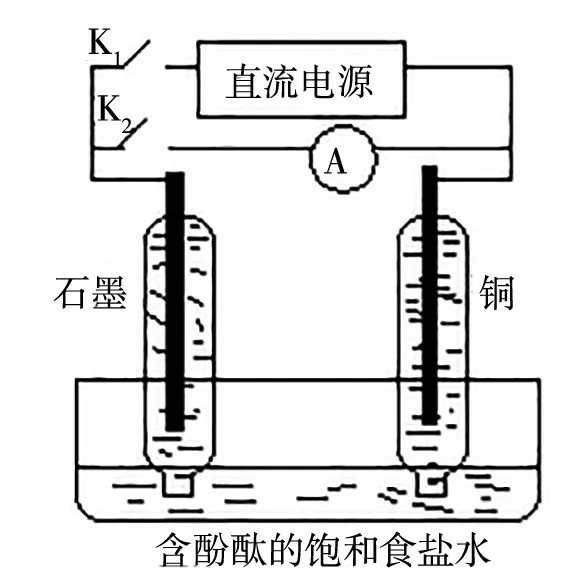
圖6
(1)將K2斷開,K1閉合時,石墨為_____極,銅為_____極,兩極產生的氣體分別為___、______;總電極反應式為________;銅電極附近溶液pH_____(填寫“不變”“變大”或“變小”)。
(2)將K1斷開,K2閉合,石墨電極的電極反應式為______;電路中轉移1 mol電子時,在____極,生成_____mol的H2O。
當K2斷開,K1閉合時,電路中接入了直流電源顯然屬于電解池,即電解飽和食鹽水。由電解池原理可得總的電極反應式為2H2O+2Cl-H2↑+Cl2↑+2OH-,此時石墨為陽極,產生Cl2,銅為陰極,產生H2,因其產生H2,導致附近溶液的OH-濃度增加,因此,對應的pH增大。當K1斷開,K2閉合時為原電池,石墨電極為正極,銅電極為負極,石墨電極的電極反應為Cl2+2e-2Cl-,銅電極的電極反應為H2-2e-+2OH-2H2O,電路中轉移1 mol電子在負極生成1 mol H2O。
該微型實驗涉及電解池與原電池,通過探究相關問題能進一步加深學習者對原電池、電解池原理的理解,使其更加清晰地認識到兩者之間的區別,進一步提高學習效率。
高中化學教學中滲透微型實驗,給學習者提供探究機會,驅使其主動思考,加深印象,有助于其搞清楚化學知識的來龍去脈,更好地理解與掌握相關化學知識精髓,因此教學實踐中應充分認識到微型實驗的重要作用,結合具體教學內容,做好微型實驗的設計與滲透,提升學習體驗,激發學習潛力,促進課堂教學效率的有效提升。

