舒肝解郁膠囊通過激活JAK1/STAT3信號通路改善大鼠抑郁癥及修復海馬神經元細胞
白天山,李志榕,黃 平,徐 燁,柳文華
1.開封市第五人民醫院醫教科,開封 475000;2.開封市第五人民醫院精神科一病區,開封 475000;3.商丘市第二人民醫院精神科三病區,商丘 476000;4.河南大學淮河醫院科研與研究生工作部,開封 475000
抑郁癥的具體發病機制尚未明確,神經元和神經的可塑性假說是目前公認的主要病理機制之一[1]。研究證實[2],抑郁癥患者存在海馬體積縮小和神經元缺失的情況。因此,抑制神經元細胞凋亡已成為抑郁癥的治療目標之一。中醫學將抑郁癥歸為“郁證”范疇,為情志不舒、肝氣郁結所致,治療應以疏肝理氣解郁為主[3]。舒肝解郁膠囊是具有疏肝理氣、健脾安神作用的中成藥,適用于情緒低落、興趣遲滯的單項抑郁癥患者的治療[4]。本研究通過慢性輕度不可預見性應激結合孤養建立抑郁癥大鼠模型,探討舒肝解郁膠囊對抑郁癥及海馬神經元細胞損傷的改善和修復作用,并探討其機制。
1 儀器與材料
1.1 儀器
SM2010R型徠卡切片機[徠卡顯微系統(上海)貿易有限公司];3550UV 型酶標儀、7500型實時熒光定量PCR儀均購自美國Bio-Rad公司;JP-K600型全自動化學發光成像分析系統(上海嘉鵬科技有限公司)。
1.2 試藥
舒肝解郁膠囊(批號200313,四川濟生堂藥業有限公司);氟西汀(批號19041128,蘇州中化藥品工業有限公司);JAK 激酶抑制劑AG490(批號YT316,北京百奧萊博科技有限公司);兔抗鼠酪氨酸蛋白激酶-1 (tyrosine-protein kinase 1,JAK1,貨 號abx027832),信號轉導激活轉錄因子-3(signal transducer activated transcription factor-3,STAT3,貨號A73260-100),磷酸化(p)-JAK1(貨號abx009836),p-STAT3(貨號20R-2918)多克隆抗體及辣根過氧化物酶標記的羊抗兔二抗均購自艾美捷科技有限公司。
1.3 動物
SPF級雄 性SD 大 鼠,50 只,6 周 齡,體 質 量 為200~240 g,購自北京維通利華實驗動物技術有限公司,生產許可證號SCXK(京)2016-0011。
2 方法
2.1 造模及給藥
所有大鼠適應性飼養1周,稱體質量后隨機分為對照組、模型組、舒肝解郁膠囊組、陽性藥物組、舒肝解郁膠囊+AG490組,每組10只。除對照組外,均采用慢性輕度不可預見性應激結合孤養建立抑郁癥大鼠模型[5],電擊足底(電流強度1 m A,電壓45 m V,10 s/次,間 隔1 min,共30 次),冰 水 游 泳(4 ℃,5 min),束 縛(8 h),搖 晃(1 次/s,15 min)、夾 尾(3 min),熱應激(45℃,5 min),禁食(24 h),禁水(24 h),晝夜顛倒、傾斜鼠籠與潮濕墊料(100 g墊料中加入200 m L 水)。每天給予1種處理方式,順序隨機,連續處理21 d,單籠飼養。對照組除每天抓取1次外,正常飼養,不采取其他處理。舒肝解郁膠囊組自建模第1天開始給予舒肝解郁膠囊150 mg·kg-1(以質量濃度5 g·L-1羧甲基纖維素鈉懸浮液配制)灌胃,陽性藥物組以氟西汀1.54 m L·kg-1灌胃(以質量濃度為5 g·L-1的羧甲基纖維素鈉懸浮液配制),舒肝解郁膠囊+AG490 組以舒肝解郁膠囊150 m L·kg-1+AG490 5 m L·kg-1灌胃,對照組和模型組以質量濃度為5 g·L-1的羧甲基纖維素鈉12.5 mg·kg-1灌胃,每日1次,至建模結束。
2.2 大鼠行為學評價
敞箱實驗于灌胃結束24 h 后進行。敞箱為80 cm×80 cm×4 cm 的無蓋立柱體,周壁均為黑色,底部為白色,底部劃分為16 cm×16 cm 的方格25個。將大鼠置于箱內底板中心,以穿越底板格數為水平活動得分,穿越1格記1分(4只腳均在同一格子內),若沿線行走則每行走10 cm 記1分。以大鼠直立次數為垂直活動得分(雙足離開底板),直立1次記1分,每次記錄10 min。水平活動反映大鼠活動度,垂直活動反映大鼠對新鮮環境的好奇程度。敞箱實驗得分=水平活動得分+垂直活動得分。
糖水消耗實驗于敞箱實驗結束后進行,以10 g·kg-1蔗糖溶液和自來水供大鼠飲用,通過測量禁水2.5 h后大鼠1 h內的糖水和自來水消耗量,計算糖水消耗百分比。糖水消耗百分比=(糖水消耗量/總液體消耗量)×100%。
2.3 海馬區神經元細胞觀察
糖消耗實驗后用斷頭法處死大鼠,每組任選5只取雙側海馬組織,以體積分數為4%的多聚甲醛固定24 h,組織塊常規脫水、透明、浸蠟及石蠟包埋,切片,厚度5μm。
Nissl染色:組織切片脫蠟、乙醇脫水及水洗后,加入緩沖亞甲藍染液染色10 min,0.2 mol·L-1乙酸鹽分色2 min,觀察海馬CA1區神經元存活情況,陽染為胞核淡染,胞質藍色,細胞輪廓清晰,用ImagePro Plus 6.0軟件對存活神經細胞進行計數,任選5個視野計算平均值。
Tunel染色:組織切片脫蠟水洗后加入Tunel反應混合液,于濕盒中37℃孵育60 s,用PBS沖洗,加入POD 轉化劑,于濕盒中37℃孵育30 s,用PBS沖洗,加入DAB底物溶液,室溫孵育3 s,用PBS沖洗,用蘇木素復染,脫水,干燥,用中性樹膠封片,置于光鏡下觀察,陽染細胞核可見棕黃色顆粒,選擇具有代表性的海馬CA1 區分析結果,任選5 個視野計數Tunel陽性細胞數。
2.4 海馬組織JAK1、STAT 3 mRNA表達水平的檢測
取出每組剩余5只大鼠的海馬組織立即置于液氮中,后保存于-80℃備用。取保存于-80℃的左側海馬組織,置于液氮中研磨,用Trizol法提取總RNA,逆轉錄獲得cDNA,用瓊脂糖凝膠電泳法鑒定產物后進行實時熒光定量PCR。引物序列見表1。根據試劑盒說明書設定反應體系。反應條件:96℃預變性5 min,94℃變性20 s,58℃退火40 s,72℃延伸50 s,重復45 個循環。以β-actin 為內參基因,2-CT為目的基因的相對表達強度,所有實驗重復3次取平均值。

表1 基因引物序列Tab.1 Gene primer sequences
2.5 海馬組織JAK1、p-JAK1、STAT3和p-STAT3蛋白檢測
取保存于-80℃的每組右側海馬組織,用BCA法檢測蛋白濃度,SDS-PAGE 電泳分離,轉移至PVDF膜,加入封閉液置于室溫搖床中封閉1 h,加入用封閉液稀釋的一抗(1∶500),4℃孵育過夜,用洗液洗膜3次,加入用封閉液稀釋的二抗(1∶2 000),室溫孵育2 h,于暗室中曝光、顯影和定影。用Image J軟件進行灰度值分析,以目的蛋白灰度值與內參β-actin灰度值的比值表示蛋白的相對表達量,并計算p-JAK1/JAK1、p-STAT3/STAT3。
2.6 統計學方法
3 結果
3.1 敞箱實驗得分與糖水消耗百分比比較
與對照組比較,模型組敞箱實驗得分及糖水消耗百分比降低(P<0.01);與模型組比較,陽性藥物組敞箱實驗得分、糖水消耗百分比升高(P<0.01);與陽性藥物組比較,舒肝解郁膠囊組敞箱實驗得分、糖水消耗百分比降低(P<0.01);與舒肝解郁膠囊組比較,舒肝解郁膠囊+AG490組敞箱實驗得分、糖水消耗百分比降低(P<0.01);模型組與舒肝解郁膠囊+AG490組敞箱實驗得分、糖水消耗百分比比較,差異無統計學意義(P>0.05)。結果見表2、圖1。

圖1 海馬CA1區Nissl染色結果(×400)Fig.1 Results of Nissl staining in CA1 area of hippocampus(×400)
表2 敞箱實驗得分、糖水消耗百分比比較(±s,n=10)Tab.2 Comparison of scores of open field test and percentage of sugar water consumption(±s,n=10)
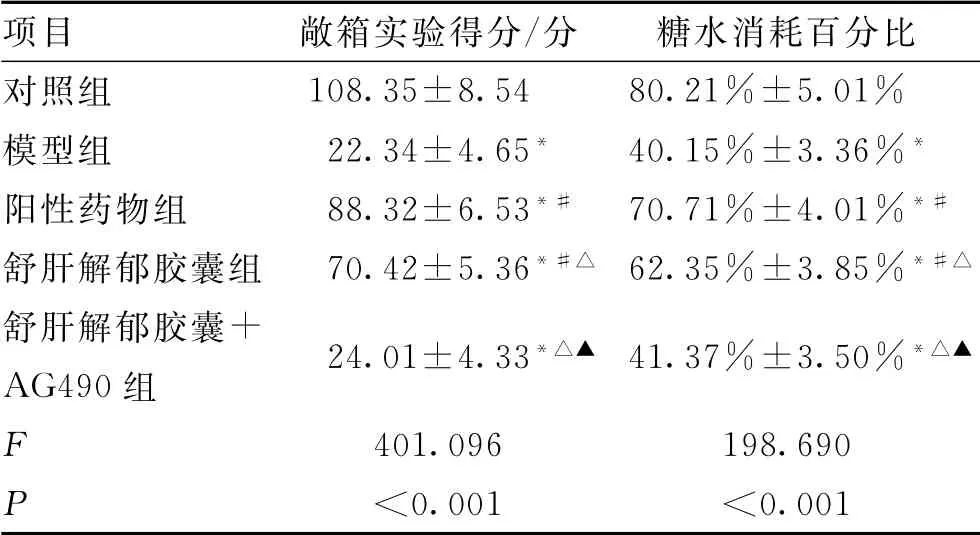
表2 敞箱實驗得分、糖水消耗百分比比較(±s,n=10)Tab.2 Comparison of scores of open field test and percentage of sugar water consumption(±s,n=10)
注:與對照組比較,*P<0.01;與模型組比較,#P<0.01;與陽性藥物組比較,△P<0.05;與舒肝解郁膠囊組比較,▲P<0.01。
項目 敞箱實驗得分/分 糖水消耗百分比對照組 108.35±8.54 80.21%±5.01%模型組 22.34±4.65* 40.15%±3.36%*陽性藥物組 88.32±6.53*# 70.71%±4.01%*#舒肝解郁膠囊組 70.42±5.36*#△ 62.35%±3.85%*#△舒肝解郁膠囊+AG490組 24.01±4.33*△▲ 41.37%±3.50%*△▲F 401.096 198.690 P<0.001 <0.001
3.2 海馬組織神經元細胞存活情況比較
與對照組比較,模型組神經元細胞存活數量減少(P<0.01);與模型組比較,陽性藥物組神經元細胞存活數量增加(P<0.01);與陽性藥物組比較,舒肝解郁膠囊組神經元細胞存活數量減少(P<0.01);與舒肝解郁膠囊組比較,舒肝解郁膠囊+AG490 組神經元細胞存活數量增加(P<0.01);模型組與舒肝解郁膠囊+AG490組神經元細胞存活數量比較,差異無統計學意義(P>0.05)。結果見表3、圖2。

圖2 海馬CA1區Tunel染色結果(×400)Fig.2 Results of Tunel staining in CA1 area of hippocampus(×400)
表3 海馬組織神經細胞存活數量比較(±s,n=10)Tab.3 Comparison of survival number of nerve cells(±s,n=10)

表3 海馬組織神經細胞存活數量比較(±s,n=10)Tab.3 Comparison of survival number of nerve cells(±s,n=10)
注:與對照組比較,*P<0.01;與模型組比較,#P<0.01;與陽性藥物組比較,△P<0.05;與舒肝解郁膠囊組比較,▲P<0.01。
項目 神經元細胞存活數量/個對照組155.20±10.12模型組 45.40±5.85*陽性藥物組 122.40±8.35*#舒肝解郁膠囊組 102.60±7.81*#△舒肝解郁膠囊+AG490組 46.40±6.01*△▲F 401.096 P<0.001
3.3 海馬組織神經元細胞凋亡情況比較
與對照組比較,模型組的凋亡細胞數量增加(P<0.01);與模型組比較,陽性藥物組的凋亡細胞數量減少(P<0.01);與陽性藥物組比較,舒肝解郁膠囊組凋亡細胞數量增加(P<0.01);與舒肝解郁膠囊組比較,舒肝解郁膠囊+AG490 組凋亡細胞數量減少(P<0.01);模型組與舒肝解郁膠囊+AG490組神經元細胞凋亡數量比較,差異無統計學意義(P>0.05)。結果見表4。
表4 神經細胞凋亡數量比較(±s,n=10)Tab.4 Comparison of neuronal apoptosis of nerve cells(±s,n=10)
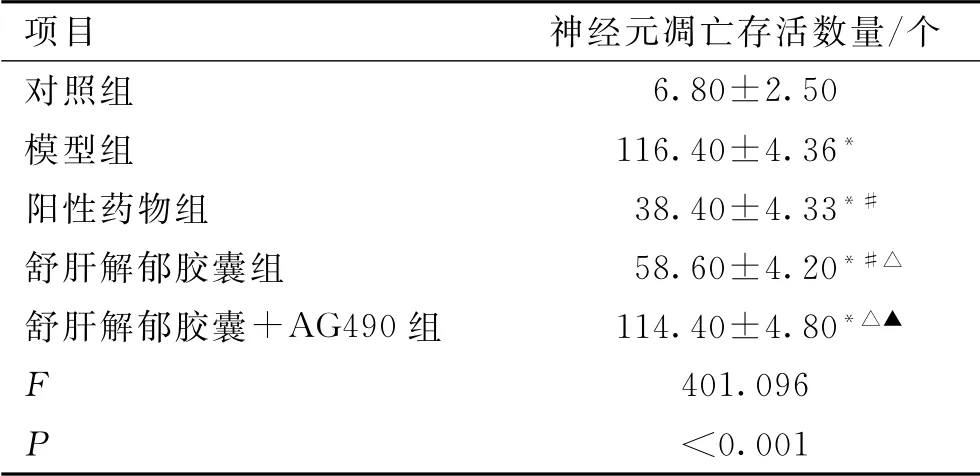
表4 神經細胞凋亡數量比較(±s,n=10)Tab.4 Comparison of neuronal apoptosis of nerve cells(±s,n=10)
注:與對照組比較,*P<0.01;與模型組比較,#P<0.01;與陽性藥物組比較,△P<0.05;與舒肝解郁膠囊組比較,▲P<0.01。
項目 神經元凋亡存活數量/個對照組6.80±2.50模型組 116.40±4.36*陽性藥物組 38.40±4.33*#舒肝解郁膠囊組 58.60±4.20*#△舒肝解郁膠囊+AG490組 114.40±4.80*△▲F 401.096 P<0.001
3.4 海馬組織JAK1、STAT3 mRNA 表達水平比較
JAK1、STAT3 mRNA 的相對表達量組間比較,差異無統計學意義(P>0.05)。結果見表5、圖3。
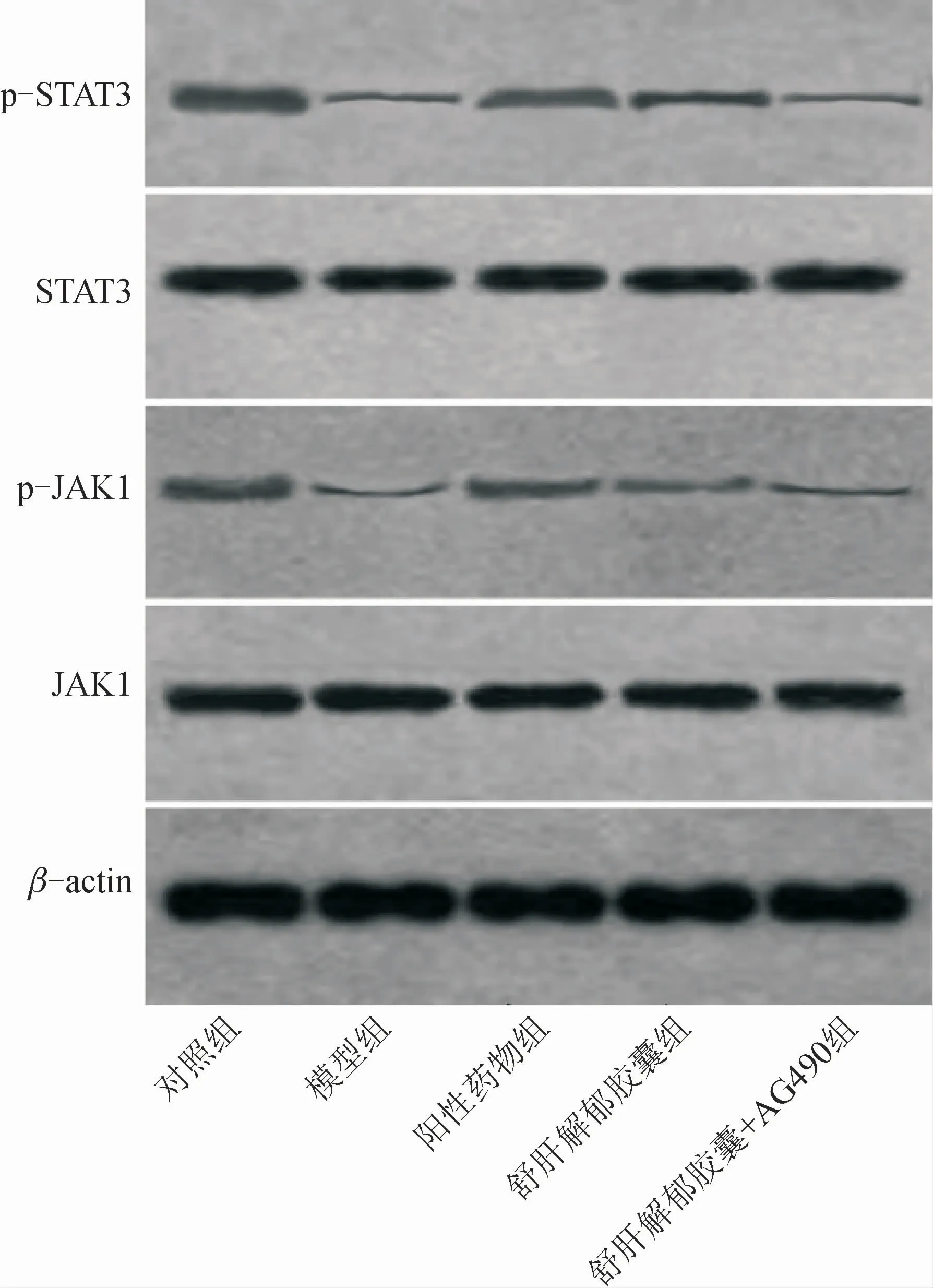
圖3 Western blot檢測海馬組織JAK1、p-JAK1、STAT3及p-STAT3蛋白表達情況Fig.3 Protein expression of Jak1,p-jak1,STAT3 and p-STAT3 detected by Western blot
表5 JAK1、STAT3 mRNA相對表達量比較(±s,n=10)Tab.5 Comparison of relative expression of JAK1 and STAT3 mRNA(±s,n=10)
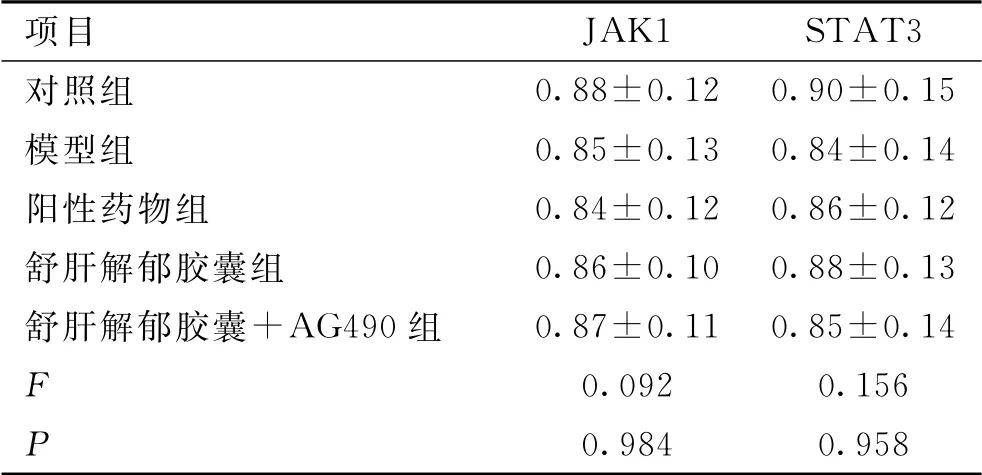
表5 JAK1、STAT3 mRNA相對表達量比較(±s,n=10)Tab.5 Comparison of relative expression of JAK1 and STAT3 mRNA(±s,n=10)
項目JAK1 STAT3對照組0.88±0.12 0.90±0.15模型組 0.85±0.13 0.84±0.14陽性藥物組 0.84±0.12 0.86±0.12舒肝解郁膠囊組 0.86±0.10 0.88±0.13舒肝解郁膠囊+AG490組 0.87±0.11 0.85±0.14 F 0.092 0.156 P 0.984 0.958
3.5 海 馬 組 織p-JAK1/JAK1、p-STAT3/STAT3比較
與對 照 組 比 較,模 型 組p-JAK1/JAK1、p-STAT3/STAT3降低(P<0.01);與模型組比較,陽性藥物組p-JAK1/JAK1、p-STAT3/STAT3升高(P<0.01);與陽性藥物組比較,舒肝解郁膠囊組p-JAK1/JAK1、p-STAT3/STAT3降低(P<0.01);與舒肝解郁膠囊組比較,舒肝解郁膠囊+AG490組p-JAK1/JAK1、p-STAT3/STAT3降低(P<0.01);模型組與舒肝解郁膠囊+AG490組p-JAK1/JAK1、p-STAT 3/STAT 3比較,差異無統計學意義(P>0.05)。結果見表6。
表6 p-JAK1/JAK1、p-STAT3/STAT3比較(±s,n=10)Tab.6 Comparison of p-JAK1/JAK1 and p-STAT3/STAT3(±s,n=10)

表6 p-JAK1/JAK1、p-STAT3/STAT3比較(±s,n=10)Tab.6 Comparison of p-JAK1/JAK1 and p-STAT3/STAT3(±s,n=10)
注:與對照組比較,*P<0.05;與模型組比較,#P<0.05;與陽性藥物組比較,△P<0.05;與舒肝解郁膠囊組比較,▲P<0.05。
項目 p-JAK1/JAK1 p-STAT3/STAT3對照組0.88±0.08 0.92±0.08模型組 0.22±0.04* 0.25±0.05*陽性藥物組 0.61±0.06*# 0.71±0.06*#舒肝解郁膠囊組 0.43±0.05*#△ 0.54±0.05*#△舒肝解郁膠囊+AG490組 0.23±0.04*△▲ 0.24±0.04*△▲F 123.137 132.048 P<0.001 <0.001
4 討論
研究發現[6],慢性應激狀態可促進腦內谷氨酸的釋放,導致神經元細胞損傷,海馬體積縮小。海馬體積縮小則影響其對下丘腦-垂體-腎上腺素軸的負反饋調節,導致激素、神經遞質分泌發生改變,加重抑郁癥狀[7]。因此,減輕神經元損傷在抑郁癥的治療中意義重大。中醫學認為肝郁是抑郁癥發病的核心,同時涉及脾、腎等多個臟器,因此疏肝理氣、健脾補腎是治療的關鍵[8]。
舒肝解郁膠囊由貫葉金絲桃和刺五加組成,貫葉金絲桃歸肝經,可疏肝解郁、清熱利濕[9]。刺五加歸脾、肺、心及腎經,可益氣健脾、補腎安神[10]。現代藥理研究結果[11-12]表明,貫葉金絲桃中的間苯三酚類化合物及刺五加中的皂苷類化合物,可促進神經遞質的重吸收與神經突觸的重建,有抗抑郁及抗應激作用。傅松年等[13]研究發現貫葉金絲桃提取物對抑郁模型小鼠抑郁行為有改善作用。徐向東等[14]認為,刺五加含藥血清能促進海馬神經元的存活。本研究結果顯示,經舒肝解郁膠囊干預后抑郁癥大鼠敞箱實驗得分、糖水消耗百分比、神經元細胞存活數量增加,說明舒肝解郁膠囊能有效改善大鼠的抑郁行為,促進神經元細胞存活、抑制凋亡。
JAK1/STAT3信號通路是眾多細胞因子信號轉導的共同途徑,參與神經細胞的增殖、分化、凋亡及炎癥反應過程[15]。JAKs能促進STATs磷酸化,與相應的靶基因啟動子結合,激活相關基因的表達和轉錄[16-17]。研 究 表 明[18],在 腦 組 織 受 損 時,JAK1/STAT3信號轉導通路可被激活誘導細胞的增殖、分化和凋亡。另有研究發現,JAK1/STAT3信號通路的激活能減輕β-淀粉樣蛋白所致大鼠海馬神經元損傷[19]。錢磊等[20]的研究顯示,JAK1/STAT3信號通路具有神經保護作用。在本研究中,經舒肝解郁膠囊干預 后 大 鼠p-JAK1/JAK1、p-STAT3/STAT3 升高,用JAK1/STAT3 抑制劑后,敞箱實驗得分與p-JAK1/JAK1、p-STAT3/STAT3 降 低,表 明 舒 肝 解郁膠囊能改善抑郁癥大鼠抑郁行為,保護海馬神經元細胞,其機制與JAK1/STAT 3信號通路的激活有關。
綜上所述,舒肝解郁膠囊可能通過激活JAK1/STAT3信號通路改善抑郁癥大鼠的抑郁行為,促進海馬神經元細胞存活、抑制凋亡。舒肝解郁膠囊中不同化學成分的藥理作用不同,對抑郁癥的影響機制不一,今后可進一步探討舒肝解郁膠囊作用于抑郁癥的其他機制,為抑郁癥的治療提供更多參考信息。

