重組人腦利鈉肽聯合尼可地爾治療急性心肌梗死合并心力衰竭的療效
董 榮,王志華,陳龍錦
鹽城市第一人民醫院心血管內科,鹽城 224000
急性心肌梗死(AMI)主要是因冠狀動脈急性閉塞阻礙血液循環,引起血流中斷,造成心肌局部缺血性壞死,破壞心肌結構功能,導致急性病理性損傷發生所致。AMI患者由于心肌部分有缺血壞死現象,使得血流動力學表達異常,心肌收縮力下降,機體代謝無法得到足夠的心輸出量支持,使得肺循環和體循環受阻,導致交感神經和腎上腺素-血管緊張素-醛固酮系統被激活,從而加重心力衰竭表現[1]。臨床對AMI合并心力衰竭常進行利尿、抗凝和擴血管及吸氧等治療,可起到緩解癥狀的效果。重組人腦利鈉肽(rh BNP)具有阻礙或延緩心力衰竭病情發展、調節心功能等作用[2]。尼克地爾可使體內鈣離子水平下降,避免心室重構發生[3]。本研究探討rhBNP聯合尼克地爾治療AMI合并心力衰竭的療效。
1 資料與方法
1.1 一般資料
選擇112例AMI合并心力衰竭患者作為研究對象。納入標準:①經臨床心電圖、冠狀動脈造影等檢查符合《急性心肌梗死診斷和治療指南》診斷標準[4];②心電圖相應導聯ST 抬高≥0.2 m V;③缺血性持續性胸痛≥30 min;④心功能基利普(Killip)分級在Ⅱ~Ⅳ級之間;⑤知情同意且自愿參與本研究;⑥研究已獲醫院倫理委員會批準。排除標準:①近期(1個月內)有嚴重外傷或手術治療史;②肝、腎及肺等伴有嚴重器質性病變;③患有全身系統性及代謝性疾病;④伴出血性腦卒中及消化道出血表現者;⑤嚴重精神疾病及認知障礙者;⑥臨床資料不完整者;⑦中途退出者。依據隨機數字表法將入選患者分為觀察組與對照組,2組患者性別、年齡、合并癥及心功能分級等一般資料比較差異無統計學意義(P>0.05),具有可比性。見表1。
表1 2組患者一般資料比較(n=56,±s)Tab.1 Comparison of general information between the 2 groups of patients(n=56,±s)
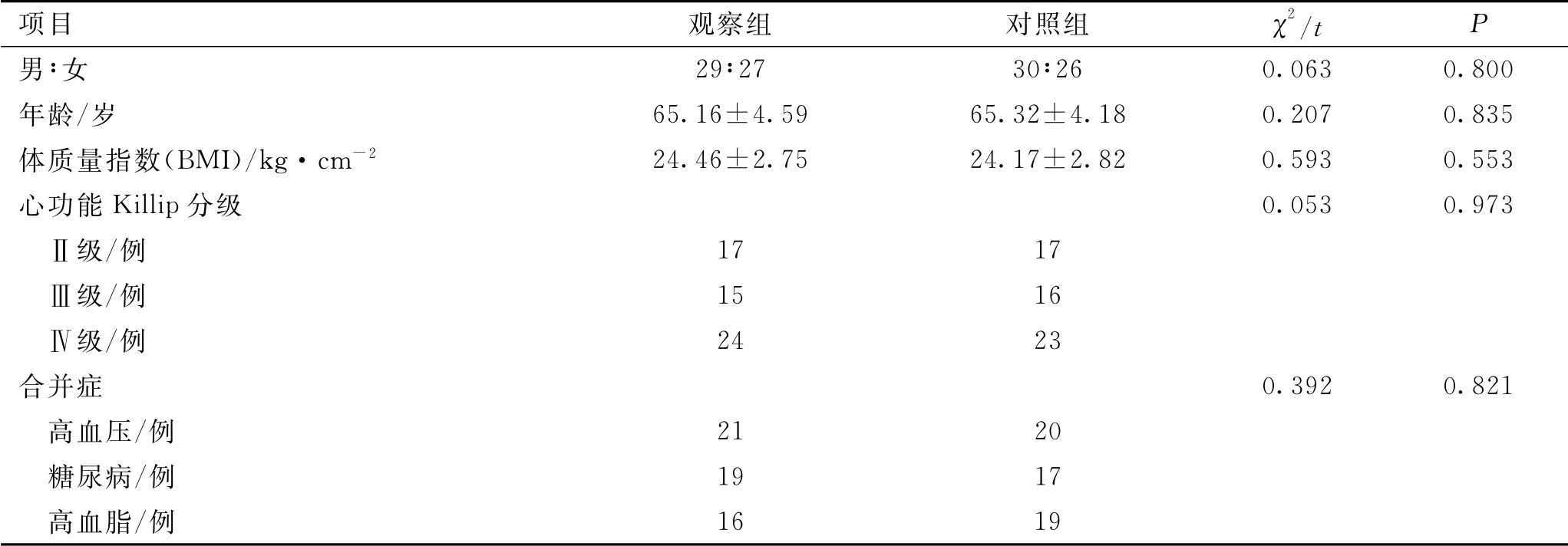
表1 2組患者一般資料比較(n=56,±s)Tab.1 Comparison of general information between the 2 groups of patients(n=56,±s)
項目 觀察組 對照組 χ2/t P男∶女29∶27 30∶26 0.063 0.800年齡/歲 65.16±4.59 65.32±4.18 0.207 0.835體質量指數(BMI)/kg·cm-2 24.46±2.75 24.17±2.82 0.593 0.553心功能Killip分級 0.053 0.973 Ⅱ級/例 17 17 Ⅲ級/例 15 16 Ⅳ級/例 24 23合并癥 0.392 0.821 高血壓/例 21 20 糖尿病/例 19 17 高血脂/例16 19
1.2 治療方法
2組患者入院后均予以β受體阻滯劑、抗凝、擴血管、強心利尿、吸氧及維持電解質平衡等對癥處理,并根據情況給予介入或溶栓治療。對照組在此基礎上給予尼可地爾(西安漢豐藥業有限責任公司,規格:5 mg)治療:每次口服10 mg,每日服用3次。觀察組在對照組治療的基礎上靜脈注射rh BNP(成都諾迪康生物制藥有限公司,規格:0.5 mg)治療:首次劑量維持在1.5μg·kg-1,勻速靜脈注射80 s,并以0.007 5μg·kg-1·min-1維持靜脈注射3 h,按患者血流動力學及血壓表現,若收縮壓(SBP)超過85 mm Hg及平均壓超過65~80 mm Hg將劑量維持在0.015~0.030μg·kg-1·min-1,行靜脈泵入維持20 h。2組患者均維持治療1個月。
1.3 觀察指標
(1)療效評價:參照《急性心肌梗死診斷和治療指南》[4]評價患者的治療效果。經治療1個月后患者臨床癥狀得到明顯改善或消除,心功能Killip分級改善>2級為顯效;經治療1個月后患者臨床癥狀得到好轉,心功能Killip 分級改善>1 級為有效;經治療1個月后患者臨床癥狀未得到改善或有惡化傾向為無效。總有效率=(顯效例數+有效例數)÷總例數×100%。(2)心功能變化:分別在治療前與治療后1個月采用Philips Sonos型超聲心動儀測定患者的左室射血分數(LVEF)、左室收縮末期容積(LVESV)、左室舒張末期容積(LVEDV)。(3)實驗室檢查指標:于治療前后分別使用免疫熒光法測定患者N 端前腦鈉肽(NT-ProBNP),使用酶聯免疫吸附試驗測定脂蛋白相關磷脂酶A2(Lp-PLA2)水平,使用放射免疫法測定血管緊張素Ⅱ(AngⅡ),使用電化學發光法測定高敏肌鈣蛋白T(hs-c Tn T)水平。(4)隨訪預后:隨訪并記錄患者半年內出現的再發心力衰竭、心室纖顫、心源性死亡及心動過速等不良事件發生情況。
1.4 統計學方法
2 結果
2.1 臨床療效
觀察組治療總有效率顯著優于對照組,差異有統計學意義(P<0.05)。見表2。
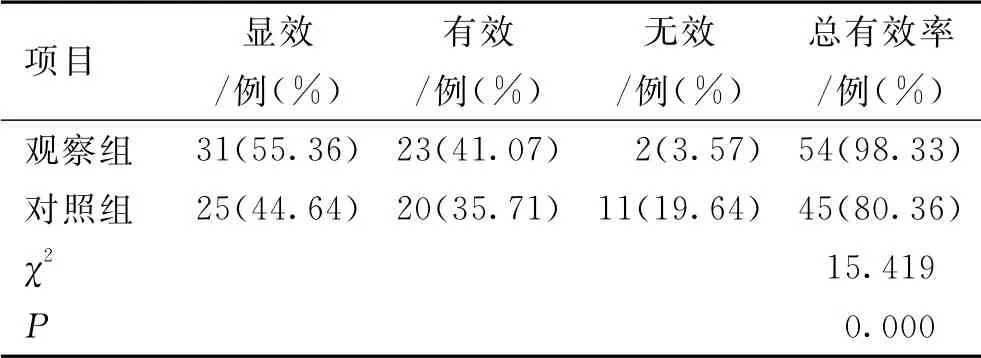
表2 2組患者臨床療效比較(n=56)Tab.2 Comparison of clinical efficacy between the 2 groups of patients(n=56)
2.2 心功能變化
治療前2組患者LVEF、LVESV 和LVEDV 比較差異無統計學意義(P>0.05);治療后2組以上指標均改善,治療后觀察組LVEF 水平高于對照組,LVESV 和LVEDV 水平低于對照組,差異有統計學意義(P<0.05)。見表3。
表3 2組患者治療前后心功能變化比較(±s,n=56)Tab.3 Comparison of changes in cardiac function between the 2 groups of patients before and after treatment(±s,n=56)
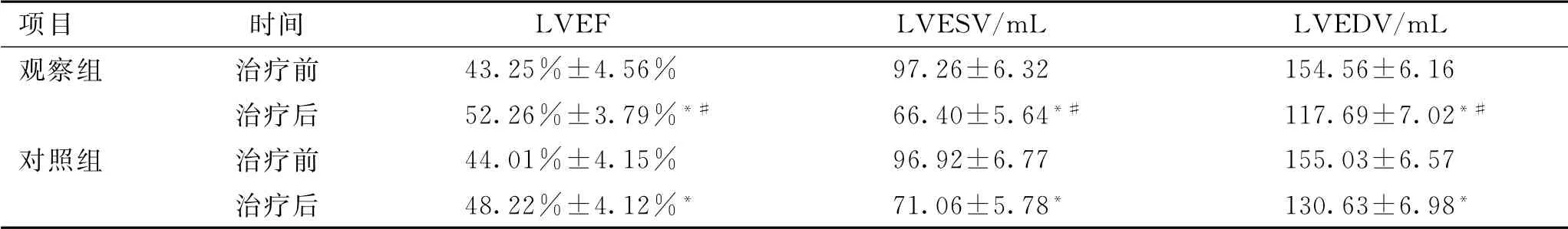
表3 2組患者治療前后心功能變化比較(±s,n=56)Tab.3 Comparison of changes in cardiac function between the 2 groups of patients before and after treatment(±s,n=56)
注:與同組治療前比較,*P <0.05;與對照組比較,#P <0.05。
項目 時間 LVEF LVESV/m L LVEDV/m L觀察組 治療前43.25%±4.56% 97.26±6.32 154.56±6.16治療后 52.26%±3.79%*# 66.40±5.64*# 117.69±7.02*#對照組 治療前 44.01%±4.15% 96.92±6.77 155.03±6.57治療后 48.22%±4.12%* 71.06±5.78* 130.63±6.98*
2.3 NT-ProBNP、hs-c Tn T、Lp-PLA 2 及AngⅡ水平變化
治療前2 組 患 者NT-ProBNP、hs-c Tn T、Lp-PLA2及AngⅡ水平比較差異均無統計學意義(P>0.05);治療后2組以上指標均有所下降,且觀察組各指標下降比對照組更明顯,差異有統計學意義(P<0.05)。見表4。
表4 2組患者治療前后NT-ProBNP、hs-cTnT、Lp-PLA2 及AngⅡ水平變化比較(±s)Tab.4 Comparison of changes in NT-ProBNP,hs-c Tn T,Lp-PLA2 and AngⅡlevels before and after treatment between the 2 groups of patients(±s)

表4 2組患者治療前后NT-ProBNP、hs-cTnT、Lp-PLA2 及AngⅡ水平變化比較(±s)Tab.4 Comparison of changes in NT-ProBNP,hs-c Tn T,Lp-PLA2 and AngⅡlevels before and after treatment between the 2 groups of patients(±s)
注:與同組治療前比較,*P <0.05;與對照組比較,#P <0.05。
項目 例數 時間 NT-ProBNP/(pg·m L-1) hs-c Tn T/(μg·L-1) Lp-PLA2/(μg·m L-1) AngⅡ/(pg·m L-1)觀察組 56 治療前 2 682.12±320.92 15.43±4.20 235.82±12.34 84.92±20.41治療后 752.41±106.32*# 0.79±0.06*# 173.05±9.22*# 36.08±17.32*#對照組 56 治療前 2 691.05±322.67 15.60±4.13 235.12±12.67 85.01±19.89治療后 1 056.08±123.93* 1.83±0.67* 189.47±10.63* 50.33±18.39*
2.4 隨訪半年后不良事件發生情況
觀察組隨訪半年后不良事件發生率顯著低于對照組,差異有統計學意義(P<0.05)。見表5。

表5 2組患者隨訪半年后不良事件發生情況比較(n=56)Tab.5 Comparison of adverse events between the 2 groups of patients after half a year follow-up(n=56)
3 討論
心力衰竭主要誘發因素為AMI,僅次于心律失常,致死率較高,相關調查顯示,心力衰竭在心血管疾病中住院率達到20%以上,致死率高達30%[5]。AMI合并心力衰竭會引起血流動力學、交感神經系統、神經內分泌及心臟結構異常,并伴有惡性循環表現。周娟等[6]研究發現,腎素-血管緊張素-醛固酮系統被激活會促使心臟負荷增加,誘導非梗死區域心肌代償性上升,而醛固酮會加快心肌膠原蛋白合成,造成AMI患者發生心室重構,增加心肌損傷程度,從而導致更易發生心律失常。同時,AMI患者交感神經系統呈興奮狀態,會引起心臟β1腎上腺受體密度下降,導致心肌細胞收縮性減弱,降低心肌功能,進而加重患者心功能不全癥狀[7]。
現階段臨床治療AMI合并心力衰竭多應用藥物治療,尼可地爾具有增加冠狀動脈血流、促心臟負荷下降及心肌能量上升等作用,但經臨床大量實踐發現,單獨應用尼可地爾治療難以達到最佳療效[8-9]。rh BNP屬于治療心力衰竭的新型藥物,作為一種基因重組B 型鈉尿肽,其生物活性、氨基酸排序及空間結構類似于內源性B 型鈉尿肽,可對交感神經系統、腎素-血管緊張素-醛固酮系統的活性發揮拮抗作用,促血管平滑肌細胞松弛,發揮擴血管、促排鈉、減輕心臟負荷等作用[10]。本次研究結果發現,觀察組治療總有效率高于對照組(P<0.05),說明rhBNP 聯合尼可地爾治療可達到理想效果,在最大程度上發揮藥物效果,這與王莉麗等[11]的研究結論相符合。鮮文[12]研究證實,rhBNP 可有效改善患者心功能及血流動力學異常,抑制機體炎癥反應。本研究發現,觀察組治療后LVEF、LVESV 和LVEDV 改善程度均優于對照組,這表明rhBNP 聯合尼可地爾治療能夠擴張冠狀動脈血管,降低肺循環及心臟負荷壓力,促進心肌保護彈性及心臟血流灌注增加,改善心室功能,并發揮預防心室重構發生的作用。
相關研究表明,神經內分泌系統持續被激活會引起hs-c Tn T、Lp-PLA2及AngⅡ異常改變,促使心血管及靶器官出現繼發性損傷,加快心室重構,導致心功能惡化加劇[13]。hs-c Tn T 在心肌損傷時在血液中常表現為高表達,臨床常用于診斷缺血或非缺血性心力衰竭;Lp-PLA2會隨著心功能損傷加重而上升,對預測心力衰竭發病程度具有一定的應用價值;AngⅡ主要因機體炎癥反應而產生高表達現象[14-15]。陳良川等[16]研究證實,AngⅡ水平上升,會引起冠狀動脈功能受阻,促使游離脂肪酸水平上升,加重AMI患者心肌損傷程度。NT-ProBNP 主要由心肌細胞與多肽合成引起心臟超負荷生成,不具備生物活性,會促使心室細胞proBNP基因轉錄與mR-NA 合成,在血液循環時產生NT-ProBNP[17-18]。本次研究中通過rh BNP 聯合尼可地爾治療后觀察組NT-ProBNP、hs-c Tn T、Lp-PLA2和AngⅡ水平均明顯低于對照組(P<0.05),與熊三軍等[19]的研究結論一致,表明rh BNP可快速清除氧自由基,糾正機體低鈉與高鉀血癥表現,抑制心肌細胞膜脂質的過氧化表現,促進心功能得到改善,并恢復機體內分泌系統。同時聯合尼可地爾可促使鈣離子外流,抑制金屬蛋白酶與一氧化氮合成酶,降低交感神經活性,進而達到改善心室重構及心功能的目的[20]。本研究通過隨訪半年心血管不良事件發生情況,觀察組發生率低于對照組(P<0.05),這表明該治療方案具有較高的安全性,rhBNP聯合尼可地爾可有效緩解心室負荷,降低致死風險,繼而最大化改善患者預后。
綜上所述,rhBNP聯合尼可地爾治療AMI合并心力衰竭患者療效確切,值得臨床推廣及應用。

