程序性死亡配體1在肺癌組織中的表達及其與患者病理特征和疾病預后相關性研究
張軍艷,谷 俊
(1.銅川市人民醫院重癥醫學科,陜西 銅川 727099;2.陜西中醫藥大學附屬醫院呼吸科,陜西 咸陽 712021)
肺癌為當今全球范圍內發病率和病死率均位居首位的惡性腫瘤[1],且發病率呈現逐年上升和低齡化的趨勢[2]。目前研究[3-4]普遍認為,包括肺癌在內的惡性腫瘤的發生發展并非一個局部的問題,而是涉及多種細胞因子信號轉導通路失調和分子功能障礙的多因素、多階段的復雜過程。近年來,免疫療法及其相關的免疫逃逸機制已逐步成為抗腫瘤治療的研究熱點[5],程序性死亡配體1(Programmed death ligand-1,PD-L1)為目前臨床常見的免疫檢查點分子,其可通過抑制T淋巴細胞活化、負性調控機體的免疫應答,使腫瘤細胞逃逸機體免疫細胞的監視和殺傷,從而促進腫瘤的發生發展[6]。臨床研究[7-8]發現,PD-L1的表達與肺癌、胃癌、卵巢癌等惡性腫瘤的預后可能存在一定的相關性,但尚未有足夠證據證明其作為預測癌癥患者免疫治療預后的獨立生物學標志物的可靠性。在抗腫瘤治療過程中,腫瘤的病理學特征往往對治療方案的選擇起到重要影響作用。因此,本研究通過收集我院部分肺癌患者的臨床資料和組織標本,通過檢測組織中PD-L1的表達,旨在探究PD-L1的表達與肺癌患者病理學特征及預后的關系。
1 資料與方法
1.1 一般資料 回顧性收集我院病理科于2015年1月至2017年3月期間行手術切除的原發性肺癌組織標本作為研究對象,病例納入標準:①經病理學診斷確診為肺癌;②術前未曾接受放化療或免疫治療;③病理組織無壞死區域。排除標準:①合并其他原發性惡性腫瘤;②臨床資料不完善。共90例標本符合上述標準。另收集同期50例癌旁正常肺組織(距癌組織約2 cm),并經病理學檢查確認無癌細胞浸潤,設為對照組。本研究經我院倫理委員會審查通過。
1.2 檢測方法
1.2.1 主要試劑:免疫染色固定液、免疫組化試劑盒(批號:P0098);兔抗人PD-L1單克隆抗體(批號:ab230369)。
1.2.2 免疫組化法分析PD-L1的表達:將組織樣本置于中性甲醛中脫水固定,石蠟包埋,連續切片3 μm厚,二甲苯脫蠟,分級乙醇水化,修復抗原,以3%過氧化氫溶液滅活內源性過氧化物酶,PBS洗滌,加一抗,4 ℃孵育過夜,加二抗,室溫孵育60 min,DAB顯色5 min,蘇木精復染,讀片,以PBS代替一抗作為空白對照,以上所有操作均嚴格按照試劑盒說明書進行。
1.3 結果判讀 由兩名有經驗的病理醫師采用雙盲法對染色結果進行判讀,在高倍鏡下(400×)隨機選取5個視野,且單個視野內癌細胞數量>200個,PD-L1以腫瘤細胞膜呈棕褐色或棕黃色而細胞核呈紅色顆粒為陽性表達,統計陽性細胞數。以該例樣本5個視野中陽性細胞占比的平均值作為該例的表達率,另以所有病例的表達率的均數作為截斷值,若某例樣本的表達率≥截斷值則定義該例樣本為陽性,反之則為陰性[9]。
1.4 隨 訪 所有患者均采取門診或電話的方式進行為期5年的隨訪,以手術當日未隨訪起始日期,以隨訪結束、復發、轉移或死亡為隨訪終點,失訪或其他原因死亡則視為刪失病例,計算無進展生存期(Progression-free survival,PFS)和總生存期(Overall survival,OS)。

2 結 果
2.1 兩組組織中PD-L1表達情況比較 肺癌組織中PD-L1的陽性表達率顯著高于癌旁正常組織(P<0.05),見表1。

表1 兩組組織中PD-L1表達情況比較[例 (%)]
2.2 PD-L1表達與病理學特征的關系 90例肺癌樣本中共有46例(51.11%)呈現PD-L1陽性表達,PD-L1陽性表達和陰性表達的病例在不同性別、年齡、病理分類、吸煙史和表皮生長因子受體(EGFR)突變上比較無統計學差異(均P>0.05),而在不同TNM分期、分化程度、淋巴結是否轉移上比較有統計學差異(均P<0.05),見表2。
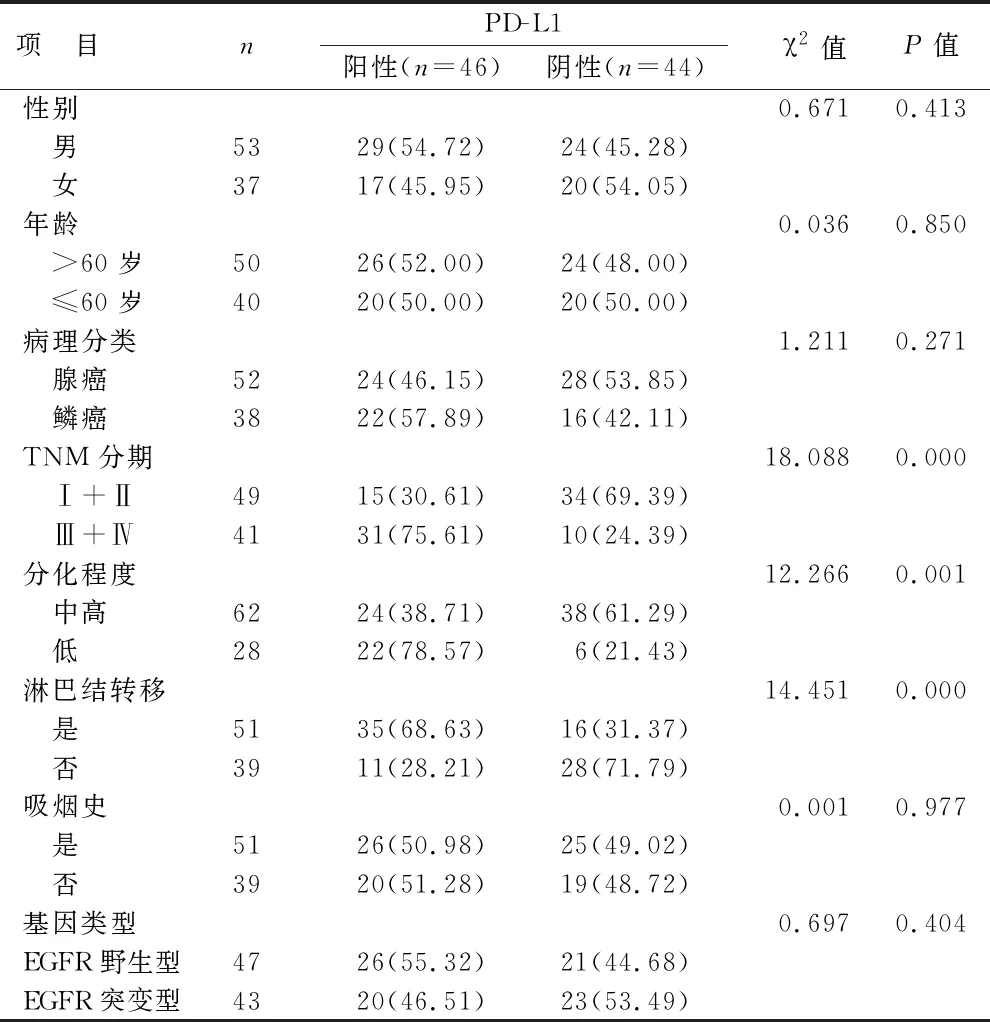
表2 PD-L1表達與病理學特征的關系[例(%)]
2.3 PD-L1表達與患者預后的關系 在5年隨訪期中,90例病例中共失訪14例,死亡29例,存活47例。生存分析結果顯示,PD-L1陽性表達患者的PFS和OS顯著短于陰性表達者(P=0.0008,P=0.006),見圖1。
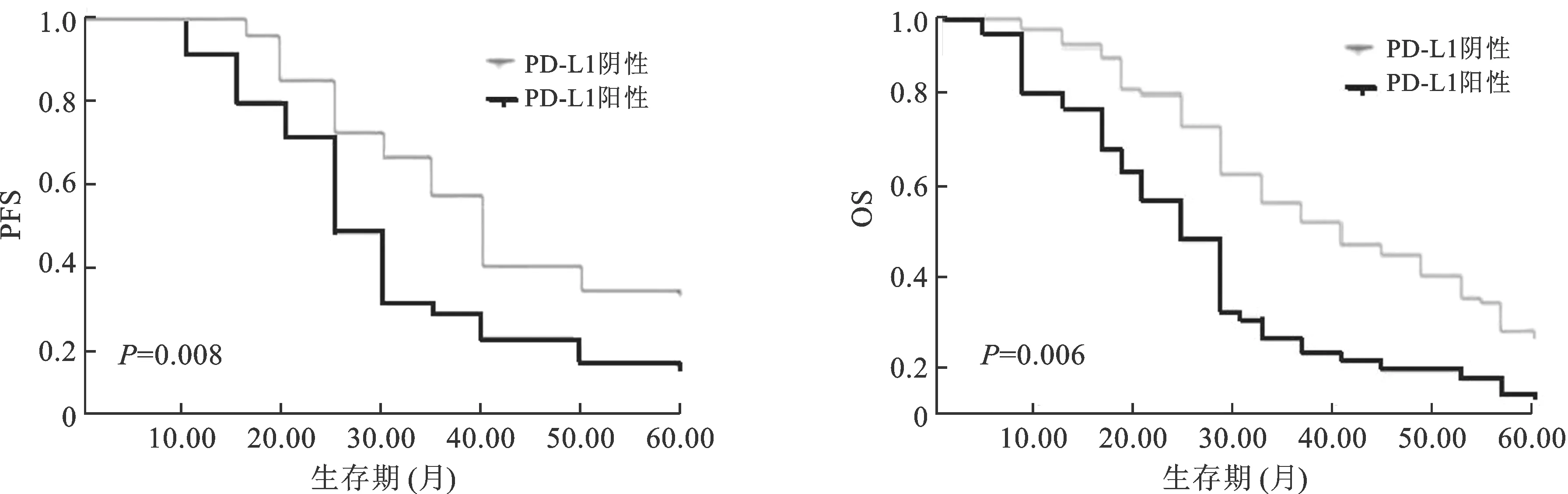
圖1 PD-L1表達與生存曲線
2.4 肺癌患者預后影響因素分析 以患者在隨訪結束時是否轉移、復發或死亡作為因變量,將TNM分期、分化程度、淋巴結是否轉移、PD-L1的表達作為自變量納入Logistic回歸分析,結果顯示,TNM分期(β=0.558,P=0.009)、分化程度(β=1.423,P=0.019)、淋巴結轉移(β=0.269,P<0.001)和PD-L1(β=1.699,P<0.001)均為影響肺癌患者預后的獨立危險因素,見表3。
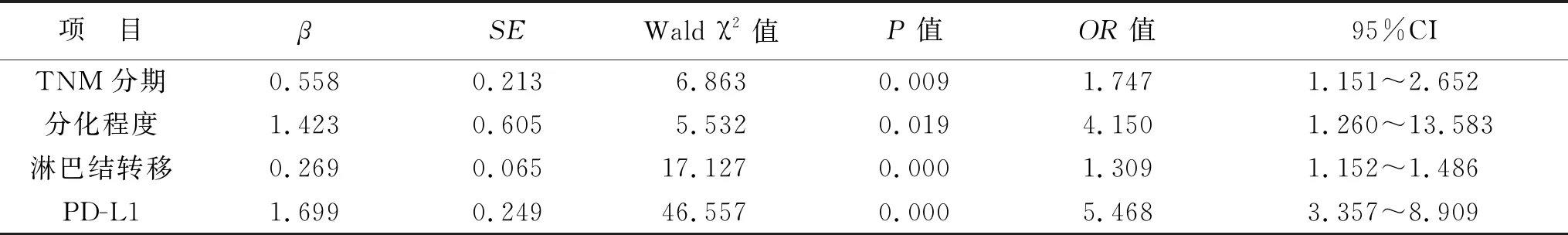
表3 肺癌患者預后多因素Logistic回歸分析
3 討 論
肺癌為目前臨床最常見的惡性腫瘤,且近年來發病率及病死率增長迅速,嚴重威脅人類的生命健康[10]。目前,肺癌的治療方案以外科手術切除、放化療以及免疫治療等為主[11],盡管外科手術方式、放療技術均不斷進步,靶向治療藥物亦推陳出新,然而多數患者發現病變時往往已達中晚期,喪失了手術機會,因此治療后生存率仍較低,且仍有大量患者在根治術后5年內復發或轉移[12],收效甚微。因此,對信號轉導通路、免疫調控的研究已成為治療包括肺癌在內的多種惡性腫瘤的至關重要的環節。
近年來,隨著對腫瘤免疫療法及其相關的免疫逃逸機制的深入研究,抗腫瘤治療已由分子靶向治療階段進入免疫治療的新階段,已有部分免疫治療藥物在臨床試驗中展示出了較好的療效,為眾多中晚期惡性腫瘤患者帶來了新希望[13-14]。最新研究[15]發現,腫瘤細胞可異常調節共刺激分子和表面抗原封閉。機體在正常狀態下,共刺激分子與負性共刺激分子處于動態平衡之中,從而保持淋巴細胞的免疫效應,在保證正常的免疫監視和殺傷功能的同時又可避免自身免疫損傷,而腫瘤細胞被證實可刺激負性共刺激分子及其相關配體的表達,破壞正負信號平衡,破壞機體正常的免疫活性。既往研究發現,PD-L1作為負性共刺激分子免疫球蛋白超家族中的重要一員,廣泛表達于抗原提呈細胞(Antigen-presenting cells,APCs)、單核細胞、巨噬細胞、內皮細胞、活化的T細胞和B細胞等中,可通過抑制效應T細胞的活性,負性調節機體的免疫應答,參與包括細菌感染、病毒感染、腫瘤免疫逃逸、腫瘤細胞增殖及血管新生等在內的多種生物學過程。PD-L1在肺癌、卵巢癌、胃癌等多種惡性腫瘤細胞中呈現高表達研究[16-17]證實,在腫瘤微環境中,腫瘤細胞通過上調PD-1的表達,大大增加其與腫瘤浸潤淋巴細胞表面PD-L1結合概率,從而進一步激活PD-1/PD-L1信號轉導通路,通過高表達PD-1/PD-L1而募集細胞因子以及免疫抑制細胞,達到降低腫瘤細胞的抗原性作用,使免疫微環境由穩態轉變為免疫抑制狀態,而抑制腫瘤浸潤淋巴細胞對腫瘤細胞的監視和殺傷,腫瘤細胞通過上述“免疫編輯”過程,清除、均衡、逃逸,最終實現逃避機體免疫系統的抗腫瘤作用。
王平等[18]研究報道,彌漫性大B細胞淋巴瘤(Diffuse large B-cell lymphoma,DLBCL)患者體內PD-L1呈現高表達,且與患者的臨床病理學特征及不良預后顯著相關,具有潛在的評估患者生存預后的價值。Petrova等[19]利用帕博利珠單抗治療非小細胞肺癌(Non-small cell lung cancer,NSCLC),發現阻斷了患者體內的PD-1/PD-L1信號轉導通路,同時機體T淋巴細胞的抗腫瘤免疫應答反應明顯恢復,腫瘤生長顯著抑制,患者生存期得以顯著延長。本研究中,肺癌組織中PD-L1的陽性表達率顯著高于癌旁正常組織,提示PD-L1可能參與了肺癌的發生發展。然而,PD-L1的表達與肺癌病理學特征及患者預后是否存在關聯,目前鮮有報道。因此,本研究進一步分析肺癌患者的臨床病理學資料,發現PD-L1的表達在不同TNM分期、分化程度、淋巴結是否轉移上有顯著差異;生存曲線分析結果顯示,PD-L1陽性表達患者的PFS和OS顯著短于陰性表達者,提示PD-L1的表達與肺癌患者的病理學特征及預后密切相關。此外,本研究還分析了影響肺癌患者預后的因素,Logistic回歸分析結果表明,TNM分期、分化程度、淋巴結轉移和PD-L1的表達均為影響肺癌患者預后的獨立危險因素。鄭文[20]報道稱,非小細胞肺癌患者在接受125I粒子治療后PD-1和PD-L1 mRNA的表達水平顯著下降,預后顯著改善,其機制可能與抑制PD-1/PD-L1通路而抑制腫瘤細胞的免疫逃逸有關。
綜上所述,本研究表明PD-L1的表達與肺癌患者病理學特征及預后密切相關,具有一定的臨床預測價值,同時有望成為臨床治療肺癌的新靶標。

