微小RNA-145表達對胃癌不同分子分型患者的新輔助化療效果評價及臨床意義
趙雪峰 譚明 趙一杰 檀碧波
胃癌早期無癥狀或僅有輕微非特異性癥狀,因而很難早期發現,臨床大多數胃癌患者與就診時已處于進展期[1,2]。對進展期胃癌的治療措施是以手術為主的綜合治療,但相當一部分患者由于腫瘤分期較晚,直接手術難以切除腫瘤或不能達到根治水平。為提高這些患者的腫瘤手術切除率并改善預后,近年來新輔助化療在進展期胃癌治療中已得到較為廣泛的應用。通過新輔助化療,患者腫瘤切除率明顯升高,近期預后也有所改善[3,4]。通過標志物檢測能對新輔助化療的效果及不良反應進行預測則可能改善進展期胃癌的綜合治療效果,具有重要的臨床應用價值。傳統的胃癌病理分型在預測治療效果、評價病情及預后方面存在明顯不足,因此,近年來出現了多種新的分子分型,其中ACRG分子分型在預測藥物治療效果方面有較好的價值[5]。ACRG分子分型中微衛星穩定性(MSS)/上皮間質轉化(EMT)亞型患者具有發病年齡較早、分化程度較差、放化療效果不佳的特點[6]。MSS/EMT亞型檢測在臨床工作中可以通過檢測CDH1基因編碼的蛋白質E-鈣粘蛋白(E-cadherin)代表[6]。微小RNA(microRNA)是一類長度為20 nt的非編碼單鏈RNA,對靶基因有轉錄后調控功能[7-9]。研究顯示,microRNA在多種惡性腫瘤中存在過表達或者表達降低的現象,其主要通過調控靶基因的mRNA表達而參與腫瘤的發生、進展及轉移[10,11]。miR-145作為一種具有抑癌基因功能的microRNA,在胃癌患者的組織中存在表達降低的現象,能夠參與胃癌細胞的增殖、凋亡、遷移等過程[10,11]。但檢測miR-145表達能否預測胃癌新輔助化療的效果目前還沒有定論。還有研究發現miR-145 對E-cadherin有調節作用[12]。本研究以接受新輔助化療(SOX方案)的胃癌患者為研究對象,于新輔助化療前檢測胃癌及癌旁組織中miR-145及E-cadherin的表達水平,分析其與胃癌新輔助化療效果的關系,對其檢測價值進行探討。
1 資料與方法
1.1 一般資料 以2019年1月至2020年10月于我院住院治療并接受新輔助化療的進展期胃癌患者80例為研究組,其中男65例,女15例;年齡32~63歲,平均年齡(57.92±7.11)歲。所有入組者由患者本人簽署知情同意文件,研究方案經醫院醫學倫理委員會審核并批準。
1.2 納入與排除標準
1.2.1 納入標準:①患者均有胃鏡活檢病理證實為胃腺癌,按第8版 AJCC/UICC胃癌分期系統進行影像學分期,患者臨床分期為ⅡB~Ⅲ期;②患者于就診前未接受過其他針對胃癌的治療,腫瘤均有潛在切除可能;③患者及家屬同意接受新輔助化療。
1.2.2 排除標準:①診斷為復發或存在遠處轉移的胃癌患者;②既往患有其他惡性腫瘤或現合并其他惡性腫瘤者;③患者有嚴重的感染性疾病、免疫系統疾病或肝腎疾病者;④無法配合或不同意新輔助化療的患者。
1.3 新輔助化療方案及效果評價 患者均接受SOX方案進行新輔助化療,化療藥物為奧沙利鉑及替吉奧(25 mg/粒,江蘇恒瑞醫藥股份有限公司)。新輔助化療為3周方案:每周期第1天給予奧沙利鉑(Oxaliplatin)靜脈給藥,劑量為130 mg/m2;第2天起口服替吉奧2周,劑量為40~60 mg/m2;口服替吉奧結束后停藥1周后進行下一周期化療。
1.4 標本采集 腫瘤及癌旁胃黏膜組織均來自胃鏡活檢標本,標本均一式兩份,一份用于熒光定量PCR(qRT-PCR)檢測,另一份用于蛋白印跡(Western blot)檢測。標本離體后盡快(30 min內)置于凍存管并存儲于液氮中,然后轉存到-80℃超低溫冰箱。
1.5 qRT-PCR檢測miR-145的表達 用TRIzol從胃癌及癌旁組織中提取總RNA,按照美國GeneCopia公司試劑盒的說明書進行逆轉錄及PCR反應,以U6 snRNA為內參。PCR反應的循環參數:95℃預變性5 min;然后95℃ 變性30 sec,60℃退火20 s,72℃延伸20 s,共進行45個循環,檢測miR-145的熒光信號,2ΔΔCt方法計算miR-145的相對表達強度。
1.6 Western blot檢測組織中E-cadherin蛋白的表達 提取胃癌及癌旁組織的總蛋白,BCA法進行蛋白定量,取樣品40 μg上樣,按操作說明次序加入一抗和二抗,以β-actin為內參,E-cadherin蛋白條帶曝光顯影后掃描,分別記錄E-cadherin及β-actin蛋白條帶的積分光密度值(integrated optical density value,IOD),以二者的比值代表相對表達強度。
1.7 觀察指標 (1)患者接受1~4個周期化療,結束后1周行胸腹部增強CT,化療效果分為完全緩解(CR,目標病灶完全消失)、部分緩解(PR,目標病灶縮小>25%)、穩定(SD,目標病灶變化≤25%)、治療后進展(PD,目標病灶增大>25%)。(2)除PD患者外,其他患者均于新輔助化療停止后3~6周內接受手術,記錄手術效果。(3)化療過程中加強隨訪,內容為骨髓抑制、嚴重胃腸道反應、末梢神經損害等。判斷標準:骨髓抑制是指白細胞減少(<4×109/L)、或中性粒細胞減少(<2×109/L)、或血小板減少(<80×109/L)、或貧血(男性HGB<80 g/L,女性HGB<90 g/L);嚴重胃腸道反應指患者出現嚴重的惡心、嘔吐癥狀,需要靜脈補液者;末梢神經損害指肢體末端出現明顯感覺障礙和(或)感覺異常。
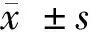
2 結果
2.1 新輔助化療的療效 80例進展期胃癌患者共完成237個周期新輔助化療(均為SOX方案),平均(2.96±1.08)周期/人。每個化療周期結束后1周進行評價,最多進行4個周期化療。緩解(CR、PR)及穩定(SD)患者化療結束后3~6周行手術治療,進展(PD)患者則更換化療方案,繼續化療。80例患者中CR患者4例(5.00%),PR患者34例(42.50%),SD患者31例(38.75%),PD患者11例(13.75%)。CR+PR+SD為化療有效,有效率為86.25%(69/80)。
2.2 新輔助化療的不良反應 患者發生骨髓抑制者31例(38.75%),嚴重胃腸道反應者17例(21.25%),末梢神經損害者36例(45.00%)。
2.3 治療前胃癌組織與癌旁組織miR-145、E-cadherin的表達水平 胃癌組織中miR-145、E-cadherin表達水平低于癌旁組織(P<0.001)。見表1。

表1 胃癌組織與癌旁組織miR-145、E-cadherin表達水平比較
2.4 化療前胃癌患者組織中miR-145、E-cadherin表達水平與化療效果的關系 研究組患者按化療效果分為CR、PR、SD、PD組,治療前miR-145、E-cadherin表達強度在CR、PR、SD、PD患者組織中表達依次降低(P<0.05)。見表2。
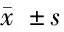
表2 不同化療效果的胃癌患者腫瘤組織miR-145、E-cadherin表達
2.5 化療前胃癌患者組織中miR-145、E-cadherin表達水平與化療不良反應的關系 發生骨髓抑制的患者miR-145、E-cadherin表達比無骨髓抑制者更低(P<0.05),miR-145、E-cadherin表達與骨髓抑制、嚴重胃腸道反應無關(P>0.05)。未發現miR-145、E-cadherin表達與末梢神經損害有關(P>0.05)。見表3。
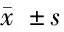
表3 化療不良反應與胃癌患者新輔助化療前組織中miR-145、E-cadherin表達的關系
2.6 腫瘤組織miR-145、E-cadherin關系 Spearman相關分析顯示,腫瘤組織miR-145、E-cadherin呈正相關(r=0.8264,P<0.001)。見圖1。

圖1 胃癌腫瘤組織miR-145、E-cadherin表達的關系
3 討論
中國胃癌的發病率、病死率在消化道惡性腫瘤中居高不下,嚴重危害人民的健康[13]。目前胃癌的治療是以手術、化療、放療、靶向治療及生物免疫治療的綜合治療,其中根治性手術占位主要地位。由于胃癌早期癥狀無明顯特異性,導致多數患者就診時已處于進展期,往往失去了根治性手術的機會。為提高這些患者的手術R0切除率,新輔助化療的在進展期胃癌的治療中得到了廣泛應用,患者術前接受新輔助化療,爭取實現R0切除,術后繼續給與輔助化療,取得了較好的臨床效果[14,15]。胃癌患者新輔助化療的主要藥物以鉑類及氟尿嘧啶類藥物為基礎,SOX方案是胃癌一線化療方案之一,奧沙利鉑與替吉奧是方案中的化療藥物,除此之外還配合使用止吐、升白等減輕化療不良反應的藥物,化療周期為3周[16]。本研究中,80例新輔助化療的胃癌患者接受了1~4個療程的化療,未發生嚴重的致命性不良反應;按化療效果評價,治療有效的患者達到86.25%,這一結果說明應用SOX方案進行新輔助化療有良好的治療效果,且具有較好的耐受性。該結果表明SOX方案可以有效抑制腫瘤的進展,在胃癌的新輔助化療中值得推廣應用,與其他報道結果[17]相符。在80例患者中,仍有11例患者在新輔助化療后出現腫瘤進展,患者未能獲得接受手術的機會。選擇新的標志物提前對新輔助化療的效果進行預測有重要的臨床價值。由于miR-145及分子分型在近年來研究中發現與胃癌關系密切,故本研究進行了相關檢測。
由于傳統的胃癌病理分型不能準確反映治療效果及預后,故近年來出現了TCGA、ACRG等多種新的分子分型[18],對胃癌治療效果及預后進行預測。ACRG分型主要基于亞洲人群,標本數據主要來自日本和韓國。ACRG分型將胃癌分為4種分子亞型:(1)微衛星不穩定性(microsatellite instability,MSI)型,(2)MSS/EMT型,(3)MSS/TP53+型,(4)MSS/TP53-型[18]。MSS/EMT型患者一般發病年齡較輕,治療效果較差[6]。為方便檢測,ACRG建議使用免疫組織化學(IHC)進行腫瘤分類,MSS/EMT型可以被E-cadherin識別。故本研究探討了E-cadherin在判斷胃癌新輔助化療效果中的作用。本研究結果發現,E-cadherin在胃癌組織中表達低于癌旁組織,提示E-cadherin表達缺失可能是參與胃癌進展及遷移的重要蛋白質。
非編碼RNA是近年來受到關注的一大類分子,由于不具有翻譯蛋白質功能,原來一直未受到關注。但近年來發現這些非編碼RNA可以在轉錄水平調控編碼基因的mRNA表達,從而發揮其調控功能。微小RNA(microRNA)是一類長度為20 nt的非編碼單鏈RNA。microRNA主要發揮的是基因抑制作用,可以通過抑制其靶基因的表達而參與細胞生物學調控[19,20]。研究發現miR-145與胃癌有關,在胃癌中表達減弱[10,11],但miR-145表達情況與胃癌新輔助化療效果的關系研究還沒有定論。本研究發現,miR-145在胃癌組織中表達低于癌旁組織,提示miR-145具有抑癌基因功能,可能成為胃癌新輔助化療效果預測的新標志物。但其具體作用機制還需要深入研究。
為了解miR-145、E-cadherin作為胃癌新輔助化療效果評價指標的可行性,本研究比較分析了新輔助化療效果與miR-145、E-cadherin表達水平的關系。結果發現miR-145、E-cadherin的表達具有明顯的一致性,在CR、PR、SD、PD患者組織中表達依次降低,差異均有統計學意義(P<0.05)。我們據此結果進行推測,化療前患者腫瘤組織miR-145、E-cadherin明顯降低,提示SOX新輔助化療可能效果不太理想,應選擇其他治療方案。
為深入分析miR-145、E-cadherin預測胃癌新輔助化療效果的綜合價值,本研究還分析了miR-145、E-cadherin表達水平與化療不良反應的關系。結果顯示,發生骨髓抑制的患者miR-145、E-cadherin表達比無骨髓抑制者明顯降低,提示SOX新輔助化療前檢測miR-145、E-cadherin表達可能對預測骨髓抑制的發生有一定幫助。但研究結果未發現miR-145、E-cadherin與消化道不良反應及末梢神經損害有關,因此我們考慮miR-145、E-cadherin在預測新輔助化療不良反應方面仍有明顯的局限性。
綜上所述,接受新輔助化療的進展期胃癌患者的組織中miR-145、E-cadherin存在表達明顯降低的現象,檢測miR-145、E-cadherin表達對預測胃癌新輔助化療效果和不良反應有重要意義。

