裸果木再生體系建立與不定芽發生研究
楊海峰,王佳琪,甘曉雪,王樹森,韋東山,于鳳強
(1 內蒙古農業大學 林學院,呼和浩特 010010;2 內蒙古農業大學 沙漠治理學院,呼和浩特 010010;3 鄂爾多斯林業和草原事業發展中心,內蒙古 鄂爾多斯 017000)
裸果木(Gymnocarposprzewalskii)為多年生半灌木,具有多分枝、葉線型、花兩性、花粉小等特征,是古地中海旱生植物區系的孑遺植物[1-3],主要分布在中國的甘肅、青海、內蒙古、新疆等地[4-5]。裸果木起源第三紀,經歷冰期,積累了豐富的遺傳變異,有較高的遺傳多樣性,適應環境能力強[6-7]。但隨著氣候變化,裸果木自然分布有向水源充足地區移動的趨勢,適生區逐步縮小[8-9]。加之裸果木是荒漠地區動物的食物來源之一,其數量日益減少,于1997年被認定為國家一級保護植物[10-11]。裸果木數量減少的另一個原因是其繁殖具有一定的困難和局限性。在寧夏中衛觀察發現,裸果木花期為降雨量集中月份,結實率不到1%[10];在新疆阿合奇縣裸果木有性繁殖的結實率僅為6.37%,其有性繁殖困難[12]。有報道認為在其無性繁殖中采用生根粉可促進裸果木硬枝生根,在沙土中成活率達80%[13],但傳統無性繁殖需要大量繁殖體,不利于野生資源的保護,且效率不高。
植物組織培養技術是解決珍稀林木種質資源保護及可持續利用問題的有效途徑之一,其具有外植體豐富、生長迅速、繁殖系數大及占地面積小等特點[14],可有效保存珍稀瀕危的林木種質資源的多樣性,對于裸果木的種質資源保護及可持續利用具有重要的應用價值。有關裸果木的組織培養研究較少,僅見汪之波等[15]利用裸果木下胚軸為外植體,采用6-BA和NAA組合,成功獲得再生植株,但該途徑存在芽分化效率較低,愈傷較多,再生植株生根不理想等問題,需要進一步優化該組培體系,但未見后續報道。因此,需要深入開展裸果木的植物組織培養研究工作,為裸果木的種質資源保護及可持續利用提供一條有效途徑。
本研究利用裸果木健壯植株的莖段為外植體,進行6-BA與IBA不同濃度組合的組織培養,篩選最佳愈傷增殖及不定芽分化配方,確定影響不定芽生根的關鍵因素,實現離體再生,同時對裸果木不定芽分化過程進行解剖結構分析,確定其起源。本研究對裸果木的快速繁殖,規模化應用提供了相關研究基礎,同時為保護和繁衍這一珍稀植物種質資源提供了一條新途徑。
1 材料和方法
1.1 實驗材料
本實驗材料采自內蒙古自治區烏拉特后旗呼和溫都爾鎮的郊區林場(E106.83,N40.95),為自然生長的裸果木健壯植株。
1.2 實驗方法
1.2.1 外植體消毒將裸果木枝條截成長2~3 cm帶葉片的莖段,流水沖洗4 h。之后,在超凈工作臺內用75%酒精清洗2次,每次30 s,無菌水清洗2次,3%次氯酸鈉消毒2次,每次10 min。最后,無菌水清洗6~8次,無菌濾紙吸干,作為外植體備用。
1.2.2 初代愈傷誘導外植體接種到愈傷誘導培養基(1/2 MS+0.1 mg·L-1IBA+0.05 mg·L-1NAA+30 g·L-1糖+7 g·L-1瓊脂,pH 5.8),光照培養16 h,黑暗8 h,培養溫度(25 ± 2) ℃。接種50瓶,每瓶2個莖段,4周后統計愈傷誘導情況。
1.2.3 愈傷組織增殖及不定芽分化將誘導的愈傷組織接種到MS培養基內,添加不同濃度水平6-BA(0、0.2、0.5、0.7、1.0、1.2、1.5、1.7、2.0 mg·L-1)和IBA(0、0.2、0.5、0.7、1.0、1.2、1.5、1.7、2.0 mg·L-1)的組合配比試驗。每個激素組合接種25塊愈傷,重復3次。接種后,每周統計愈傷組織直徑、不定芽分化數量。
1.2.4 不定芽生根培養(1)確定適合不定芽生根的基本培養基。選擇生長至約2 cm的裸果木不定芽,分別接種到蔗糖濃度30 g·L-1的MS、1/2 MS、WPM、DCR和SH的基本培養基內(不含激素),每個組合接種30個不定芽,重復3次。接種后,每周觀察不定芽生根狀況,第4周拍照并統計生根情況。
(2)確定適合不定芽生根的蔗糖濃度。選擇生長至約2 cm的裸果木不定芽,接種到不含激素的SH培養基內,設置蔗糖濃度梯度為0、10、20、30 g·L-1進行培養。每個組合接種30個不定芽,重復3次。接種后,每周觀察不定芽生根狀況,第4周拍照并統計生根情況。
1.2.5 愈傷組織分化不定芽過程的解剖學觀察將裸果木由愈傷分化形成不定芽的過程,每隔3 d取樣,FAA固定,進行石蠟切片[16],切片厚度5 μm。芽點出現后的材料每隔3~6 d取樣,瓊脂糖固定,進行振動切片,厚度為30 μm。均采用蘇木精-伊紅染色(HE染色)。
1.2.6 統計指標初代愈傷誘導率=(產生愈傷的莖段數/接種莖段數) × 100%
生芽率= (產生不定芽的愈傷塊數/接種愈傷塊數) × 100%
平均不定芽數量=不定芽總數量/接種愈傷塊數
生根率= (產生不定根的不定芽總數/接種不定芽總數) × 100%
平均不定根數量=不定根總數/接種不定芽總數
1.2.7 數據處理、圖像分析方法本研究利用Excel 2010進行數據處理,SPSS 22.0顯著性分析,對石蠟、振動切片采用尼康全自動顯微鏡Ni-E拍照,imageJ、Photoshop(CC 2018)完成圖片拼合,Origin 2018繪圖。
2 結果與分析
2.1 初代愈傷組織的誘導 裸果木莖段接種到愈傷誘導培養基內,培養至7 d,裸果木莖段基部開始膨脹,表面出現一層淡黃色愈傷(圖1,A);培養至21 d,愈傷組織繼續增大,直徑約1 cm,為淡黃色、緊致、塊狀愈傷組織(圖1,B);繼代28 d后,愈傷呈半透明淡黃色、質地柔軟、長勢良好(圖1,C),愈傷組織誘導率達90%。
2.2 6-BA和IBA對裸果木愈傷增殖的影響
2.2.1 愈傷增殖過程初代愈傷接種到6-BA與IBA不同濃度組合的愈傷增殖培養基(圖2,A)。增殖第10天,愈傷直徑增加約2 mm,顏色變為黃綠色(圖2,B)。第20天,愈傷呈現3種分化方向,第1種愈傷體積明顯增大,直徑達2.5 cm,顏色變為深黃綠色(圖2,C);第2種愈傷繼續增殖,直徑達1.5 cm,為半透明黃白色,分化出不定根(圖2,D);第3種愈傷為黃綠色,增殖較慢,表面有少量不定芽分化形成(圖2,E)。培養至30 d,愈傷增長較快,呈顆粒狀、翠綠色,繼續膨大,可占據培養基全部表面,內部中空。
2.2.2 6-BA和IBA對愈傷增殖的影響根據裸果木愈傷直徑的相關數據,分析IBA、6-BA對裸果木愈傷增殖效果的影響(表1)。當6-BA濃度保持固定,隨IBA濃度增加,愈傷直徑呈先增大后減小的顯著變化趨勢;當IBA濃度保持固定,隨6-BA濃度增加,愈傷直徑未出現顯著性差異變化。同時對主體間效果檢定(表2),IBA的F值大于6-BA,達18.259,且IBA對愈傷增殖的影響達到極顯著水平,因此,本研究認為IBA對裸果木愈傷增殖的影響高于6-BA,IBA為關鍵影響因子。在6-BA與IBA不同濃度組合中,1 mg·L-16-BA+1 mg·L-1IBA(圖2,G)、1 mg·L-16-BA+1.2 mg·L-1IBA(圖2,F)、1.5 mg·L-16-BA+0.2 mg·L-1IBA(圖2,H)愈傷組織直徑均值超過2.7 cm(圖3)。但組合1 mg·L-16-BA+1 mg·L-1IBA形狀更加規則、聚攏、褐化樣本少,繼代時,內部中空現象少,故較好的愈傷增殖組合為1 mg·L-16-BA+1 mg·L-1IBA。
2.3 6-BA和IBA對裸果木不定芽分化的影響
2.3.1 不定芽的分化過程初代愈傷接種到6-BA與IBA不同濃度組合的不定芽分化培養基內(圖2,A)。培養至第10天,愈傷組織直徑增加約2 mm,顏色由淡黃色向黃綠色轉變(圖2,B);培養至12 d,黃綠色愈傷表面有綠色芽點凸起(圖4,A);培養至21 d,芽點分化為不定芽,高約0.5 cm(圖4,B);培養至28 d,部分不定芽繼續高生長,形成節間(圖4,C),上述愈傷組織繼代,愈傷表面不斷分化不定芽,可形成叢生芽(圖4,D)。
2.3.2 6-BA和IBA對不定芽分化的影響對第3周裸果木愈傷分化不定芽結果進行統計分析(表3),結果表明,不同濃度的6-BA與0或0.2 mg·L-1IBA組合,均可誘導愈傷分化不定芽。當IBA為0或0.2 mg·L-1時,隨6-BA濃度增加,不定芽分化率呈先上升后下降趨勢,其中IBA為0 mg·L-1、6-BA為0.5 mg·L-1時,愈傷生成量少,不定芽分化率最高,達92.3%(圖5),且平均分化不定芽數量4.9個/塊。而主體間效果檢定發現(表4),IBA的顯著性達0.049,小于0.05,對不定芽誘導存在顯著影響,但0 mg·L-1IBA的生芽率明顯高于0.2 mg·L-1,說明IBA抑制不定芽誘導,降低生芽率。結合上述內容分析,低濃度6-BA可快速誘導裸果木愈傷分化不定芽,而高濃度6-BA不利于不定芽分化,IBA為不定芽誘導的關鍵因素,起負調控作用。因此,基于前期裸果木愈傷誘導基礎,裸果木愈傷分化不定芽的最佳培養基為MS+0.5 mg·L-16-BA+30 g·L-1蔗糖+7 g·L-1瓊脂。
2.4 裸果木不定芽生根的關鍵因素影響
2.4.1 基本培養基對生根的影響為分析基本培養基對裸果木生根的影響,本研究選擇MS、1/2 MS、WPM、DCR、SH為生根的基本培養基進行篩選。
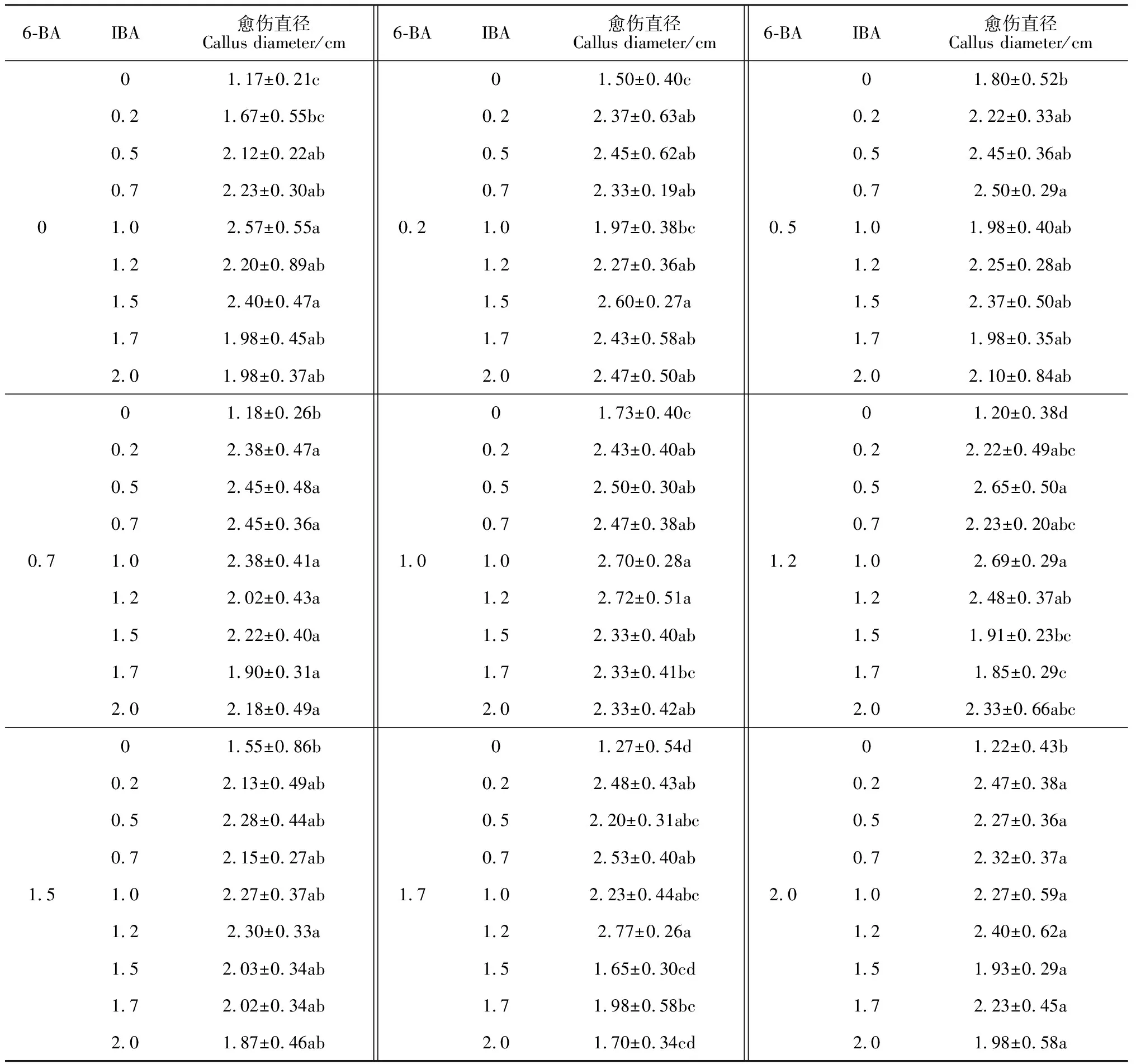
表1 IBA和 6-BA組合對愈傷增殖的影響
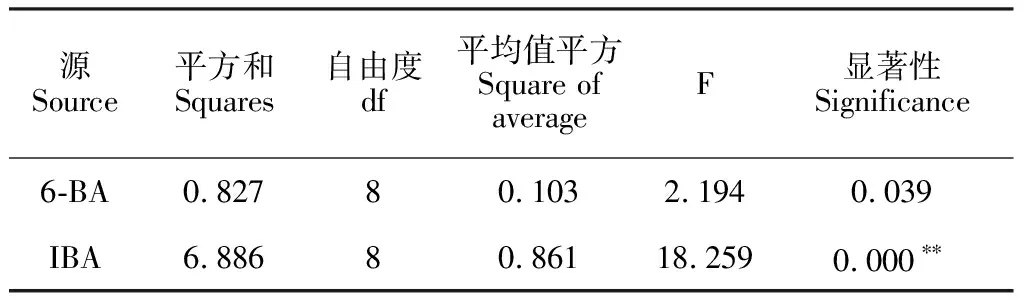
表2 主體間效應的檢驗
結果表明,培養至30 d,MS(圖6,A)、1/2 MS(圖6,B)、WPM(圖6,C)基本培養基上,不定芽莖生長緩慢,基部愈傷較多,多數根沿培養基表面生長,呈褐色,長勢弱;DCR(圖6,D)、SH(圖6,H)基本培養基上,不定芽莖生長較快,苗高達2.5 cm,生根率達82%以上(表5),但DCR基本培養基中,不定芽基部愈傷多于SH基本培養基。在SH基本培養基中,基部僅有少量愈傷,不定根呈乳白色,在培養基中生長狀態良好,長度可達3 cm, SH為適合裸果木生根的基本培養基。
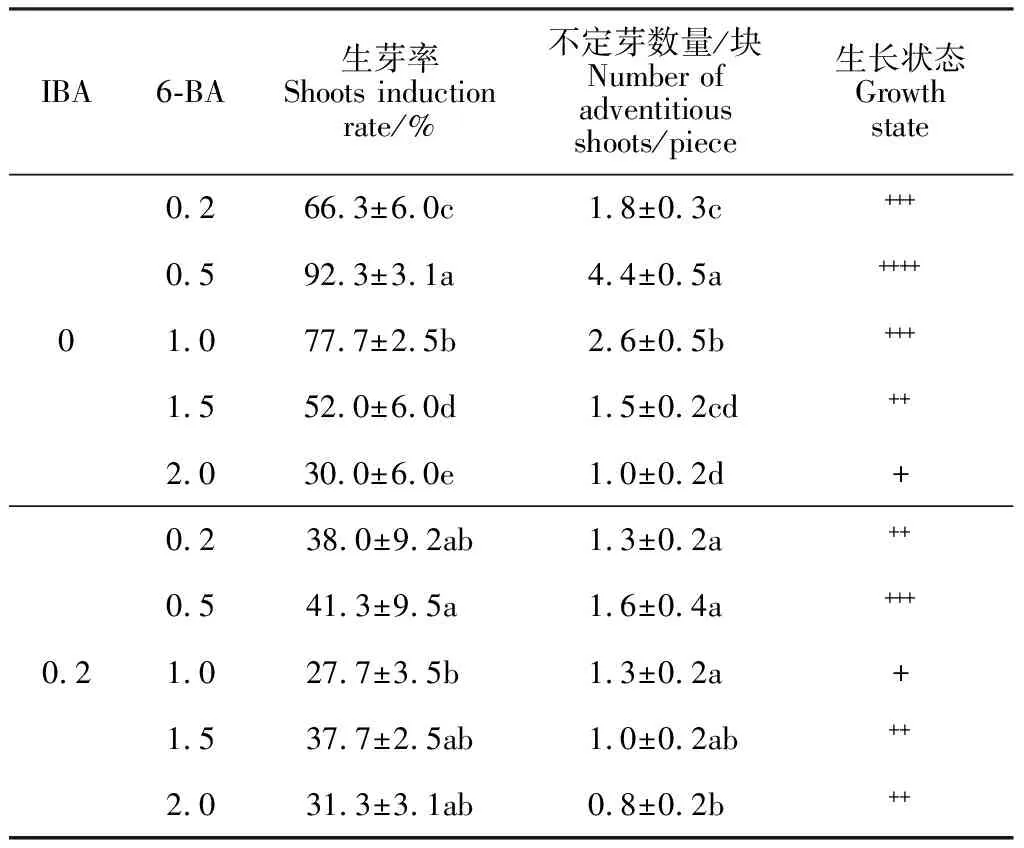
表3 裸果木愈傷分化不定芽數量統計表
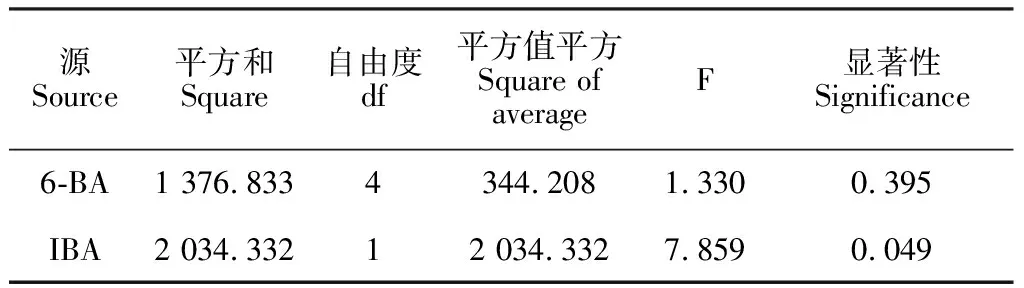
表4 主體間效果檢定
2.4.2 蔗糖濃度對生根的影響為分析蔗糖對裸果木生根的影響,本研究選擇添加不同蔗糖濃度的SH培養基為生根培養基進行蔗糖濃度篩選。研究發現,培養至40 d,蔗糖濃度為0 g·L-1的培養基上,不定芽生長較快(圖7,A),不定芽基部無愈傷生成,平均不定根數量達3.1個(圖7,E);蔗糖濃度為10 g·L-1時,不定芽生長快(圖7,B),基部愈傷極少,平均不定根數量達5.7個(圖7,F);蔗糖濃度為20 g·L-1時,不定芽生長較快(圖7,C),基部愈傷較少、平均不定根數量達5.3個(圖7,G;表6);蔗糖濃度為30 g·L-1時,不定芽莖生長緩慢(圖7,D),基部愈傷較多、不定根少(圖7,H)。據此分析,蔗糖濃度為10 g·L-1時,其生根率、不定根數量、生長高度均為最佳,但其愈傷形成與0 g·L-1蔗糖的培養基相比,仍有少量愈傷形成,但該愈傷不影響植株生長與移栽。因此,裸果木不定芽生根的最適培養基為SH+0~10 g·L-1蔗糖+7 g·L-1瓊脂。本研究認為不添加蔗糖或低濃度蔗糖是裸果木誘導生根的關鍵因素之一。
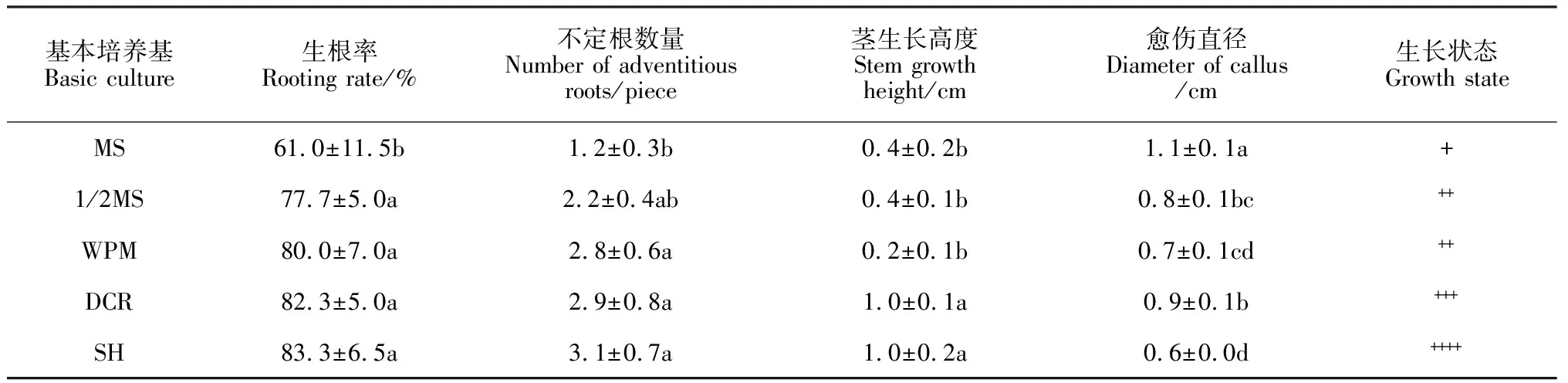
表5 裸果木不定芽生根統計表(基本培養基)

表6 裸果木不定芽生根統計表(蔗糖)
2.5 不定芽分化過程的解剖結構分析 為確認裸果木不定芽的起源,對裸果木愈傷分化過程進行解剖結構分析。培養0 d,細胞較大,形態不規則,細胞核小,染色淺(圖8,A);培養3 d,細胞質濃縮,細胞核增大,向分生細胞發育(圖8,B);培養6 d,細胞核進一步增大,染色深,具備團狀分生組織結節(圖8,C)及具有導管結構的維管組織結節(圖8,E);培養9 d,維管組織結節形態持續增大,結節內部多中心(圖8,D);培養12 d,愈傷表面有綠色凸起,切片可見愈傷表層細胞的細胞核分布集中,形成生長中心(圖8,F);培養15 d,生長中心持續極性生長,細胞核占比增大,葉原基由生長中心伸出(圖8,G);培養18 d,生長中心頂部分化出生長錐,長出愈傷(圖8,H);培養28 d,不定芽具備生長錐、節間、葉片等結構(圖8,I),愈傷內部維管組織結節解體,腋芽原基由不定芽基部分化(圖8,I箭頭)。上述裸果木愈傷分化不定芽進程分析表明,不定芽由愈傷表層分生細胞發育而來,為外起源。
3 討 論
3.1 激素對裸果木不定芽分化的影響
激素是影響不定芽分化的關鍵因素。本研究發現,不同濃度6-BA與0、0.2 mg·L-1IBA組合可誘導愈傷分化不定芽,不定芽分化率隨6-BA濃度增加,呈先上升后下降的趨勢,6-BA為0.5 mg·L-1,IBA為0 mg·L-1時,不定芽分化率顯著高于其他激素組合,因此認為,適中濃度6-BA利于不定芽分化。汪之波等[15]以裸果木下胚軸為外植體,進行裸果木的組織培養再生體系建立,認為不定芽分化誘導的最適激素組合為1 mg·L-16-BA和0 mg·L-1NAA,高濃度6-BA不利于不定芽分化,與本研究結果基本一致。但該研究添加6-BA的濃度高于本研究的最適濃度,原因可能為兩個方面,其一可能是初始愈傷誘導的激素種類和濃度的差異,造成愈傷內激素累積水平差異,導致后續芽分化中激素需求水平不同,其二可能是采用外植體的差異,汪之波采用下胚軸誘導愈傷,而本研究采用莖段誘導愈傷,可能是外植體自身生理狀態差異而導致。綜合分析,在裸果木芽分化誘導過程中,細胞分裂素6-BA具有重要作用,適中濃度6-BA有利于芽分化,而高濃度6-BA不利于芽的分化。
3.2 基本培養基和蔗糖濃度對裸果木生根的影響
基本培養基對裸果木生根具有重要影響。本研究發現,采用MS、1/2MS、DCR培養基時,愈傷形成較多,不定根由愈傷表面生成,移栽易脫落。采用WPM、SH培養基時,愈傷形成較少,多數根由莖基部直接分化形成,但WPM培養基中,不定根呈褐色,長勢弱,SH培養基中,不定根呈乳白色,生長狀態良好。因此,SH培養基適合裸果木生根培養。究其原因,可能與基本培養基內硝態氮和銨態氮的應用比例有關,MS、WPM、DCR 的硝銨比接近1∶1,而SH培養基硝態氮含量高、銨態氮含量低,硝銨比值差距大,達到25∶3,這可能是SH培養基更適合裸果木的生根的原因之一。根據裸果木的進化生境分析,其主要分布西北荒漠地區,生境干旱、土壤貧瘠。根據苗艷芳等研究發現,干旱地土壤中硝銨比值差距大,為9∶1[17],這與SH培養基中硝銨比值相似。因此認為,硝銨比值大的SH培養基利于裸果木生根,這與其歷史進化的生境可能存在相關性。
蔗糖是影響裸果木生的關鍵因素之一。本研究中,設置不同蔗糖濃度對比,發現低濃度或不添加蔗糖有利于裸果木生根及生長發育,是影響裸果木生根的關鍵因素。研究發現,高濃度蔗糖培養基中,裸果木的莖基部形成較多愈傷,由愈傷表面分化出不定根,生長緩慢,移栽時易脫落,影響成活率,但在低濃度或不添加蔗糖時,莖基部僅有少量或不出現愈傷,由基部直接分化出根,生長狀態良好。因此,蔗糖濃度與愈傷形成存在直接關系,進而影響著不定根的分化與發育。有關蔗糖與愈傷形成的相關研究發現,低蔗糖濃度可抑制草莓(strawberry)花藥壁及花絲斷口處愈傷組織產生[18]。火焰衛矛(Euonymusalatuscv. ‘Compacta’)組培苗生根時,低濃度蔗糖有利于組培苗形成不定根,促進不定根生長[19]。樟子松(Pinussylvestrisvar.mongolica)組織培養不定根時也有相同發現,低濃度蔗糖利于不定芽生根[20]。綜上所述,低蔗糖濃度可抑制愈傷生成,利于不定根分化生長。分析原因,裸果木主要分布西北荒漠地區,該地區土壤貧瘠,營養元素少,導致該植物對養分獲取積極,蔗糖濃度較低有利于模擬其正常生長生境,有利于根的分化和植物的整體生長。因此,低濃度蔗糖利于裸果木不定芽生根。
3.3 不定芽起源分析
目前,植物組織培養不定芽有兩種起源方式,外起源與內起源。多數植物僅存在外起源,而少數植物以外起源為主,內起源為輔。本研究發現,裸果木不定芽起源于愈傷表層分生細胞,為外起源。許多植物的不定芽分化均為外起源,啤酒花(HumuluslupulusL.)愈傷分化形成的維管組織結節內部的薄壁細胞及外部表層細胞均具有強大的分生能力,分化出不定芽,屬外起源[21]。辣椒(CapsicumannuumL.)不定芽起源于愈傷組織表層的分生細胞,同樣為外起源[22]。但也在其他少數植物的愈傷培養中發現,內外起源均存在,雜交構樹(BroussonetiapapyriferaL. Vent)的不定芽組織培養誘導研究發現[23],不定芽起源于愈傷組織表層細胞或內部分生組織,兩者可發育成芽原基。裸果木愈傷再生不定芽起源與啤酒花和辣椒發現的外起源類似,但研究中未發現組織內部出現芽原基,無內起源證據。因此,本研究認為裸果木愈傷再生不定芽為外起源方式。
本研究通過組織培養技術,成功建立了裸果木器官發生途徑的高效再生體系,確定了再生不定芽為外起源及基本培養基和蔗糖濃度是影響裸果木生根的關鍵因素。本研究為裸果木這一珍稀瀕危的林木種質資源保護及可持續利用奠定了研究基礎,提供了有效應用途徑。

