涂布鎳鈦合金表面的人血管內皮細胞生長因子重組質粒轉染初步研究
段 林, 何艷艷, 李天曉, 陳 松, 賀迎坤, 吳海剛, 盧韜源
目前腦血管介入技術已取得重大進展,但顱內支架應用過程中仍存在早期腦卒中風險和支架內再狹窄問題[1-2]。這可能與支架植入時血管內皮受損導致內膜下成分暴露, 炎性細胞如中性粒細胞浸潤,平滑肌細胞和成纖維細胞增殖、遷移,血管外基質重構以及炎性反應有關[3-4]。支架植入后可發生再內皮化,防止支架與血流接觸,促進活性因子的釋放,從而抑制血栓形成和炎癥,降低支架內再狹窄[5]。 許多學者將其視為改善支架性能的潛在突破點。Wu 等[6]將不同程度上調和下調的血管內皮細胞生長因子(VEGF)轉染的內皮細胞支架分別置入兔腹主動脈,1 周后發現VEGF 過表達的內皮細胞支架被完全覆蓋,而VEGF 干擾組兔則延遲至4 周,表明過VEGF表達可減少新內膜增生,促進內皮化,降低支架內再狹窄。 不過該實驗存在細胞支架儲存、運輸和植入操作不便問題。本實驗利用細胞胞吞作用,將基質膠、黏連蛋白和人VEGF 重組質粒作為鎳鈦合金絲涂層液,以便質粒主動運輸至細胞內并進行表達。
1 材料與方法
1.1 實驗材料和試劑
人VEGF 重組質粒由本中心實驗室原先合成。人臍靜脈內皮細胞購自中國科學院, 鎳鈦合金絲(d=0.66 mm)由湖南瑞康通科技發展公司提供。 基質膠、 黏連蛋白購自北京索萊寶科技公司,Hoechst熒光染料和4%多聚甲醛購自上海碧云天生物技術公司, 人臍靜脈內皮細胞培養液購自武漢普諾賽生命科技公司,胰酶和磷酸緩沖液(PBS)購自美國Thermo Fisher 科技公司。
1.2 鎳鈦合金絲表面處理和涂層制備
將鎳鈦合金絲剪成1 cm 長,分別用丙酮、無水乙醇和去離子水超聲10 min,洗去表面污漬,氮氣吹干后置于4℃冰箱備用。 將分裝的基質膠、黏連蛋白和人VEGF 重組質粒于4℃冰箱過夜解凍, 在低溫配液恒溫模塊上用預冷槍頭將涂層液配制成基質膠(5 mg/mL)、黏連蛋白(40 μg/mL)、重組質粒(50 ng/μL)混合液,置于4℃脫色搖床過夜搖勻。 生物安全柜中,鎳鈦合金絲用PBS 清洗3 遍,浸泡于放置低溫配液恒溫模塊上的涂層液30 min;取出鎳鈦合金絲,放入24 孔細胞培養板,一并置于37℃細胞培養箱1 h;取出鎳鈦合金絲,用PBS 輕輕清洗2 遍,轉移至新的24 孔板,等待細胞接種。
1.3 細胞培養和接種
生物安全柜紫外滅菌30 min; 取凍存細胞于37℃水浴中快速溶解,離心(1 000 r/min)3 min;棄上清液,加入2 mL 完全培養基重懸;細胞懸液轉入含8 mL 完全培養基的10 cm 培養皿,搖勻,鏡下觀察細胞狀態,置于細胞培養箱,次日換液,待細胞密度達90%左右行傳代和接種;吸棄舊培養基,PBS 清洗2 遍,加入1 mL 胰酶,鏡下觀察細胞形態,待細胞變圓加入2 mL 完全培養基終止消化, 移入15 mL離心管,1 000 r/min 離心3 min,棄上清液,加入2 mL完全培養基重懸,從中吸取10 μL 懸液于血球計數板計數, 以每孔8×104細胞量接種于上述鎳鈦合金絲,并培養48 h。 其余懸液按比鋪板于10 cm 培養皿,繼續培養備用。
1.4 細胞染色和檢測
48 h 后取出24 孔板, 生物安全柜中吸棄舊培養基,用PBS 清洗2 遍,將全部鎳鈦合金絲轉至新的24 孔板中, 滴加多聚甲醛固定液使其淹蓋鎳鈦合金絲表面, 固定15 min, 取出分裝的Hoechst 染料,避光1∶1 000 稀釋,并滴加24 孔板中,淹蓋鎳鈦合金絲表面,15 min 后用錫紙將其包裹, 進行正置熒光檢測。
2 結果
48 h 后, 正置熒光顯微鏡觀測到基質膠+黏連蛋白包被的鎳鈦合金絲表面細胞有藍色熒光,無綠色熒光;含人VEGF 重組質粒包被的鎳鈦合金絲表面細胞有藍色熒光和綠色熒光,如圖1 所示。 表明人VEGF 重組質粒已轉染至人臍靜脈內皮細胞并進行表達,與預期結果一致,為下一步構建此類重組質粒涂層尊定了基礎。
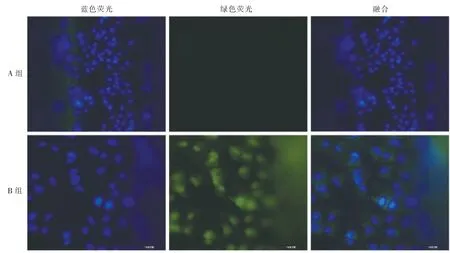
圖1 正置熒光顯微鏡下質粒轉染示意圖
3 討論
隨著介入器材改進,以及水凝膠、聚羥基乙酸(PGA)、乙交酯-丙交酯共聚物(PGLA)、纖維和聚四氟乙烯等修飾的彈簧圈,藥物洗脫支架和覆膜支架臨床應用,神經介入術治療腦血管疾病效果不斷提高[7-8]。 但目前經修飾的材料基本是不可降解材料,植入后仍會發生炎癥、術后再內皮化延遲、血栓形成和支架內再狹窄等[9-11],其基因分子層面研究與實施仍處于探索階段。
基因治療是將外源正常基因導入靶細胞,以糾正或補償缺陷與異常基因引起的疾病,達到治療目的。 其中也包括轉基因等方面技術應用,也就是將外源基因通過基因轉移技術插入患者適當的受體細胞,使外源基因制造的產物能治療某種疾病。 基因治療廣義上還可包括從DNA 水平采取的治療某些疾病的措施和新技術。DNA 這種僅被稱為遺傳信息的物質,因其序列可編程性、分子識別性、可重構性和可預測的自組裝性,以驚人的速度被鑒定并作為一種新材料被利用[12-13]。 DNA 本身是一種天然納米尺度材料[14],其衍生物如DNA-RNA[15]、DNA-金屬雜交體[16]和肽核酸(PNA)[17]可通過編程技術轉換成具有明確取向、間距、立體關系及與生物分子更優相互作用的自組裝材料,這使其在改進材料發展和臨床應用中具有里程碑意義[18-19]。 質粒是基因工程最常見運載體和細胞染色體外能自主復制的一種很小的環狀DNA 分子, 它的存在與否一般對宿主細胞生存無決定性作用,是基因治療中的理想媒介。 Zha 等[20]用電轉法構建一種含VEGF 重組質粒的外泌體,并將其與3D 打印的多孔骨支架結合,體內研究表明該支架可有效誘導大量血管化骨再生。同樣Ding 等[21]將編碼基質金屬蛋白酶-3 組織抑制因子的質粒凍干在金屬-聚合物導體支架內表面,動物實驗表明該支架可明顯抑制兔模型靜脈移植的內皮增生。
本實驗利用細胞胞吞作用,將基質膠、黏連蛋白和人VEGF 重組質粒作為鎳鈦合金絲涂層液進行表面修飾,以便質粒主動運輸至細胞內并進行表達,正置熒光顯微鏡觀測到人VEGF 重組質粒組鎳鈦合金絲表面細胞含綠色熒光,表明人VEGF 重組質粒轉染成功, 也為構建質粒基因涂層尊定了基礎。 本實驗創新之處:基質膠在10℃以上會發生凝固成膠,此特性符合人體溫度;基質膠本身有促進細胞生長的作用,對人體無細胞毒性;質粒通過主動轉運進入細胞, 動物實驗時不需其他輔助手段。但也存在不足之處,僅靠質粒主動轉運作用效率較低,涂層粘附性欠缺,對于是否達到治療的理想狀態,還需進一步驗證涂層的生物學特性以及后期動物實驗模型驗證。

