長鏈非編碼RNA LINC01105調控肝癌對胸腺素α1耐藥①
黃鳳霞 李海燕 李正堃 黃君華 雷 燕 (西安醫學院醫學技術學院,西安 710021)
長鏈非編碼RNA(long-chain non-coding RNA,lncRNA)一般是指無蛋白產物且長度大于200 nt 的RNA 轉錄本,是轉錄和轉錄后過程調控網絡中的一部分,在哺乳動物基因組中廣泛表達,參與DNA 甲基化、染色質重塑、轉錄和翻譯等多種生物學過程調控[1-2]。lncRNA 通常由RNA 聚合酶Ⅱ轉錄形成,與mRNA 一樣含5'端帽子結構,常用于拼接和多聚腺苷酸化[3]。與mRNA 相比,lncRNA 表現出一定序列保守性,因此lncRNA 序列似乎不如其高級結構重要,lncRNA 的二級和三級結構在其功能上起重要作用[4]。YE 等[5]研究報道,LINC01105 在神經母細胞瘤中可通過其miR-6769b-5p 信號軸促進靶基因VEGFA 表達,在神經母細胞瘤發生發展過程中起重要作用。
世界衛生組織數據顯示,肝癌是全球第六大常見癌癥,在癌癥引起的死亡中位列第四,與肝癌耐藥性密切相關[6]。胸腺素廣泛分布于多種組織中,尤其是胸腺肽α1和胸腺肽β4在醫學上具有重要用途,其中胸腺肽α1的生物活性包括促進淋巴細胞生成、恢復免疫能力和增強T細胞特征和功能等,在原發性或繼發性免疫缺陷疾病、癌癥或衰老相關疾病患者中具有治療潛力[7-9]。研究顯示,采用胸腺肽α1治療肝癌具有明顯優勢,可顯著延長患者無復發生存 期(recurrence-free survival,RFS)和 總 生 存 期(overall survival,OS),但 仍 存 在 胸 腺 肽α1 耐 藥性[10-11]。本研究擬探究LINC01105 能否調控肝癌對胸腺素α1的耐藥性及可能機制。
1 材料與方法
1.1 材料
1.1.1 組織 本研究共收集26例肝癌患者資料及手術/活檢的肝組織樣本以及26 例肝良性增生患者資料及活檢的肝組織樣本。26 例肝癌患者中,甲胎蛋白(alpha-fetoprotein,AFP)<25.0 μg/ml 者5 例,25.0~200.0 μg/ml 者15 例,>200.0 μg/ml 者6 例;26 例肝良性增生患者中,AFP<25.0 μg/ml 者11 例,25.0~200.0 μg/ml 者11 例,>200.0 μg/ml 者4 例。兩組受試者性別、年齡、體重指數及AFP 水平均具有可比性(P>0.05)。本研究經川北醫學院附屬醫院倫理委員會批準同意,患者知情同意。
1.1.2 實驗動物 BALB/c 小鼠購自國家嚙齒類實驗動物種子中心上海分中心,合格證號:0020627-SCXK(SH)2007-0005。
1.1.3 主要試劑與儀器 HEK-293T 細胞、L-02 細胞、Huh7 細胞、Hep-3B 細胞和HepG2 細胞均購自中國科學院上海生命科學研究所細胞庫;MEM 培養基、胎牛血清購自Gibco;DMEM 培養基、無RNase 水購 自Hyclone;Lipofectamine2000 購 自Invitrogen;TRIzol 試劑購自Life Technology 公司;酚氯仿異戊醇、異丙醇等化學試劑購自國藥集團;逆轉錄試劑購自日本TaKaRa公司;SYBR Green熒光定量試劑盒購自Bio-Rad;海腎熒光素酶報告基因檢測試劑盒購自Promega 公司;流式細胞術實驗相關試劑均購自GE Healthcare 公司;戊巴比妥鈉購自Sigma 公司;Nanodrop 2000 超微量分光光度計購自Thermofisher公司。
1.2 方法
1.2.1 細胞培養與轉染 HEK-293T 細胞、L-02 細胞、Hep-3B 細胞和HepG2 細胞采用MEM 培養基培養,Huh7 細胞采用DMEM 培養培養,培養基中均加入10%胎牛血清,培養條件:37 ℃、5%CO2。采用脂質體Lipofectamine2000 進行細胞瞬時轉染,操作方法參照Invitrogen產品說明。消化細胞并按5×104個/孔鋪至12 孔板,待細胞完全貼壁且達到60%融合時,采 用Lipofectamine2000 進 行sh-NC、sh-LINC01105、oe-miR-6769b-5p 和sh-LINC01105+oe-miR-6769b-5p慢病毒轉染,37 ℃、1%O2、5%CO2和94%N2條件下培養48 h備用。
1.2.2 qRT-PCR 采用TRIzol 試劑提取總RNA,Nanodrop 2000 儀器檢測,測量RNA 濃度。根據濃度計算逆轉錄使用RNA 的體積,采用逆轉錄試劑盒將1 μg RNA 逆轉錄為cDNA。采用無RNase 水將cDNA 稀釋10 倍,并作為模板采用SYBR Green 熒光定量試劑盒進行qRT-PCR 檢測,引物序列見表1。所有實驗重復3次。
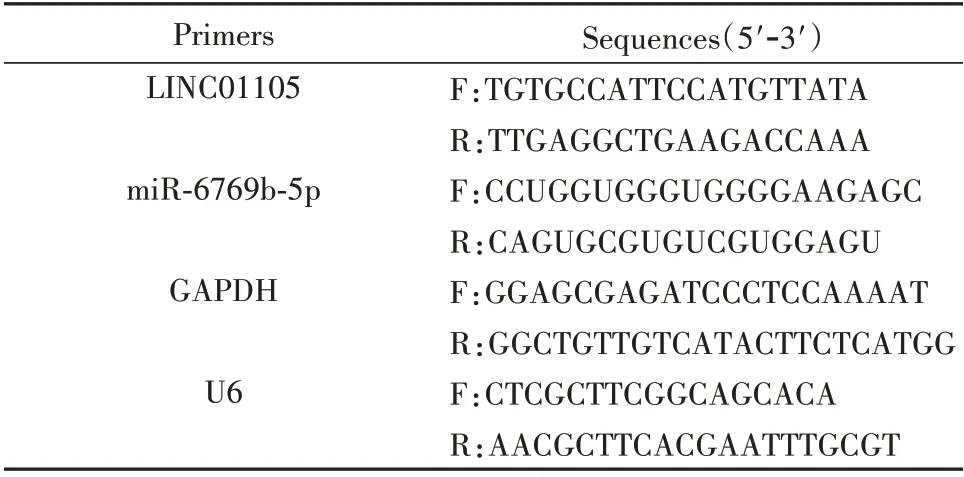
表1 引物序列Fig.1 Primer sequence
1.2.3 熒光素酶報告實驗 將HEK293T細胞接種于24 孔板,培養24 h。人工構建miR-6769b-5p 野生型啟動子雙熒光素酶報告基因載體pGL4.10-hRluc,將miR-6769b-5p 預測結合位點突變的突變體MutmiR-6769b-5p和LINC01105雙熒光素酶報告基因載體共轉染HEK293T 細胞,轉染48 h 后吸出培養基,PBS 洗2 遍,收集并裂解細胞,將生長培養基吸盡,PBS漂洗,加入1×PLB 裂解液室溫搖床充分裂解,采用Promega 海腎熒光素酶報告基因檢測試劑盒及熒光素酶底物發光檢測儀進行檢測,根據產品和儀器說明操作。所有實驗重復3次。
1.2.4 小鼠肝癌異種移植模型構建 將獲得穩定轉染的細胞系體外培養7 d后制備50 μl單細胞懸液(1×106個/ml),合 并50 μl Matrigel 溶 液 注 射 于BALB/c 小鼠腹股溝區域,每組8 只。移植當日記為第0天,移植第7天開始每隔1周采用游標卡尺測量腫瘤大小,記錄并計算腫瘤體積(V)=0.8×2/3×D12×D2(D1、D2 分別為相互垂直的最長直徑與最短直徑)。手術移除原位移植瘤并統計瘤體重量。靜脈注射3倍濃度的3%戊巴比妥鈉處死小鼠,本研究經西安醫學院動物倫理會批準。
1.2.5 流式細胞術 收集不同處理的Huh7 細胞,0.25%胰蛋白酶消化,計數并調整細胞濃度至1×106個/ml,取1 ml 細胞1 500 r/min 離心10 min,棄上清,每毫升細胞加2 ml PBS,離心,棄上清,加入預冷70%乙醇固定細胞,4 ℃過夜。第2天用PBS洗滌細胞2次,取100 μl細胞懸液,加入至0.5 ml含50 μg/ml RNAase PI 溶液中避光反應30 min,100 目尼龍網過濾,流式細胞儀檢測G1期、S期和G2期細胞比例。
1.2.6 LINC01105 通 過miR-6769b-5p 對 肝 癌 細 胞胸腺素α1 耐藥性的影響 分別敲低LINC01105 和miR-6769b-5 表達,并設置4 組轉染Huh7 細胞:sh-NC+NC inhibitor;sh-LINC01105+NC inhibitor;sh-NC+miR-6769b-5p inhibitor 和 sh-LINC01105+miR-6769b-5p inhibitor,qRT-PCR 驗 證4 組 細 胞LINC01105和miR-6769b-5p表達。采用不同濃度胸腺素α1 處理4 組細胞48 h,每組設5 個復孔,CCK-8實驗檢測細胞存活率。
1.3 統計學分析 采用SPSS21.0軟件進行統計學處理,計量資料采用±s表示,兩組間比較采用t檢驗,多組間比較采用單因素方差分析。P<0.05表示差異具有統計學意義。
2 結果
2.1 LINC01105 和miR-6769b-5p 與肝癌的關系qRT-PCR 結果表明,肝癌組織中LINC01105 呈顯著高表達(圖1A),miR-6769b-5p 呈顯著低表達(圖1B)。與人正常肝細胞L-02相比,肝癌細胞系中LINC01105 呈高表達,miR-6769b-5p 呈低表達,其中Huh7 細胞中LINC01105 表達最高(圖1C),因此采用Huh7 細胞進行后續實驗。提示LINC01105 和miR-6769b-5p與肝癌發生密切相關。
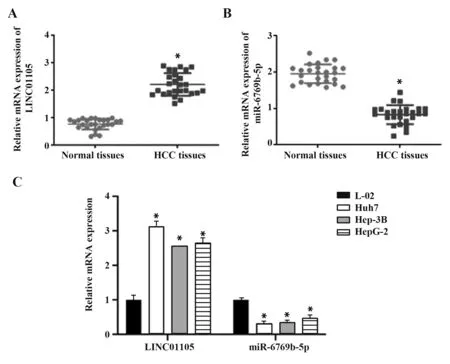
圖1 肝癌組織及細胞LINC01105和miR-6769b-5p表達Fig.1 LINC01105 and miR-6769b-5p expressions in liver cancer tissues and cells
2.2 LINC01105 靶向抑制miR-6769b-5p 表達 采用Targetscan 預測LINC01105 和miR-6769b-5p 的靶向抑制關系,LINC01105 和miR-6769b-5p 靶向作用位點如圖2A 所示。課題組在Huh7 細胞中敲低LINC01105 表達,并采用qRT-PCR 檢測LINC01105的敲低效率(圖2B)。在Huh7 細胞中成功敲低LINC01105 后,采用熒光素酶報告實驗確定LINC01105 對miR-6769b-5p 的靶向抑制關系(圖2C),發現敲低LINC01105后,miR-6769b-5p表達顯著上調(圖2D)。表明LINC01105 可靶向結合miR-6769b-5p,并抑制miR-6769b-5p表達。
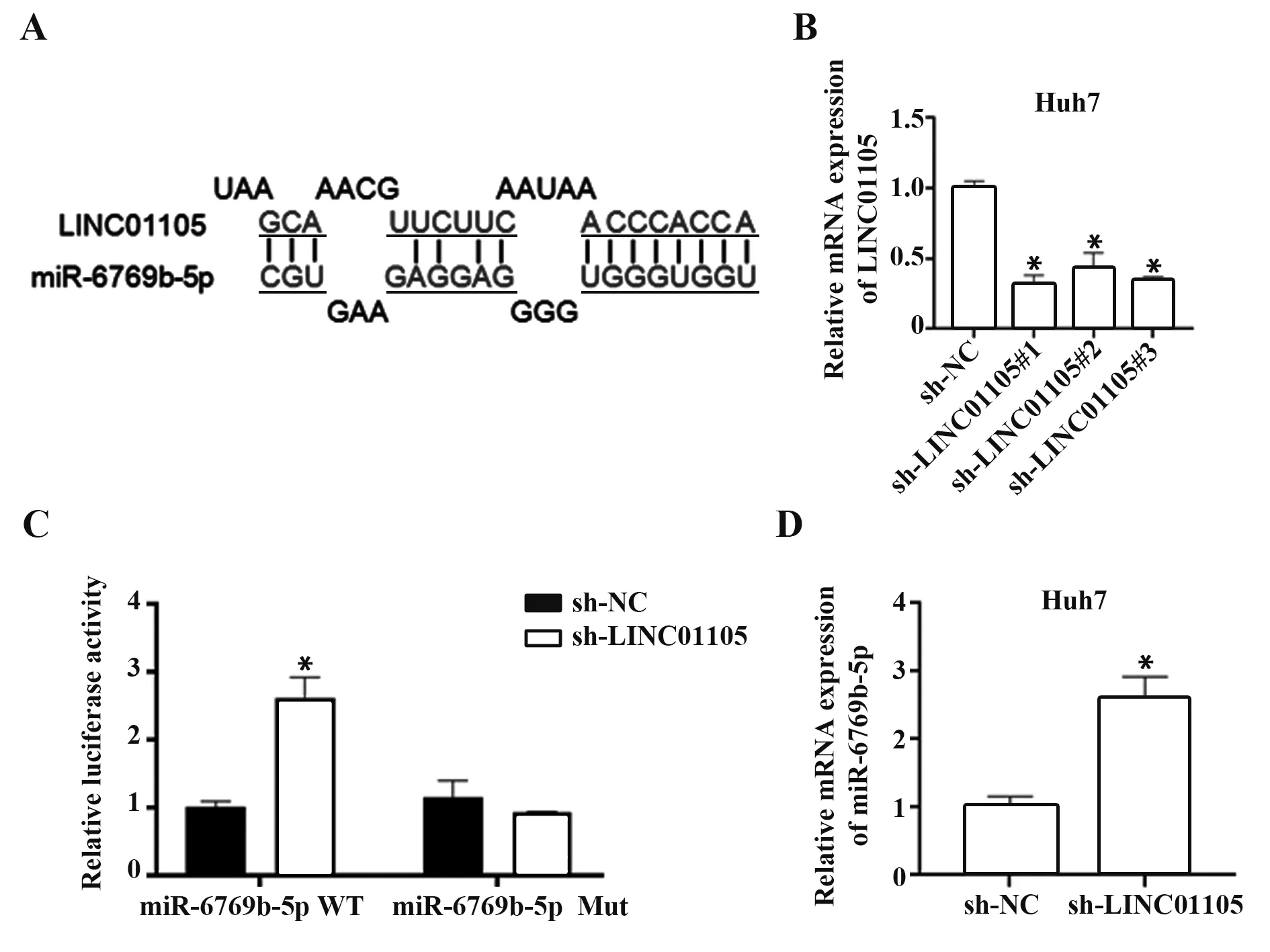
圖2 LINC01105靶向抑制miR-6769b-5p表達Fig.2 LINC01105 targeting inhibiting miR-6769b-5p expression
2.3 LINC01105 通過miR-6769b-5p 促進肝癌細胞對胸腺素α1 的耐藥性 敲低LINC01105 表達可顯著增強Huh7 細胞對胸腺素α1 的敏感性,過表達miR-6769b-5p 可顯著增強Huh7 細胞對胸腺素α1的敏感性,敲低LINC01105 聯合過表達miR-6769b-5p進一步增強Huh7細胞對胸腺素α1的敏感性。進一步采用0.5 μmol/L 胸腺素α1 處理各組細胞48 h,流式細胞術檢測細胞周期分布,結果表明,敲低LINC01105和過表達miR-6769b-5p均可抑制細胞進入G1期,使細胞停滯于S期(圖3)。
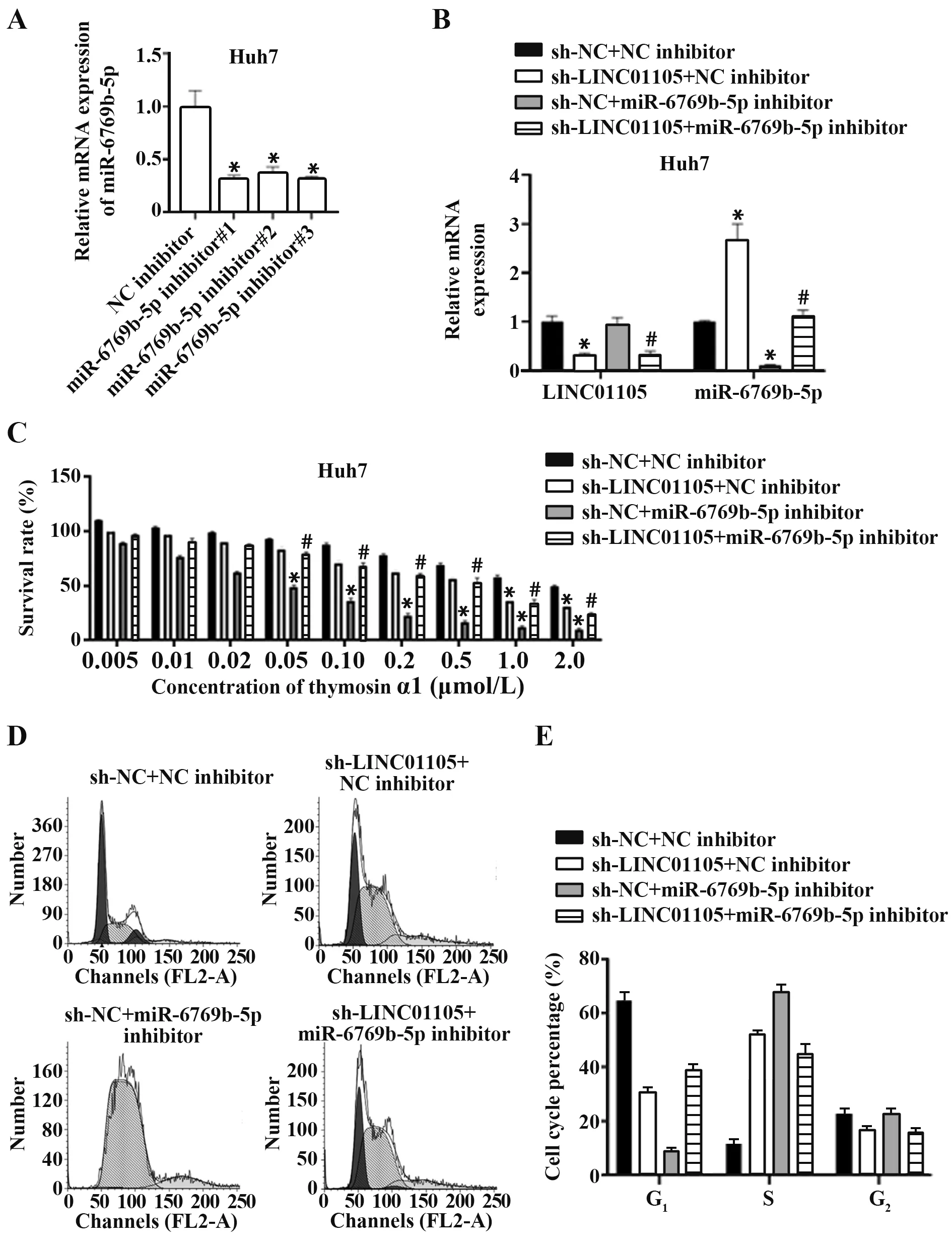
圖3 LINC01105通過miR-6769b-5p促進肝癌細胞對胸腺素α1的耐藥性Fig.3 LINC01105 promoted resistance of HCC cells to thymosin α1 through miR-6769b-5p
2.4 LINC01105通過miR-6769b-5促進肝癌在小鼠體內對胸腺素α1 的耐藥性 將4 組轉染的Huh7 細胞皮下接種至小鼠腹股溝成瘤,持續21 d,每天灌胃給予0.5 mg/10 g胸腺素α1,qRT-PCR檢測小鼠皮下腫瘤中LINC01105 和miR-6769b-5p 表達,結果表明各組小鼠皮下腫瘤中,敲低LINC01105 表達,miR-6769b-5p表達顯著上調(圖4A)。抑制miR-6769b-5p表達也可顯著下調miR-6769b-5p 表達,小鼠6 周內存活率顯示,敲低LINC01105 表達可降低皮下腫瘤質量和體積,提高小鼠存活率,敲低LINC01105同時過表達miR-6769b-5p,可進一步降低小鼠皮下腫瘤質量和體積,提高小鼠存活率(圖4B~D)。
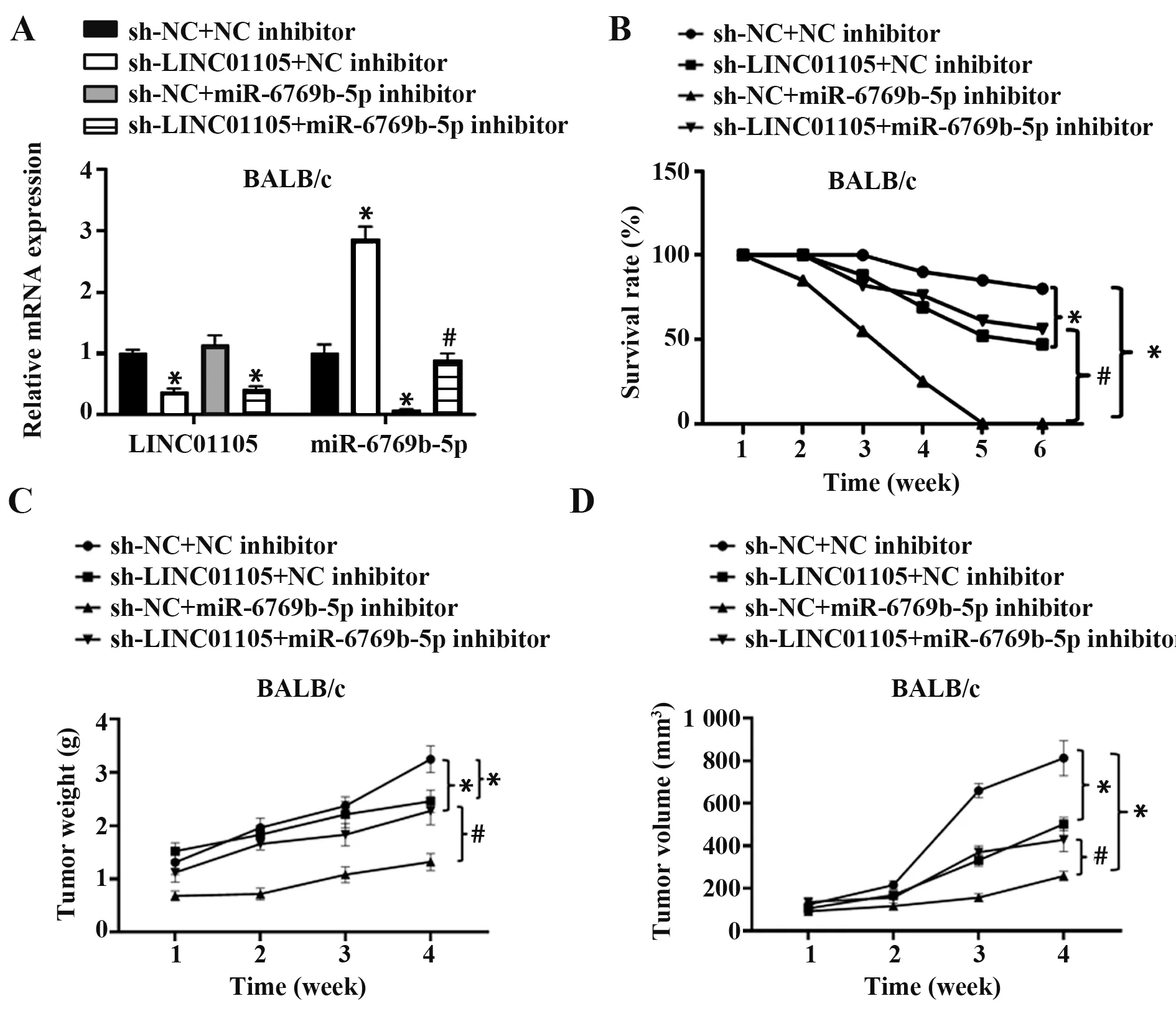
圖4 LINC01105通過miR-6769b-5p促進肝癌細胞對胸腺素α1的耐藥性Fig.4 LINC01105 promoted resistance of HCC cells to thymosin α1 through miR-6769b-5p
3 討論
肝細胞癌是原發性肝癌的主要類型,也是全球致死率最高的癌癥之一。因此革新肝癌治療手段,提高患者生存率及生活質量,是目前所亟須解決的問題。作為一種新發現的lncRNA,近年報道中LINC00511在包括肺癌、乳腺癌、胰腺癌、宮頸癌、肝癌、卵巢癌和膠質瘤在內的多種癌癥中表達上調并與癌癥發生密切相關,其潛在作用機制包括促進腫瘤的增殖、細胞周期進程、侵襲、遷移、轉移和化療耐藥及抑制細胞凋亡等[5]。此外,LINC00511 上調往往預示不良預后,也代表臨床上LINC00511 可被用作癌癥患者預后的生物標志物。本研究結果顯示,與正常肝組織比,肝癌組織顯著增高(P<0.05),與人正常肝細胞L-02相比,肝癌細胞系Huh7、Hep-3B和HepG2 LINC01105 表達顯著增高(P<0.05),與上述文獻結論一致。
本研究證實了胸腺素α1對肝癌的抗癌活性,胸腺素α1可促進淋巴細胞生成、增強T細胞功能等,可通過增強人體免疫功能從而恢復潛在的殺傷癌細胞能力[12]。進一步研究顯示,肝癌細胞模型中LINC00511 呈高表達,miR-6769b-5p 呈低表達,且LINC00511 可 負 向 調 控miR-6769b-5p 表 達,敲 低LINC01105 表達可顯著增強Huh7 細胞對胸腺素α1的敏感性,過表達miR-6769b-5p 可顯著增強Huh7細胞對胸腺素α1的敏感性,敲低LINC01105聯合過表達miR-6769b-5p 可進一步增強Huh7 細胞對胸腺素α1 的敏感性,與既往文獻結論一致[5]。同時本研究結果也為后續研究提供了方向,即調節LINC00511或miR-6769b-5p表達的新藥聯合胸腺素α1或可成為肝癌治療的新方案。
綜上所述,LINC01105可通過靶向miR-6769b-5p調節肝癌對胸腺素α1的耐藥性。

