特香型酒曲儲存期霉菌的分離鑒定及對酒曲理化指標的影響
李嘉宇,楊玉蓉,朱棟才,李 杰,楊志龍,楊 濤,*
(1.中南林業科技大學 食品科學與工程學院,湖南 長沙 410004;2.江西李渡酒業有限公司,江西 南昌 331725;3.湖南湘窖酒業有限公司,湖南 邵陽 422006)
特香型白酒主體香為清香帶濃香,細聞有焦糊香,濃、清、醬香型白酒特征兼而有之,但又不接近哪一種香型。“曲為酒之骨”,酒曲作為釀酒生產中的一種糖化劑、發酵劑與生香劑,在發酵過程中起著至關重要的作用,故有“有美酒必備佳曲”之說[1]。在釀酒生產過程中,酒曲在提高出酒率、降低糧耗、增加優質品率、保持香型穩定等方面有著重要的作用[2]。不同類型的酒曲能生產不同類型的酒。酒曲微生物是發酵產酒的本質原因,所以只要了解酒曲中微生物的習性與作用,就能夠對改善酒曲品質以及出酒的質量起到指導生產的作用。
國內有關酒曲的相關研究較多,但有關特香型酒曲霉菌控制則相對少見。劉效毅等[3]通過分子生物學對高溫大曲中的微生物進行序列分析,鑒定得到大曲中細菌主要是芽孢桿菌、放線菌、葡萄球菌、微球菌;霉菌主要是青霉、曲霉、毛霉、交鏈孢霉、莖點霉菌、球毛殼、散囊菌、紅曲霉。酒曲中霉菌的生長伴隨著大曲生產的整個環節,特香型大曲中霉菌類群占一定比例,數量能達到104CFU/g,主要是毛霉、青霉和曲霉[4-5]。霉菌能夠產生分解淀粉和蛋白質的酶,不同種類的霉菌能夠產生不同種類的酶,在不同的發酵條件下產生的酶種類與作用都不盡相同,其主要功能是分泌糖化酶、液化酶及蛋白酶,對分解釀酒原料中的淀粉、蛋白質等大分子物質具有積極的推動作用,使得整個反應體系中糖類及氨基酸含量升高,可為其他微生物的代謝提供基礎物質,亦為后續的酒體風味形成奠定基礎[6-8]。霉菌的主要來源為空氣、場地、原輔料、母曲及人體[9]。隨著白酒工藝的日漸發展,消費群體層次的改變,白酒行業也在不斷進行著改革創新,人們對白酒的品質要求也日漸提高。特香型酒曲的貯藏期在3~6個月不等[10],如何保證酒曲在貯藏期的品質質量現已成為了各個酒廠的關鍵問題。酒曲在貯藏期最常見的質量問題就是長霉,適量的霉菌在酒曲中有加強風味、提高酒曲質量的作用[11]。但是霉菌過多則會使得酒曲出現霉變結塊、有雜質、風味不純等問題。如若使用了這些霉變酒曲釀酒會使酒體帶有邪雜味,色澤與醇厚感也會大打折扣,還對人體健康有很大的威脅[12]。
本研究以江西某企業提供的不同質量特香型酒曲為原料,測定了霉菌二次生長大曲的理化指標,并對毛霉的理化性質、對酵母產酒精能力的影響進行分析,為后續特香型大曲的防霉抑霉工作提供理論基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 實驗樣品
同一批次霉菌二次生長曲樣(霉心曲塊、霉曲整塊)與正常曲樣(好曲整塊)若干:江西某特香型酒企提供;米根霉(Rhizopus oryzae)1號、釀酒酵母(Saccharomyces cerevisiae):保存于中南林業科技大學食品科學與工程學院。
1.1.2 化學試劑
葡萄糖、氫氧化鈉、鹽酸、可溶性淀粉、碘、碘化鉀、DL5 000 Marker(均為分析純或生化試劑):國藥集團化學試劑有限公司;脫氧核糖核酸(deoxyribonucleic acid,DNA)提取試劑盒:天根生化科技(北京)有限公司。
1.1.3 培養基
A:馬鈴薯葡萄糖培養基(potato dextrose agar,PDA):200 g馬鈴薯,20 g葡萄糖,17 g瓊脂,1 000 mL蒸餾水。115 ℃滅菌20 min。
B:PDA+大曲浸出汁(10%):200 g馬鈴薯,20 g葡萄糖,17 g瓊脂,900 mL蒸餾水,100 mL大曲浸出汁。
大曲浸出汁液(10%):將100 g正常曲樣搗碎,加900 mL水,振蕩1 h,過濾,棄去濾渣,收集大曲浸出汁。115 ℃滅菌20 min。
1.2 儀器與設備
AC2-2E8超凈工作臺:新加坡藝思高科技有限公司;YXQ-50A立式高壓滅菌鍋:上海博訊實業有限公司醫療設備廠;MIR-150A恒溫培養箱:上海三騰儀器有限公司;YCW-160B搖床:上海捷呈實驗儀器有限公司;3730XL測序儀、2720 thermal cycler聚合酶鏈式反應(polymerase chain reaction,PCR)儀:美國Applied Biosystems公司;Legend Micro17離心機:Thermo公司;JY300C電泳儀、JYDF電泳槽、JY04S-3C凝膠成像儀:北京君意東方電泳設備有限公司;DFD-700水浴鍋:北京中興偉業儀器有限公司。
1.3 實驗方法
1.3.1 酒曲樣品菌群分析方法
內部轉錄間隔區核糖體脫氧核糖核酸(internal transcribed spacer ribosomal deoxyribonucleic acid,ITS rDNA)擴增子測序,是通過特異性引物擴增樣本中原核生物ITSrDNA的可變區,構建高通量測序文庫并對ITS rDNA可變區序列進行分析,從而鑒定環境中原核微生物的組成與豐度的方法。ITS rDNA擴增子測序的實驗流程包括樣本基因組DNA的提取與質檢、ITS rDNA可變區擴增與測序文庫構建、高通量測序等多個步驟,該部分操作委托蘇州金唯智公司進行測試,將所有優化后的序列與物種操作單元(operational taxonomic units,OTU)代表序列進行比對,與OTU代表序列相似性在97%以上的序列為同一OTU,統計生成OTU豐度表。
1.3.2 特香型大曲理化指標的測定
水分測定:使用差重法,將大曲試樣置于101 ℃條件下烘干3 h并取出冷卻稱質量,重復試驗直至質量恒定(精確至0.001 g)[13]。
糖化力測定:使用滴定法,參考QB/T4257—2011《釀酒大曲通用分析方法》[14]。空白對照記錄其消耗葡萄糖體積為V1,正式實驗記錄其消耗葡萄糖體積V2,糖化力按下式計算:
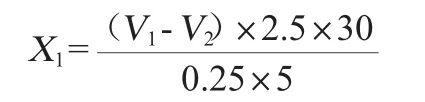
式中:X1為糖化力,mg/(g·h);V1、V2是消耗葡萄糖溶液體積,mL。
淀粉含量測定:參考QB/T4257—2011《釀酒大曲通用分析方法》。
液化力測定:制備5%酶液,使用比色法測定液化力,參考QB/T4257—2011《釀酒大曲通用分析方法》,記錄下反應時間t。液化力以下式計算:
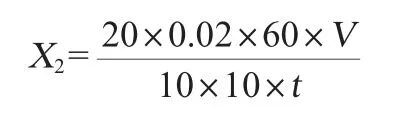
式中:X2為液化力,g/(g·h);V是酶液定容體積,mL。
酸度測定:取大曲試樣10 g,加無菌水200 mL,常溫振蕩30 min,收集濾液。吸取樣液20 mL加無菌水30 mL,用0.1 mol/L氫氧化鈉溶液滴定至pH為8.2,記錄氫氧化鈉溶液體積V1,同時做空白實驗,記錄體積V0,酸度以下式計算[15]:
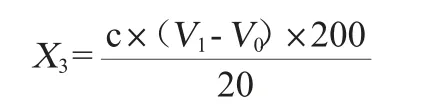
式中:X3為酸度,mmol/10 g;c為氫氧化鈉溶液濃度,mol/L;V1、V0是消耗氫氧化鈉溶液體積,mL。
1.3.3 霉菌的分離鑒定
取霉菌二次生長明顯的大曲,將發霉部分(約10 g)取下,加入90 mL無菌水,放入錐形瓶中振蕩1 h,將其孢子完全振蕩至懸液中。以涂布的方式將上述孢子懸液涂布至A、B兩種培養基中,30 ℃備用。使用DNA提取試劑盒提取DNA,進行PCR擴增、凝膠電泳。ITS rDNA擴增子的引物對為ITS1:5'-TCCGTAGGTGAACCTGCGG-3',ITS4:5'-TCCTCCGCTTATTGATATGC-3'。菌種鑒定序列與美國國立生物技術信息中心(national center for biotechnology information,NCBI)的GenBank數據庫進行比對。ITS擴增體系為:1×PCR mix 45 μL、ITS1(10P)2 μL、ITS4(10P)2 μL、DNA模板1 μL。PCR擴增程序見表1。

表1 聚合酶鏈反應擴增程序Table 1 PCR amplification procedure
1.3.4 傘狀毛霉對酵母產酒精能力的影響
酵母產酒精能力的測定參照王犁燁等[16]的方法,將菌液濃度均為106CFU/mL的霉菌孢子懸液與釀酒酵母菌懸液以不同比例混合,以5%的接種量分別裝于有杜氏小管以及15 mL的PDA液體培養基的試管中,要確保杜氏小管內無氣泡,30 ℃搖床培養。每隔12 h觀察一次產氣情況并記錄杜氏小管內的氣體體積[17]。
1.3.5 pH適應性
配制PDA培養基后滅菌,在超凈臺中使用1 mol/LNaOH溶液或1 mol/L HCl溶液調整其pH值分別為5、6、7、8、9、10、11、12。將霉菌二次生長曲樣在30 ℃自然濕度條件下培養3 d,每隔12 h測其菌落直徑[18-19]。
1.3.6 溫度適應性
將接種霉菌的平板分別于25℃、30℃、35℃、40℃、45℃,自然濕度條件下培養3 d,每隔12 h測其菌落直徑[20]。
1.3.7 濕度適應性
將霉菌接種的平板分別于濕度70%、75%、80%、85%、90%、95%,30 ℃條件下培養3 d,每隔12 h測其菌落直徑[21]。
1.3.8 數據處理
運用Excel 2019進行數據收集處理,Origin 9.0進行繪圖。
2 結果與分析
2.1 OTU聚類分析
由表2可知,霉菌二次生長酒曲的OTU6毛霉為主要的二次生長霉菌,其數量顯著高于優質酒曲5~10倍。而在根霉OTU數量上,好曲要多于霉菌二次生長的酒曲。
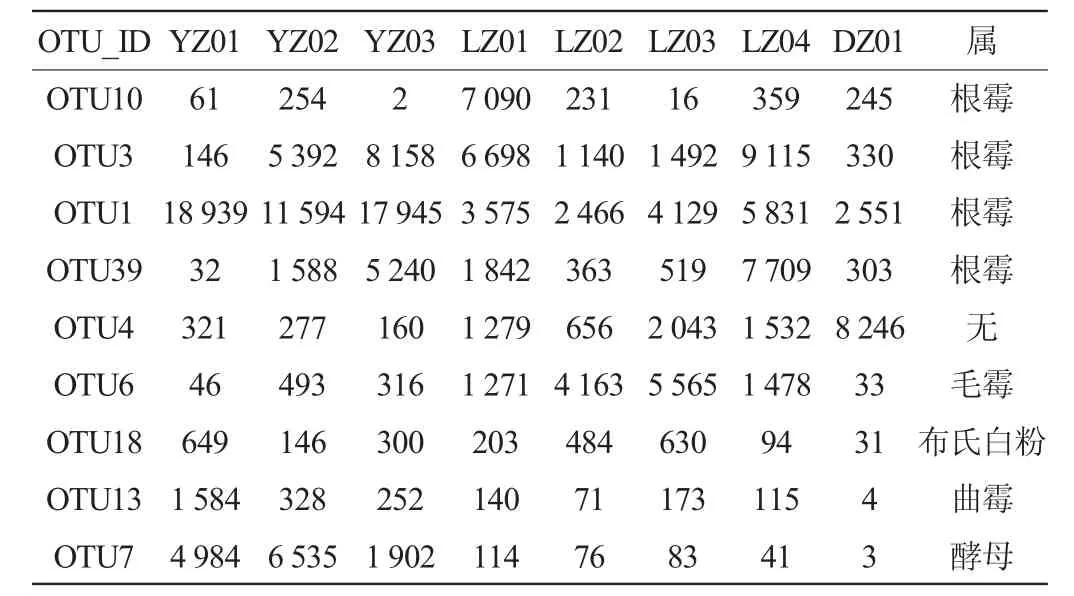
表2 酒曲樣品OTU聚類分析Table 2 OTU cluster analysis of Jiuqu sample
2.2 特香型大曲理化指標測定
2.2.1 水分含量測定
大曲貯存的時間越長,成曲中的水分含量就越低,表明發酵產生的游離水分越多、揮發程度越好,大曲發酵的成熟度就越好。由圖1可知,霉心曲塊、好曲整塊、霉曲整塊的水分含量依次為14.5%、12.5%、11.7%。霉心曲塊水分含量最高,所以霉菌生長的最好;而霉曲整塊的水分含量比好曲整塊要低,分析原因是因為霉心處水分含量比整體高,能促進真菌細菌的生長繁殖,而微生物的大量繁殖會產生熱量,會導致周圍的曲塊水分蒸發[22-23]。
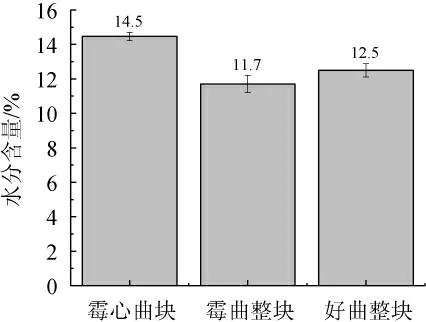
圖1 酒曲水分含量比較Fig.1 Comparison of moisture contents of Jiuqu
2.2.2 糖化力測定
糖化力是衡量酒曲糖化作用強弱最重要的指標,指的是酒曲中具有糖化作用的酶及微生物將淀粉轉化為糖的能力,酒曲糖化力的高低受到很多因素(如溫度、濕度、微生物生長情況等)的影響,是酒曲最為重要的理化指標之一。由圖2可知,好曲整塊、霉曲整塊、霉心曲塊的糖化力依次為818.6 mg/(g·h)、669.8 mg/(g·h)、622.8 mg/(g·h)。毛霉的糖化力本就比根霉要低很多,分析原因是因為酒曲中毛霉的二次生長影響了根霉的糖化作用。糖化力下降導致大曲糖化能力不足,淀粉轉化為糖的能力下降,曲中糖分減少[24]。
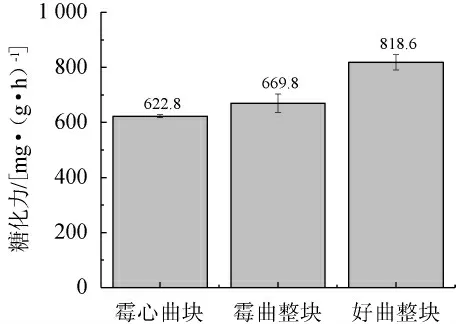
圖2 酒曲糖化力比較Fig.2 Comparison of saccharification power of Jiuqu
2.2.3 淀粉含量測定
由圖3可知,霉心曲塊、霉曲整塊、好曲整塊的淀粉含量依次為34.84 g/100 g、35.66 g/100 g、37.59 g/100 g,好曲整塊的淀粉含量最高。淀粉含量不足會導致轉化成糖分的含量降低,進一步導致酒精產量不足[25]。
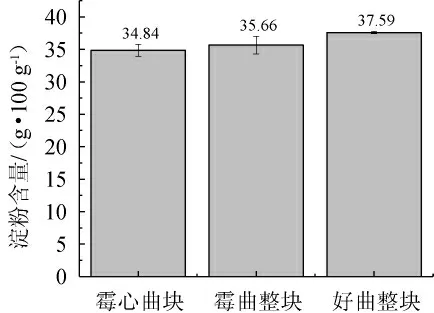
圖3 酒曲淀粉含量比較Fig.3 Comparison of starch contents of Jiuqu
2.2.4 液化力測定
液化酶能夠水解淀粉,產生糊精、低聚糖和單糖,并為后續的發酵過程提供底物。由圖4可知,霉心曲塊、霉曲整塊、好曲整塊的液化力依次為0.168 g(/g·h)、0.216 g(/g·h)、0.259 g(/g·h)。液化力降低會使得酵母產酒精能力下降,無法將糖轉化為乙醇,使得酒精度不足,口感下降[26]。

圖4 酒曲液化力比較Fig.4 Comparison of liquefaction power of Jiuqu
2.2.5 酸度測定
酒曲的酸度大小可以反映出大曲復合曲香物質的強弱程度。由圖5可知,霉心曲塊、霉曲整塊、好曲整塊的酸度依次為0.65 mmol/L、1.12 mmol/L、1.54 mmol/L。其中霉心處的酸度低于特香型大曲酸度的最低值(0.8 mmol/10 g)。有可能是二次生長的霉菌抑制了產酸微生物的產酸代謝,導致其活性下降,產酸性能也隨之下降。
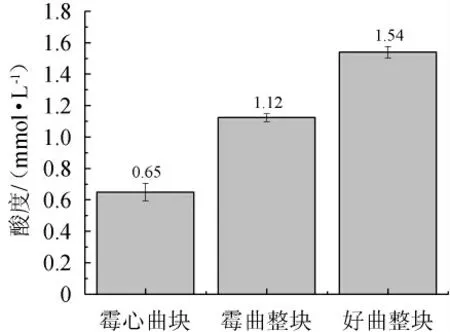
圖5 酒曲酸度比較Fig.5 Comparison of acidity of Jiuqu
2.3 分離霉菌的菌落形態及分子生物學鑒定
由圖6可知,通過微生物菌落形態觀察,菌落絮狀,初為白色或灰白色,后變為灰褐色,菌絲密集且成絮狀,頂端有黑色小點;顯微鏡下菌絲極少分隔,有分枝,無假根及匍匐菌絲。孢子囊較大、球形、頂生內含孢子量多。孢子囊孢子球形、橢圓形。孢囊梗單生、不成束,單軸分枝或假單軸樣分枝,初步判斷該菌為毛霉菌。由表3可知,菌株A3和A4與傘狀毛霉(Lichtheimia corymbifera)(BMU07174)同源性達100%,親緣關系最近,結合形態觀察,鑒定該毛霉為傘狀毛霉(Lichtheimia corymbifera)。
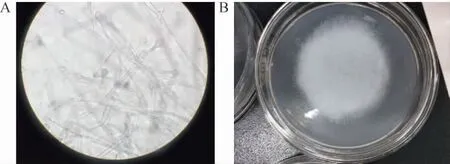
圖6 分離霉菌菌株的菌落形態Fig.6 Colony morphology of isolated mould strains

表3 菌株的同源性比對結果Table 3 Comparison results of homology of strains
2.4 傘狀毛霉對酵母產酒精能力影響
因為酵母在發酵過程中產生CO2和酒精,所以產CO2的量與發酵產乙醇的量具有對應關系,以此判斷酵母產酒精的能力[27-28]。由表4可知,空白實驗和全毛霉發酵的實驗中,培養基中沒有產生氣體。而全酵母實驗中產氣量為最多,達到了5 cm。在混菌發酵中,隨著傘狀毛霉比例的增加,產氣量下降,說明產酒精能力下降;但達到1∶1的接種量比之后,隨傘狀毛霉比例的增加,產氣量維持一定。
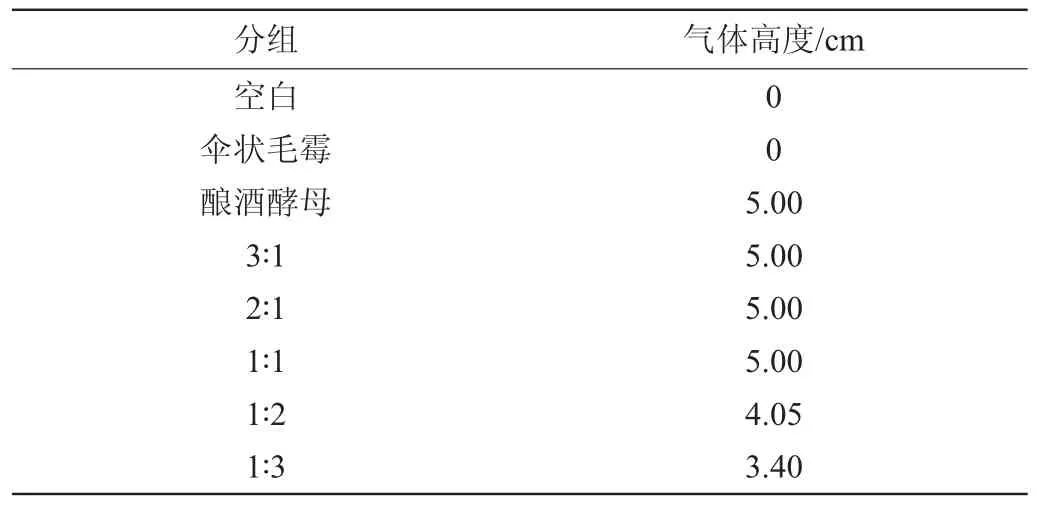
表4 釀酒酵母與傘狀毛霉比例對酵母產酒精能力的影響Table 4 Effect of Saccharomyces cerevisiae and Mucor umbellifera ratio on alcohol production of yeast
2.5 傘狀毛霉的生長特性
2.5.1 pH適應性
由圖7可知,pH值為7的時候霉菌的菌落直徑最大,pH越高霉菌的菌落直徑越小。在pH為12時,霉菌的生長環境最差,生長速率也最慢。pH的適應從強到弱依次為pH7>pH9>pH8>pH6>pH5>pH10>pH11>pH12。雖然pH對毛霉菌落直徑有一定影響,但整體趨勢未發生太大變化,pH的適應范圍較大。說明pH值對霉菌生長的影響在一定范圍內十分有限,所以只需將pH值控制在5~11之間即可。
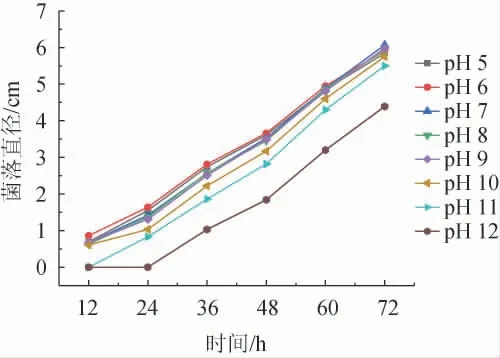
圖7 不同pH對傘狀毛霉生長的影響Fig.7 Effect of pH on the growth of Mucor umbellifera
2.5.2 溫度適應性
由圖8可知,霉菌在35 ℃時的與菌落直徑最大,低于35 ℃或高于40 ℃的生長速率與菌落直徑均有下降趨勢,其最佳生長溫度為35~40 ℃。溫度的適應性從強到弱依次為35 ℃>40 ℃>30 ℃>45 ℃>25 ℃。說明霉菌生長對溫度的要求是比較高的,而且對其生長的影響較大,溫度適應性的分界線也比較明顯。
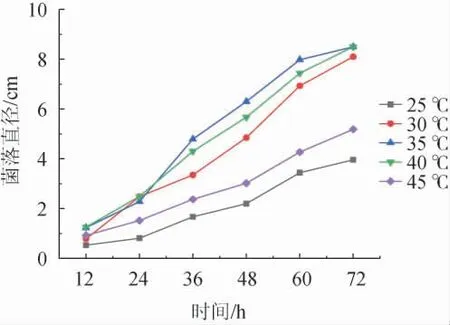
圖8 不同溫度條件對傘狀毛霉生長的影響Fig.8 Effect of different temperature on the growth of Mucor umbellifera
2.5.3 濕度適應性
由圖9可知,相對濕度在80%時霉菌的菌落直徑與生長速率最大。在相對濕度低于70%或高于85%時,霉菌的生長受顯著抑制。相對濕度適應性從強到弱依次為80%>75%>70%>90%>85%>95%。濕度適應性的分界線也比較明顯,且對毛霉有較大的的生長影響。
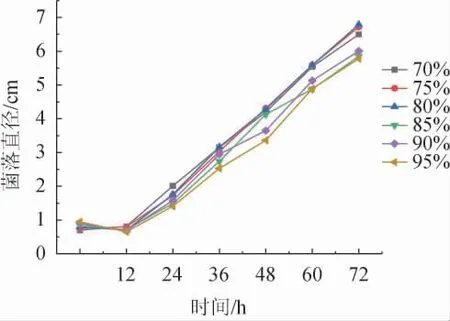
圖9 不同相對濕度對傘狀毛霉生長的影響Fig.9 Effects of different relative humidity on the growth of Mucor umbellifera
3 結論
通過比較不同質量大曲理化指標得知,如果一塊大曲的傘狀毛霉菌出現了二次生長的情況,其糖化力、液化力等重要的釀酒指標均會降低。而這些指標都是環環相扣的,淀粉通過糖化作用轉化為糖分,又通過液化作用產生酒精,每一個環節的能力都弱一些,最后出酒的風味就會大打折扣,使酒的糖度、酒精度、風味都遠低于標準。
通過對儲藏期二次生長霉菌的鑒定,得出特香型大曲儲藏期二次生長的霉菌為傘狀毛霉。傘狀毛霉的生長環境在pH5~10時差距并不明顯,儲藏期大曲的平均水分含量要控制在12.5%,儲藏溫度控制在25 ℃,環境相對濕度不要超過70%為最佳條件。

