環狀RNA同源域相互作用蛋白激酶3促進三陰乳腺癌細胞增殖和遷移的作用機制研究
叢 佳, 石 楊, 劉遠遠
[遼寧省大連市婦女兒童醫療中心(集團), 1. 乳腺科, 2. 生殖實驗室, 3. 病理科, 遼寧 大連, 116033]
三陰乳腺癌(TNBC)占所有乳腺癌發病率的15%~20%, 為雌激素受體(ER)、孕激素受體(PR)和人類表皮生長因子受體2(HER-2)均陰性的乳腺癌類型[1]。因其特殊的分子表型, TNBC對內分泌治療和分子靶向治療不敏感,目前主要的治療方式為手術局部切除和全身化療,但常規術后輔助放化療的療效較差,腫瘤轉移率和復發率均較高,故TNBC已成為最具有治療挑戰性的乳腺癌亞型[2]。環狀RNA(circRNA)是于1970年被發現的一類非編碼RNA, 其沒有5′帽子結構和多聚腺苷酸尾,具有穩定的共價閉環結構,在不同組織和不同發育階段均有表達且發揮著重要的生物學作用[3]。研究[4]顯示, circRNA在人類惡性腫瘤的發生與發展中具有關鍵調控作用。circRNA同源域相互作用蛋白激酶3(circHIPK3)位于染色體區域11p13上,屬致癌因子,可促進胃癌、腎細胞癌和肺癌等多種腫瘤的惡性進展,并調控細胞增殖、遷移、耐藥、自噬和凋亡等腫瘤生物學行為[5-7]。CHEN Z G等[8]報道, circHIPK3在乳腺癌組織中表達上調,并促進乳腺癌細胞的增殖、遷移和侵襲能力,是乳腺癌治療的新型分子靶點,但circHIPK3在預后更差的TNBC中發揮的作用未知。本研究探討circHIPK3在TNBC中發揮的作用及其分子機制,以期為研究circHIPK3能否作為TNBC的潛在治療分子靶點提供重要依據。
1 材料與方法
1.1 材料與試劑
TNBC細胞系HCC1806、MDA-MB-231、HCC-70和人正常乳腺細胞系MCF-10A購自美國ATCC細胞庫; RPMI 1640培養基、胎牛血清、胰酶和青鏈霉素混合液購自美國Hyclone公司; Trizol試劑購自美國Invitrogen公司; RNA提取試劑盒購自北京天根生化科技有限公司; 聚合酶鏈反應(PCR)試劑盒購自德國QIAGEN公司; circHIPK3敲減質粒和circHIPK3過表達質粒購自廣州銳博生物技術有限公司; 細胞增殖實驗(MTS)試劑盒購自美國Biovision公司; Transwell小室購自美國Coring公司; 吉姆薩染色液購自上海碧云天生物有限公司; RIPA裂解液購自北京索萊寶試劑有限公司; BCA蛋白檢測試劑盒購自美國Thermo公司; 聚偏氟乙烯(PVDF)膜、增強型化學發光法(ECL)發光液(100 mL)購自美國Millipore公司; Wnt3a、β-連環蛋白(β-catenin)、原癌基因c-MYC、基質金屬蛋白酶2(MMP-2)蛋白抗體和甘油醛-3-磷酸脫氫酶(GAPDH)抗體購自英國Abcam公司。
1.2 方法
1.2.1 細胞培養: 將TNBC細胞系HCC1806、MDA-MB-231、HCC-70和人正常乳腺細胞系MCF-10A從液氮中取出立即放置于37 ℃水浴鍋中,解凍后800轉/min離心5 min, 去除凍存液后加入RPMI 1640細胞培養基,并加入10%的胎牛血清和5%的青鏈霉素混合液,放置于含5%CO2的37 ℃全濕度細胞孵育箱中培養。每隔1 d更換1次培養基,采用胰酶消化法進行細胞傳代。
1.2.2 實時熒光定量PCR(qRT-PCR)檢測circHIPK3表達: 胰酶消化后收集待檢測細胞,用磷酸鹽緩沖液(PBS)洗滌3次后加入TRIzol試劑裂解細胞。采用RNA提取試劑盒提取裂解細胞中的總RNA。檢測RNA的純度及濃度后,采用一步法逆轉錄聚合酶鏈反應(RT-PCR)試劑盒配制反應體系進行qRT-PCR擴增。配制反應試劑, 5× QIAGEN一步法RT-PCR緩沖液10 μL、dNTP混合物2 μL、QIAGEN一步法RT-PCR酶混合物2 μL、上下游引物各1 μL、RNA 1 μg, 加無RNA酶水補足至50 μL。反應條件為逆轉錄50 ℃ 30 min、預變性95 ℃ 15 min, 變性94 ℃ 30 s, 退火56 ℃ 60 s, 延伸72 ℃ 60 s, 變性、退火、延伸設置40個循環,終延伸72 ℃ 10 min。每個circHIPK3檢測樣品設置3個平行樣,根據內參基因GAPDH將數據進行歸一化,采用2-△△Ct公式計算circHIPK3的相對表達水平。circHIPK3引物序列為5′-TATGTTGGTGGATCCTGTTCGGCA-3′(正向)和5′-TGGTGGGTAGACCAAGACTTGTGA-3′(反向),GAPDH引物序列為5′-GAAGGTGAAGGTCGGAGTC-3′(正向)和5′-GAAGATGGTGATGGGATTTC-5′(反向)。
1.2.3 細胞轉染: 選擇生長狀態較好的MDA-MB-231細胞和HCC-70細胞,用胰酶消化后進行細胞計數,按1×105個細胞/孔接種至6孔板中。將MDA-MB-231細胞分為sh-NC組和sh-circHIPK3組,將HCC-70細胞分為oe-NC組和oe-circHIPK3組。采用Lip2000對各組細胞進行轉染, sh-NC組細胞轉染NC敲減質粒, sh-circHIPK3組細胞轉染circHIPK3敲減質粒, oe-NC組細胞轉染NC過表達質粒, oe-circHIPK3組轉染circHIPK3過表達質粒。將各組細胞置于含5%CO2的37 ℃全濕度細胞孵育箱中培養。轉染48 h后,采用qRT-PCR法檢測各組細胞中circHIPK3表達量,觀察circHIPK3敲減質粒、circHIPK3過表達質粒的轉染效果。
1.2.4 MTS檢測細胞增殖活性: 轉染各組細胞,胰酶消化后進行細胞計數,按1 500個細胞/孔接種至96孔板中,每組設置6個平行樣,并設置0、24、48、72 h共4個時點,將細胞放置在含有5%CO2的37 ℃全濕度細胞孵育箱中培養。在不同時點,將每個樣品更換100 μL的新鮮培養基,并加入20 μL的MTS檢測試劑,于細胞孵育箱中繼續培養2 h后,采用酶標儀檢測各樣品在490 nm處的光密度(OD)值, OD值越大表示細胞增殖活性越強。
1.2.5 Transwell實驗檢測細胞遷移: 轉染各組細胞,胰酶消化,以無血清培養基洗3次后進行細胞計數,采用無血清培養基調整細胞濃度至1×106個/mL, 吸取100 μL細胞懸液至Transwell小室的上室膜中,將Transwell小室的上室放至含500 μL 10%血清培養基的Transwell小室的下室,每組設置3個平行樣,放置于含5%CO2的37 ℃全濕度細胞孵育箱中培養。培養12 h后,將Transwell小室的上室膜用PBS洗3次后放入甲醇中固定10 min,于吉姆薩染色液中染色20 min。PBS洗3次后,于顯微鏡下計數各組細胞穿膜數目。
1.2.6 TOP/FOP Flash雙熒光素酶活性檢測: 轉染各組細胞,胰酶消化后進行細胞計數,按1 500個細胞/孔接種至96孔板中,每組設置6個平行樣,將TOP Flash質粒、FOP Flash質粒分別轉染到各組細胞中,放置于含5%CO2的37 ℃全濕度細胞孵育箱中培養。共轉染48 h后,使用雙熒光素酶報告基因檢測試劑盒檢測各組細胞的熒光素酶活性。
1.2.7 蛋白質印跡法(Western blotting)檢測Wnt/β-catenin信號通路蛋白表達: 胰酶消化后,收集待檢測細胞,用PBS洗3次后加入蛋白裂解液裂解細胞。將細胞裂解液4 ℃高速離心30 min去除細胞碎片后,收集蛋白裂解液,采用聚氰基丙烯酸正丁酯(BCA)檢測蛋白濃度。于蛋白裂解液中加入上樣緩沖液,煮沸3 min使蛋白變性。將蛋白樣品加至十二烷基硫酸鈉-聚丙烯酰胺凝膠中,采用80 V電壓電泳100 min分離蛋白,采用100 V電壓濕轉120 min轉移蛋白至PVDF膜上。將PVDF膜與封閉液常溫孵育1 h后,用TBST洗3次,加入待檢測蛋白一抗稀釋液(Wnt3a、β-catenin、c-MYC、MMP-2一抗稀釋液的稀釋比例均為1∶500, GAPDH一抗稀釋液為1∶500)于4 ℃孵育過夜, TBST洗3次,加入相對應的兔、鼠二抗稀釋液(1∶8 000)室溫孵育1 h, 用ECL試劑盒顯示蛋白條帶。采用ImageJ軟件分析蛋白的相對表達量。
1.3 統計學分析
2 結 果
2.1 circHIPK3在不同細胞系中的表達水平
circHIPK3在TNBC細胞系HCC1806、MDA-MB-231、HCC-70中的相對表達量分別為(4.06±0.81)、(5.78±0.56)、(2.33±0.84), 在人正常乳腺細胞系MCF-10A中的相對表達量為(1.06±0.10)。與正常乳腺細胞系MCF-10A相比, circHIPK3在3種TNBC細胞中的表達水平均升高,差異有統計學意義(F=30.110,P<0.001)。3種TNBC細胞中, MDA-MB-231細胞circHIPK3表達水平最高, HCC-70細胞表達水平最低,與HCC1806細胞比較,差異有統計學意義(t=3.025、2.568,P=0.029、0.048)。見圖1。

與MCF-10A細胞比較, **P<0.001。圖1 circHIPK3在TNBC細胞系和人正常乳腺細胞系中的表達
2.2 circHIPK3敲減質粒、過表達質粒的轉染效果
選擇circHIPK3表達量最高的TNBC細胞系MDA-MB-231進行circHIPK3 敲減質粒轉染實驗, qRT-PCR結果顯示, circHIPK3在sh-circHIPK3組中的相對表達量為(0.36±0.06), 低于sh-NC組的(0.98±0.03), 差異有統計學意義(t=16.008,P<0.001), 見圖2A。選擇circHIPK3表達量最低的 TNBC細胞系HCC-70進行circHIPK3 過表達質粒轉染實驗, qRT-PCR結果顯示, circHIPK3在oe-circHIPK3組中的相對表達量為(6.29±0.71), 高于oe-NC組的(0.99±0.05), 差異有統計學意義(t=12.897,P<0.001), 見圖2B。


A: circHIPK3敲減質粒對MDA-MB-231細胞的轉染效果(與sh-NC組比較, **P<0.001);B: circHIPK3過表達質粒對HCC-70細胞的轉染效果(與oe-NC組比較, **P<0.001)。圖2 circHIPK3敲減質粒、過表達質粒對TNBC細胞系的轉染效果
2.3 circHIPK3對TNBC細胞增殖活性的影響
MTS結果顯示,與sh-NC組相比, sh-circHIPK3組MDA-MB-231細胞24、48、72 h時的增殖活性降低,差異有統計學意義(P<0.05); 與oe-NC組相比, oe-circHIPK3組HCC-70細胞24、48、72 h時的增殖活性增強,差異有統計學意義(P<0.05)。見圖3、表1。


A: 敲減circHIPK3表達對MDA-MB-231細胞增殖活性的影響(與sh-NC組比較, *P<0.05);B: 過表達circHIPK3對HCC-70細胞增殖活性的影響(與oe-NC組比較, *P<0.05)。圖3 circHIPK3對TNBC細胞增殖活性的影響

表1 各組細胞不同時點的光密度值比較
2.4 circHIPK3對TNBC細胞遷移能力的影響
Transwell實驗結果顯示, sh-circHIPK3組MDA-MB-231細胞穿膜細胞數目為(14.67±7.08)個,少于sh-NC組的(35.33±9.25)個,差異有統計學意義(t=4.344,P=0.001), 即sh-circHIPK3組細胞遷移能力降低,見圖4A。oe-circHIPK3組HCC-70細胞穿膜細胞數目為(82.33±11.51)個,多于oe-NC組的(30.67±10.32)個,差異有統計學意義(t=8.186,P<0.001), 即oe-circHIPK3組HCC-70細胞遷移能力提高,見圖4B。

A: 敲減circHIPK3表達對MDA-MB-231細胞遷移能力的影響; B: 過表達circHIPK3對HCC-70細胞遷移能力的影響。圖4 各組TNBC細胞遷移能力的Transwell實驗結果(吉姆薩染色,放大200倍)
2.5 circHIPK3對TNBC細胞Wnt/β-catenin信號通路活性的影響
TOP/FOP Flash雙熒光素酶活性檢測結果顯示, sh-circHIPK3組MDA-MB-231細胞熒光素酶相對活性為(0.56±0.08), 低于sh-NC組的(1.00±0.05), 差異有統計學意義(t=11.424,P<0.001), 即sh-circHIPK3組MDA-MB-231細胞Wnt/β-catenin信號通路活性降低,見圖5A; oe-circHIPK3組HCC-70細胞熒光素酶相對活性為(3.83±0.55), 高于oe-NC組的(1.00±0.04), 差異有統計學意義(t=12.571,P<0.001), 即oe-circHIPK3組HCC-70細胞Wnt/β-catenin信號通路活性增加,見圖5B。
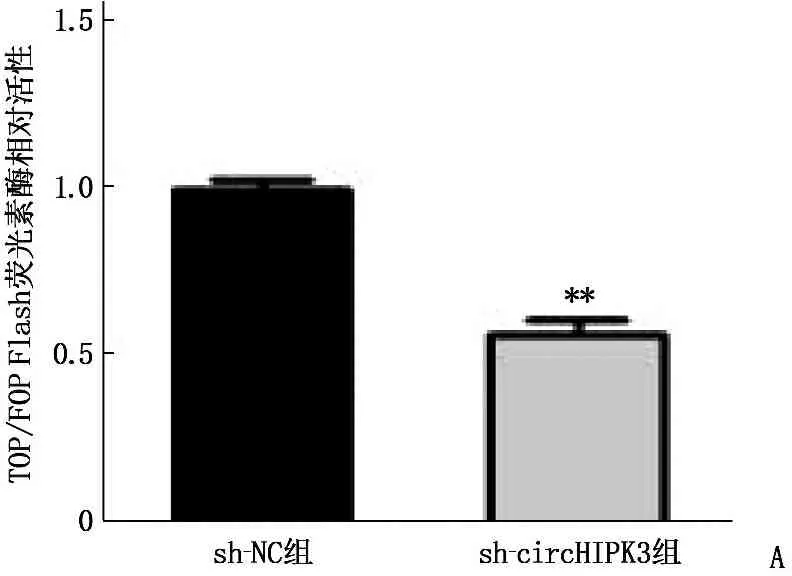

A: 敲減circHIPK3表達對MDA-MB-231細胞Wnt/β-catenin信號通路的影響(與sh-NC組比較, **P<0.001);B: 過表達circHIPK3對HCC-70細胞Wnt/β-catenin信號通路的影響(與oe-NC組比較, **P<0.001)。圖5 circHIPK3對TNBC細胞Wnt/β-catenin信號通路活性的影響
2.6 circHIPK3對TNBC細胞Wnt/β-catenin信號通路相關蛋白表達的影響
Western blotting實驗結果顯示,與sh-NC組比較, sh-circHIPK3組MDA-MB-231細胞Wnt/β-catenin信號通路相關蛋白Wnt3a、β-catenin、c-MYC、MMP-2表達降低,差異有統計學意義(P<0.05); 與oe-NC組比較, oe-circHIPK3組HCC-70細胞Wnt/β-catenin信號通路相關蛋白Wnt3a、β-catenin、c-MYC、MMP-2表達增加,差異有統計學意義(P<0.05)。見圖6、表2。


A: 敲減circHIPK3表達對MDA-MB-231細胞Wnt/β-catenin信號通路相關蛋白的影響;B: 過表達circHIPK3對HCC-70細胞Wnt/β-catenin信號通路相關蛋白的影響。圖6 circHIPK3對TNBC細胞Wnt/β-catenin信號通路相關蛋白表達的影響

表2 各組細胞Wnt/β-catenin信號通路相關蛋白表達情況
3 討 論
乳腺癌是臨床常見的惡性腫瘤,近年來發病率呈現持續上升趨勢。根據ER、PR、增殖指數Ki-67和HER-2等分子特征,乳腺癌可分為Lumina A、Lumina B、HER-2過表達和基底樣癌等不同類型,與ER陽性、PR陽性和HER2陽性的乳腺癌相比, TNBC具有發病年齡較早、侵襲性強和預后不良的特性[2]。與其他亞型乳腺癌不同的是, TNBC仍然缺乏有效的分子靶向治療方法,但熱療、光動力療法以及基于納米醫學、微小RNA(miRNA)、小干擾RNA(siRNA)和適體的靶向治療等一系列新型療法增加了TNBC患者的治療機會[9]。TNBC的發病機制目前尚未完全闡明,研究TNBC惡性進展過程中發揮重要作用的分子,對于探索更有效的分子靶點進而改善TNBC患者的生存質量至關重要。
circRNA屬于非編碼RNA, 密切參與增殖、侵襲和遷移等腫瘤病理過程[3-4]。circHIPK3又名hsa_circ_0000284, 由HIPK3基因的第2個大外顯子(1 099 nt)組成(HIPK3基因是酵母基因YAK1的人類蛋白激酶同源物,從多藥耐藥細胞系KB-V1中克隆), circHIPK3主要定位于細胞質中,廣泛表達于各個組織內,其中大腦和小腦中的表達最為豐富[10]。相關研究[11]發現, circHIPK3在多種腫瘤的發生和發展中發揮著至關重要的作用,并且可能成為一種有潛力的腫瘤診斷生物標志物或治療靶點。circHIPK3在胃癌組織和細胞系中的表達顯著上調,并與胃癌患者的總生存率呈負相關,沉默circHIPK3的表達可減弱胃癌細胞的增殖和遷移能力[5]。circHIPK3在腎細胞癌組織和細胞中過表達,敲減circHIPK3能夠抑制腫瘤細胞的增殖、遷移和侵襲能力[6]。CHEN Z G等[8]報道,乳腺癌組織中circHIPK3表達上調預示乳腺癌患者預后較差, circHIPK3在體內和體外均可促進乳腺癌細胞增殖、遷移和侵襲能力。為了明確circHIPK3是否在TNBC中發揮重要功能,本研究檢測了circHIPK3在TNBC細胞系中的表達水平,發現circHIPK3在3種TNBC細胞系中的表達水平均顯著高于人正常乳腺細胞系MCF-10A, 提示circHIPK3在TNBC中同樣發揮促癌作用。本研究選用circHIPK3高表達的TNBC細胞系MDA-MB-231轉染circHIPK3敲減質粒,選用circHIPK3低表達的TNBC細胞系HCC-70轉染circHIPK3過表達質粒,發現敲減circHIPK3表達可抑制TNBC細胞的增殖和遷移能力,過表達circHIPK3可促進TNBC細胞的增殖和遷移能力,表明circHIPK3在TNBC的惡性進展中發揮促癌作用,與其他腫瘤疾病研究[5-7]中circHIPK3的作用一致。
既往研究[7]顯示, circHIPK3在肺癌中可以通過激活蛋白激酶B/哺乳動物雷帕霉素靶蛋白(AKT/mTOR)信號通路促進肺癌進展; circHIPK3在食管鱗癌細胞中通過調控p53-Akt-Mdm2信號通路促進腫瘤細胞增殖、遷移和侵襲,誘導細胞凋亡[12]; circCHIPK3過表達通過調控HMGB1/PI3K/AKT信號通路促進乳腺癌細胞惡性進展[8]; circHIPK3通過激活Wnt/β-catenin信號通路促進胃癌細胞增殖與轉移[5]。由此提示, AKT/mTOR、p53-Akt-Mdm2、PI3K/AKT和Wnt/β-catenin信號通路均密切參與腫瘤增殖、遷移等惡性生物學行為。Wnt/β-catenin在TNBC中處于激活狀態,失活后可抑制TNBC細胞惡性行為,可作為TNBC治療的潛在靶點[13]。本研究采用TOP/FOP Flash雙熒光素酶報告基因檢測circHIPK3對TNBC細胞中Wnt/β-catenin信號通路活性的影響,發現敲減circHIPK3表達會降低Wnt/β-catenin信號通路活性,而過表達circHIPK3會增強Wnt/β-catenin信號通路活性。Wnt/β-catenin信號通路激活的經典途徑為在Wnt配體的存在下促使β-catenin積累并入核, β-catenin入核后激活其下游靶基因的表達[14]。作為Wnt配體之一, Wnt3a在TNBC中高表達,參與Wnt/β-catenin信號通路促進TNBC的進展[15]。相關研究[16]顯示, Wnt/β-catenin下游靶基因增殖相關蛋白c-MYC和遷移相關蛋白MMP-2同樣在TNBC中發揮促癌作用。本研究Western blotting檢測結果顯示,敲減circHIPK3表達會抑制TNBC細胞中Wnt3a、β-catenin、c-MYC和MMP-2蛋白的表達,過表達circHIPK3會促進Wnt3a、β-catenin、c-MYC和MMP-2蛋白的表達。由此表明,circHIPK3通過激活Wnt/β-catenin信號通路促進TNBC細胞的增殖與遷移。
綜上所述, circHIPK3在TNBC細胞系中表達上調,通過調控Wnt/β-catenin信號通路促進TNBC細胞增殖和遷移,故circHIPK3可能是TNBC治療的潛在分子靶點。

