2018-2020 年耐碳青霉烯類鮑曼不動桿菌臨床分布及耐藥性分析
楊海剛
(貴陽市第二人民醫院,貴州 貴陽 550000)
0 引言
鮑曼不動桿菌(ABA)是不動桿菌屬中氧化酶試驗陰性,不能運動,生存能力很強的常見的條件致病菌[1],主要引起危重病人呼吸機相關性肺炎[2]和血流感染[3]。容易從外界獲得耐藥基因,在醫院中醫務工作者和病人等極易感染該菌。鮑曼不動桿菌的耐藥機制復雜,是其對臨床常用抗菌藥物耐藥廣泛的原因,臨床醫生在對該菌引起感染的患者進行治療時往往療效欠佳, 是臨床治療面臨的棘手問題[4-6],因此該菌被專家和學者們比作21 世紀革蘭陰性桿菌中的“耐甲氧西林金黃色葡萄球菌(MRSA)”[7]。現就2018-2020 年我院各臨床科室住院患者不同微生物培養標本中分離的鮑曼不動桿菌藥物敏感情況及其臨床科室分布情況進行統計分析,以便臨床醫生在為患進行治療時選擇抗菌有效的抗菌藥物提供依據,從而有效避免經驗用藥影響患者的治療和預后,統計分析情況具體如下。
1 材料與方法
1.1 菌株來源
從2018-2020 年我院各臨床科室送檢的不同微生物培養標本中,經統計統一患者鮑曼不動桿菌第一次分離株,共計903 株,耐碳青霉烯類鮑曼不動桿菌(CRAB)580 株,占比64.23%。
1.2 質控菌株
質控菌株為銅綠假單胞菌ATCC 27853、大腸埃希菌ATCC 25922。
1.3 儀器
MicroScan WalkAway-96plus 全自動微生物鑒定系統和藥敏分析儀系統。
1.4 細菌鑒定和藥敏試驗
各臨床科室送檢的微生物培養標本均嚴格依據不同標本操作作業指導書進行分離培養,通過對可疑分離株進行鑒定及藥敏分析,其藥敏試驗結果按2020 年版美國臨床和實驗室標準協會(CLSI)的標準進行解釋與報告。
1.5 數據分析
采用WHONET5.6 專用統計分析軟件統計分析。
2 結果
2.1 耐碳青霉烯類鮑曼不動桿菌的檢出情況和在臨床科室分布情況
我院2018-2020 年間檢出鮑曼不動桿菌903株,其中2018 年檢出365 株,2019 年檢出300 株,2020 年檢出238 株。分別占同年分離株的比例13.18%,11.22%,10.94%,2018 年度占比一度超過肺炎克雷伯菌,排所有分離株第二;大腸埃希菌占比16.64%,17.47%,18.64% 和肺炎克雷伯菌占比13.14%,14.55%,15.91%,2018-2020 年鮑曼不動桿菌(ABA)的臨床分布情況見表1。
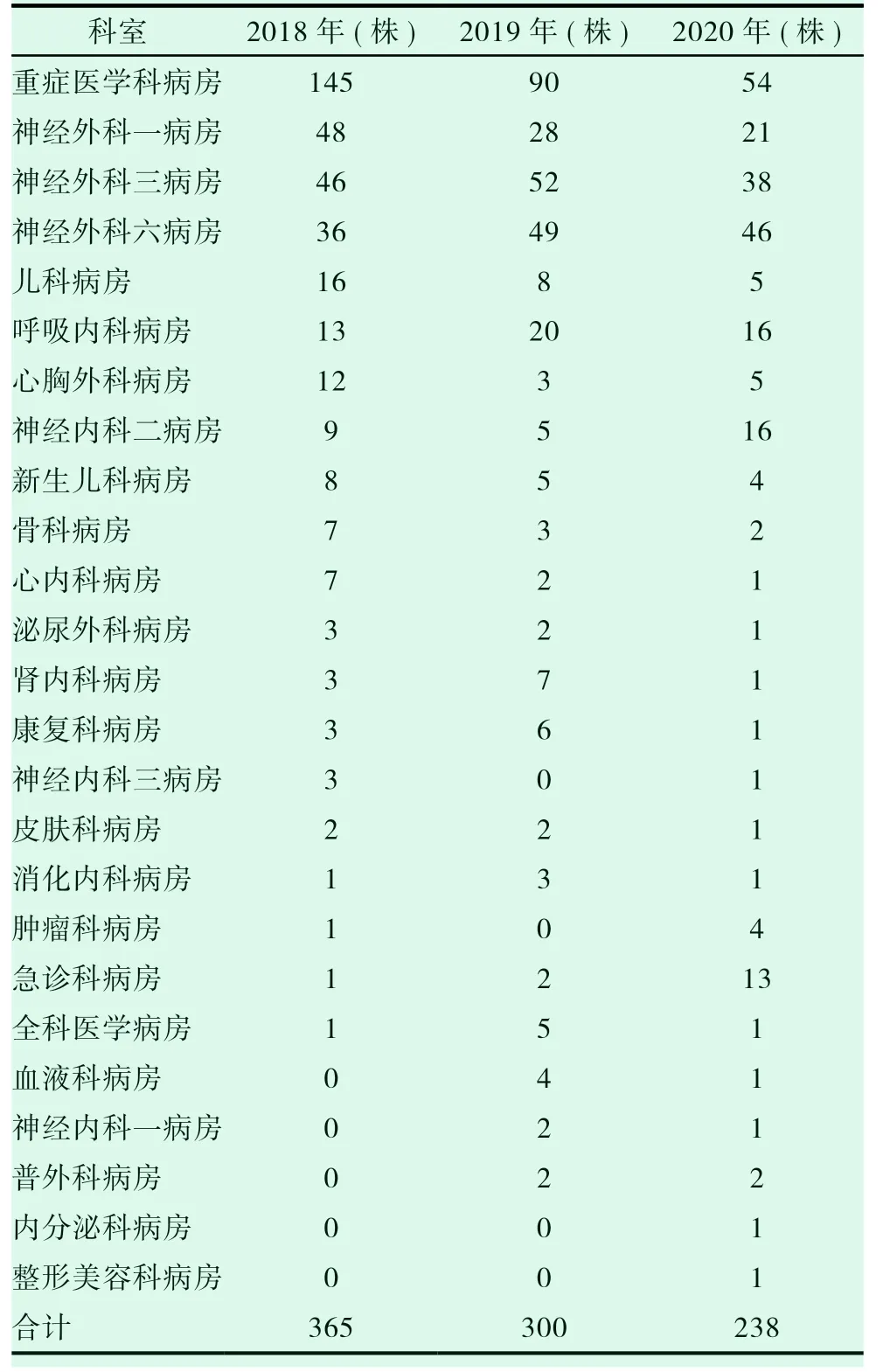
表1 鮑曼不動桿菌(ABA)在臨床各科室分布情況(株)
2.2 鮑曼不動桿菌藥敏結果
2018-2020 這三年來發現,我院該菌第三代頭孢菌素頭孢他啶,第四代頭孢菌素頭孢吡肟,喹諾酮類抗菌藥物環丙沙星及氨基糖苷類慶大霉素等抗菌藥物的耐藥率普遍較高,三年平均耐藥率分別為69.7%、68.2%、68.5%、64.6%。年度耐藥率頭孢曲松耐藥率最高,2020 年最高達到了73.5%,總體分析的具體耐藥情況及科室分布情況見表2、表3。
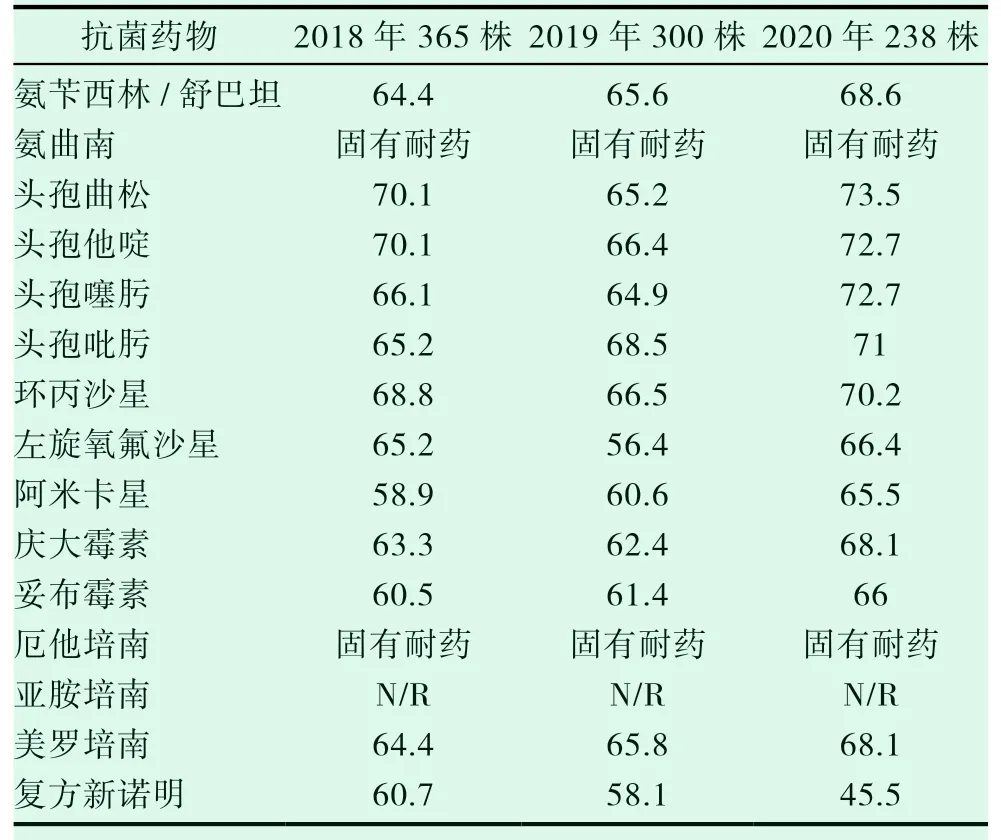
表2 2018-2020 年我院鮑曼不動桿菌(ABA)耐藥率(%)
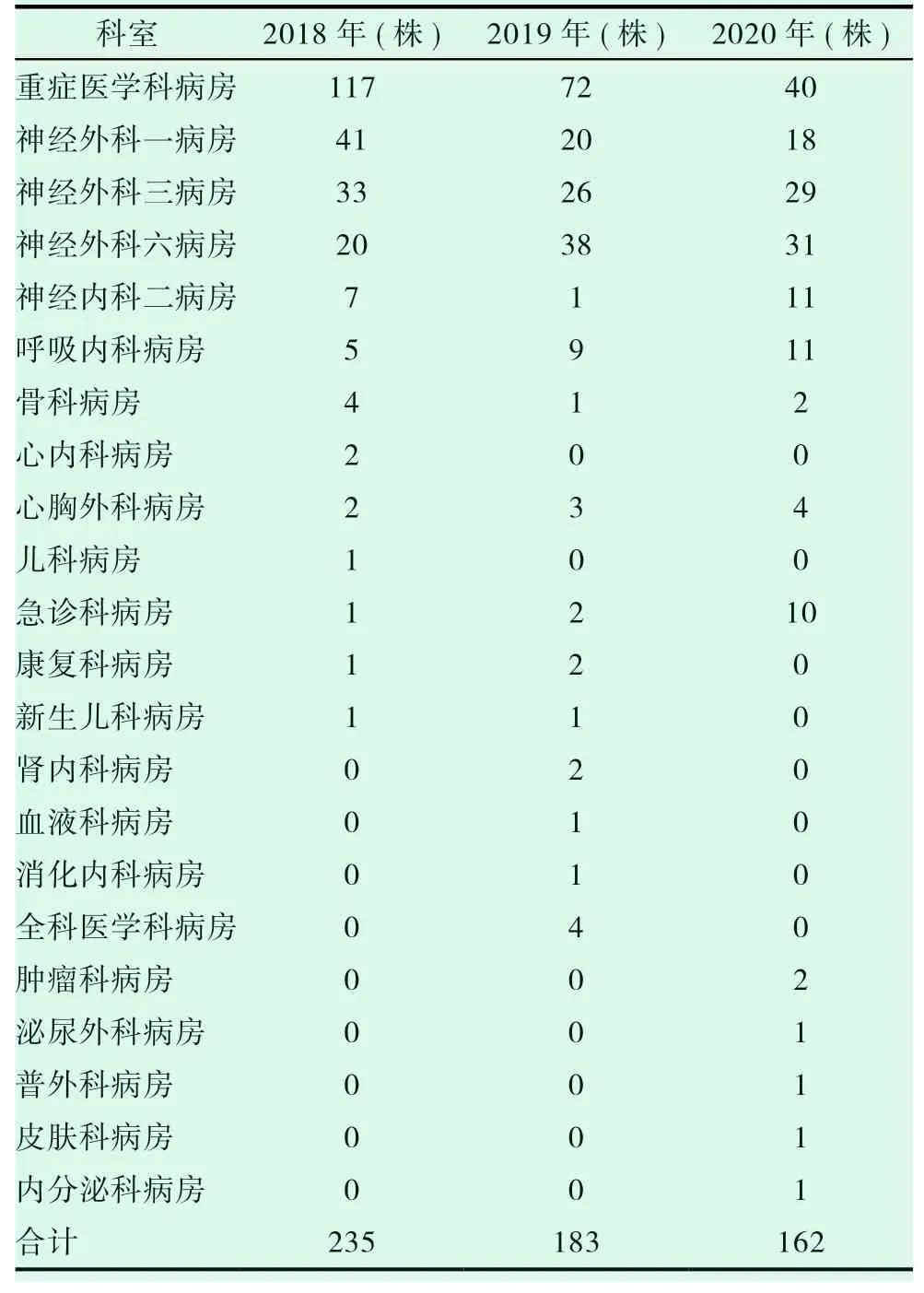
表3 2018-2020 年我院耐碳青霉烯類鮑曼不動桿菌(CRAB)科室分布情況
3 討論
在生活中,鮑曼不動桿菌幾乎無處不在。在人的呼吸道內,泌尿道等處都有它的身影。在醫院中更是常見,其生存能力、獨立獲得外源基因的能力很強。鮑曼不動桿菌是一種可引起肺炎、腦膜炎及泌尿道等感染的非發酵革蘭陰性桿菌,也是當前院內感染的主要原因之一[8-10]。耐碳青霉烯類鮑曼不動桿菌為醫院獲得性感染與社區獲得感染中的常見致病菌,分布上前者較多,其也是院內感染致病菌中的常見菌,有文獻表明耐碳青霉烯類鮑曼不動桿菌感染[11-12]多因呼吸道感染所致。結合國外相關研究數據顯示,鮑曼不動桿菌在眾多的醫院感染菌中所占地位一直居高不下,在美國醫院中占據第四位,前三位分別是大腸埃希菌、肺炎克雷伯菌及銅綠假單胞菌[13]。而在本院檢測結果中發現該菌檢出率卻超過了銅綠假單胞菌,僅低于大腸埃希菌和肺炎克雷伯菌。因此全院上下各醫務工作者均高度重視該問題。由表1 可顯示,2018-2020 年,我院耐碳青霉烯類鮑曼不動桿菌與鮑曼不動桿菌分離株的占比分別是64.4%、61.0%、68.1%;其具體分布見表3,不難發現分布上以外科系統科室分離較多,其中重癥醫學科病房因此患者可能系全院各科室重癥患者的集中收治科室,因此其分離株也絕對較多,該結果與田興華,陳毅紅結果一致[14-15]。內科系統科室中,以呼吸內科病房、神經內科二病房及急診科病房分離較多,其原因在于神經內科二病房是我院神經系統疾病中較危重患者就診科室,呼吸內科病房與急診科病房收治患者疾病較為復雜多樣;同時可能系部分神經外科病房和重癥醫學科病房的患者當病情嚴重時做侵入性操作以輔助治療所致;其次,可能患者本身的某些疾病所導致的免疫力降低,反復住院和長時間使用各類抗菌藥物等也會使重癥醫學科病房和神經外科病房檢出率較高的原因。表示3 同時顯示,其余科室如心內科病房、腎內科病房、內分泌科病房、腫瘤科病房及骨科病房等分離的鮑曼不動桿菌相對較少,其可能原因是我院為腦科專科醫院,就診于我院以上科室的患者病情較輕,住院時間較短和醫院感染預防得當等綜合情況有關。即便如此,重癥醫學科病房、神經外科一、神經外科三、神經外科六病房和重癥醫學科病房耐碳青霉烯類鮑曼不動桿菌(CRAB)檢出率仍居高不下,因此在醫院感染預防中,應格外加強以上耐碳青霉烯類鮑曼不動桿菌(CRAB)高檢出病房的監測,并不定期到相關科室檢查消毒和隔離等措施的執行情況,并對不合適的進行規范指導,盡可能減小鮑曼不動桿菌在醫院的爆發和流行。
表2顯示,2018-2020 年我院檢出的鮑曼不動桿菌表現出多重耐藥的現象,對常見的抗生素耐藥率在45.5%以上。我院鮑曼不動桿菌對第三代頭孢菌素頭孢他啶,第四代頭孢菌素頭孢吡肟,喹諾酮類抗菌藥物環丙沙星及氨基糖苷類慶大霉素等抗菌藥物的耐藥率普遍較高,三年平均耐藥率分別 為69.7%、68.2%、68.5%、64.6%。2018-2020 年連續三年耐藥率高居不下,因此強烈建議臨床醫生在選擇抗生素在對該菌感染的患者進行治療時,應盡量選擇耐藥性比較低的,不容易產生高耐藥菌株情況的抗生素,必要時采取聯合用藥。這樣,第一能高效地對患者進行治療,第二能減少高耐藥菌株的產生。由于我院儀器原因致亞胺培南結果不可靠,故無測試結果。因此在判定是否為耐碳青霉烯類鮑曼不動桿菌是通過判斷其對美羅培南的敏感性來確定其是否為耐藥菌株。表2 顯示2018-2020 年鮑曼不動桿菌對美羅培南的耐藥率依次為64.4%、61.0%、68.1%,針對鮑曼不動桿菌耐碳青霉烯類抗生素的情況,我院采取增加頭孢哌酮/舒巴坦紙片法的藥敏試驗,或通過儀器法增加粘菌素檢測,其結果的判斷標準參照當年或上一年CLSI。鮑曼不動桿菌的耐藥情況較復雜,能產生多種β-內酰胺酶,從而對碳青霉烯類藥物產生耐藥,其耐藥機制往往是:產生碳青霉烯酶,水解碳青霉烯類藥物的β-內酰胺酶、膜孔道蛋白丟失、藥物外排泵的表達過度和青霉素結合蛋白改變等等[16]。有資料顯示,該菌可產生修飾酶對氨基糖苷類抗菌藥物產生耐藥,同時還能對環丙沙星、左氧氟沙星等喹諾酮類抗菌藥物產生耐藥。鮑曼不動桿菌能作為耐藥宿主將耐藥基因傳遞給其他細菌,也能接受其他細菌的耐藥基因,所以該菌易產生耐藥菌株[17]。大量臨床數據研究表明,當鮑曼不動桿菌對碳青霉烯類抗菌藥物耐藥率很高時,那么該菌很有可能發展為多重耐藥菌株或泛耐藥菌株,可以選擇的抗菌藥物也會極為有限[18]。此外,大量使用碳青霉烯類藥物是產生多重耐藥鮑曼不動桿菌的因素[19]。綜上所述,鮑曼不動桿菌在這三年間對碳青霉烯類抗菌藥物如美羅培南的耐藥率相對偏高,所以臨床醫生在對患者選用碳青霉烯類抗菌藥物進行治療時應謹慎。
研究發現,抗菌藥物的選擇與使用不當,是導致多重耐藥菌出現的常見原因,特別是耐碳青霉烯類鮑曼不動桿菌的大量出現,且耐藥菌株的頻率仍在加速上升,讓臨床醫生在治療上很是棘手,為達到治療效果必要時需選擇多種有活性的抗菌藥物聯合治療。當然,細菌的耐藥情況也存在地區性差異,此次統計分析對我院鮑曼不動桿菌的分布和耐藥性有了一定認識,統計結果顯示,近三年來耐碳青霉烯類藥物鮑曼不動桿菌的耐藥率存在不斷上升的趨勢,鮑曼不動桿菌的耐藥現狀尤為突出,特別是耐碳青霉烯類鮑曼不動桿菌不斷增多的現狀值得全院醫護人員深思。全院醫護人員需立即行動起來,共同為遏制細菌耐藥國家行動計劃貢獻自己綿薄力量。各級臨床醫生在規范抗菌藥物合理選擇與使用的同時,針對細菌耐藥問題我院醫院感染管理科已采取分工協助方式對各臨床科室進行網格化管理,專人負責對相關科室進行感染預防管理,進行手衛生跟蹤督導,提高手衛生依從性。大量文獻報道,良好的手衛生依從性是減少醫院感染最便捷和有效的手段,為此,全院醫務工作者應養成良好的手衛生意識,主動加強手衛生,以減少多重耐藥菌株,特別是耐碳青霉烯類藥物鮑曼不動桿菌的產生。

