凍融胚胎過夜培養后移植患者妊娠情況分析
王曉婷,陳宥藝,韓曉艷,張 祥,閆春芳
(西安市第四醫院生殖醫學中心,陜西 西安 710004)
對于新鮮取卵周期未移植行全胚冷凍,或移植后未孕仍有剩余凍存胚胎的患者,凍融胚胎移植(frozen-thawed embryo transfer,FET)是一個有效的臨床策略。它具有凍融移植周期子宮內膜容受好、能有效預防卵巢過度刺激綜合征、降低治療成本并能增加累計臨床妊娠率等優勢。雖然影響凍融胚胎移植妊娠率的因素很多,但是凍融胚胎的質量及繼續發育潛能無疑是最重要的影響因素之一。本研究回顧性分析了西安市第四醫院536例凍融胚胎移植周期,旨在探索凍融胚胎過夜培養后卵裂球增長與否及繼續發育的情況對臨床妊娠結局的影響,并為需要進行單胚胎移植的患者,提供最佳的胚胎選擇方案。
1資料與方法
1.1患者資料
收集2018年1月至2019年3月在西安市第四醫院進行凍融胚胎移植患者的536個周期的臨床資料。研究對象的納入標準:①女方因盆腔輸卵管、排卵障礙、子宮內膜異位癥、不明原因等因素,男方因少弱畸形精子癥或無精子癥等因素進入常規體外受精與胚胎移植(in vitro fertilization,IVF)或卵胞漿內單精子顯微注射(intracytoplasmic sperm injection,ICSI)周期;②所有患者的解凍胚胎均是胚齡為第3天卵裂期的冷凍胚胎、過夜培養后移植2枚胚胎的凍融移植周期。排除標準:①患者有明確影響胚胎著床的因素,包括子宮畸形、輸卵管積水、子宮腺肌癥等;②夫婦一方染色體核型異常;③女方有未控制至正常的糖尿病、結核、甲亢,以及其他自身免疫系統疾病者。
1.2方法
1.2.1內膜準備
所有患者均于月經周期第2~4天行陰道超聲及基礎性激素檢查,根據既往月經周期、基礎疾病及患者的意愿,采用自然周期、促排卵周期、人工周期或降調節+人工周期方案行移植前的內膜準備,子宮內膜厚度≥7mm作為凍融胚胎移植的標準。
1.2.2解凍胚胎
所有納入研究對象的胚胎均為常規IVF或ICSI受精、體外培養、采用玻璃化冷凍保存的第3天卵裂期胚胎。所有胚胎均采用玻璃化冷凍方法冷凍,冷凍前根據卵裂球個數、均勻程度及碎片情況對胚胎進行分級[1],冷凍胚胎均評級為Ⅰ~Ⅲ級。使用玻璃化解凍試劑盒(日本加藤公司)對第3天卵裂期胚胎進行解凍復蘇。試劑盒包括解凍液TS、稀釋液DS、沖洗液WS1和WS2,解凍過程:將胚胎從液氮中取出,迅速置于37℃的TS液中,1min后將其依次轉移至DS、WS1、WS2中分別放置3min、5min、5min。最后轉移至預先平衡好的37℃胚胎培養液G2 PLUS(瑞典vitrolife公司),置于37℃、6%CO2、5%O2的培養箱中繼續培養18~20h。
1.2.3解凍胚胎存活標準
解凍后胚胎有半數及以上卵裂球存活視為存活胚胎[2]。
1.2.4分組方法
依照移植的2枚胚胎過夜培養后(18~20h)卵裂球增長與否分為3個大組:A2組(n=425),有2枚胚胎均有卵裂球增長;A1組(n=89),只有1枚胚胎有卵裂球增長;A0組(n=22),有2枚胚胎均無卵裂球增長。再根據每個胚胎卵裂球增長的數目及發育情況將A2組分層為5個小組,即aa組、ab組、ac組、bb組、cc組(a:胚胎致密化、融合或者形成早期囊胚;b:胚胎增長卵裂球個數>2個;c:胚胎增長卵裂球個數≤2個)。
1.2.5確定妊娠結局
移植后14d測血人絨毛膜促性腺激素(β-human chorionic gonadotrophin,β-hCG),血β-hCG≥50IU/L者判斷為生化妊娠并繼續黃體支持。移植后30d陰道超聲檢查,見孕囊及心管搏動為臨床妊娠。
1.3統計學方法

2結果
2.1一般臨床結果
凍融移植的536個周期,獲得臨床妊娠周期293例,臨床妊娠率為54.7%;孕囊數389個,胚胎種植率為36.3%;早期流產49例,早期流產率為16.7%。A2、A1、A0組的年齡、內膜厚度、身體質量指數(body mass index,BMI)和不孕年限比較差異均無統計學意義(P>0.05),見表1、表2。
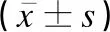
表1 A2、A1、A0 組患者的基本情況
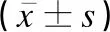
表2 A2組的5個小組患者的基本情況
2.23組胚胎繼續發育情況與患者臨床妊娠情況的關系
凍融胚胎經培養18~20h后進行移植,A2、A1、A0 3組的臨床妊娠率分別為60.9%、36.0%、9.1%,差異有統計學意義(χ2=37.76,P<0.05);3組胚胎種植率分別為41.1%、21.3%、4.5%,差異有統計學意義(χ2=44.73,P<0.05);3組早期流產率分別為16.2%、18.8%、50.0%,差異無統計學意義(P>0.05),見表3。

表3 A2、A1、A0 3組的臨床妊娠情況的總體比較[%,(n/N)]
3組間的臨床妊娠率(A2組vs A1組:χ2=18.704;A2組vs A0組:χ2=23.146)和胚胎種植率(A2組vs.A1組:χ2=24.359;A2組vs.A0組:χ2=23.389)兩兩比較差異均有統計學意義(P<0.05);3組早期流產率兩兩比較差異均無統計學意義(P>0.05)。
2.3 A2組的5個小組臨床妊娠情況比較
分兩個層次比較A2組內5個小組(aa組、ab組、ac組、bb組、cc組)的臨床妊娠情況,首先將至少移植含有1枚胚胎出現致密化、融合或者形成早期囊胚的3個小組(aa組、ab組、ac組)進行比較,在至少有1枚a類胚胎的前提下,觀察另一枚胚胎發育情況對臨床妊娠結局的影響;其次再對aa組(2枚胚胎均出現致密化、融合或者形成早期囊胚)、bb組(2枚胚胎卵裂球增長個數均>2個)、cc組(2枚胚胎增長卵裂球個數均≤2個)3個小組之間妊娠情況進行比較,結果如下。
2.3.1 aa、ab、ac 3組間比較
aa、ab、ac 這3個小組中,均至少有1枚胚胎出現致密化、融合或者形成早期囊胚。結果顯示,隨著另一枚胚胎增長卵裂球數目的下降,臨床妊娠率和胚胎種植率有下降趨勢,早期流產率呈上升趨勢,見表4。組間兩兩比較顯示:aa組的臨床妊娠率(χ2=5.976)和胚胎種植率(χ2=15.906)均顯著高于ac組,且ab組的胚胎種植率顯著高于ac組(χ2=9.839),差異均有統計學意義(P<0.05),3組間的早期流產率差異無統計學意義(P>0.05)。
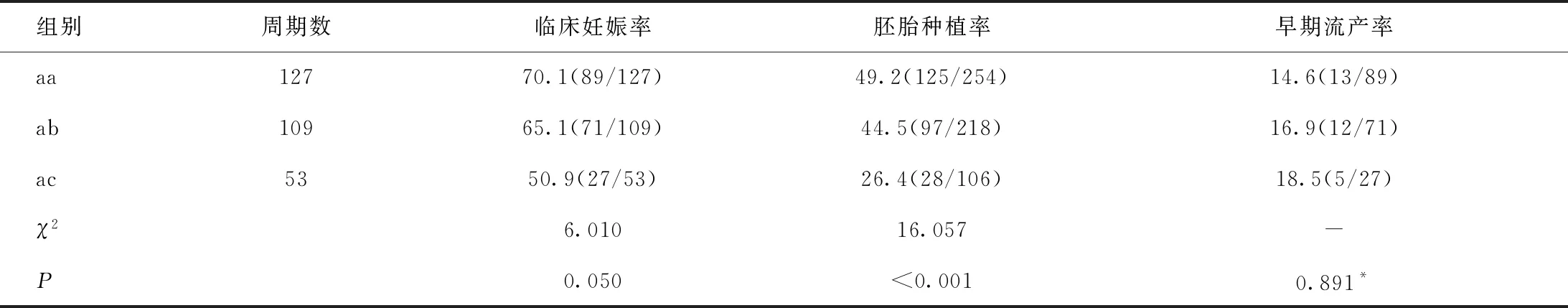
表4 aa、ab、ac 3組的臨床妊娠情況的總體比較[%,(n/N)]
2.3.2 aa、bb、cc 3組間比較
aa、bb、cc 3個小組中,隨著2枚胚胎卵裂球增長數目的減少,臨床妊娠率和胚胎種植率依次出現下降趨勢,見表5。組間兩兩比較顯示:其中,aa組的臨床妊娠率顯著高于cc組(χ2=8.108),aa組的胚胎種植率顯著高于cc組(χ2=6.971),bb組的早期流產率顯著低于cc組(χ2=3.890),上述差異均有統計學意義(P<0.05)。
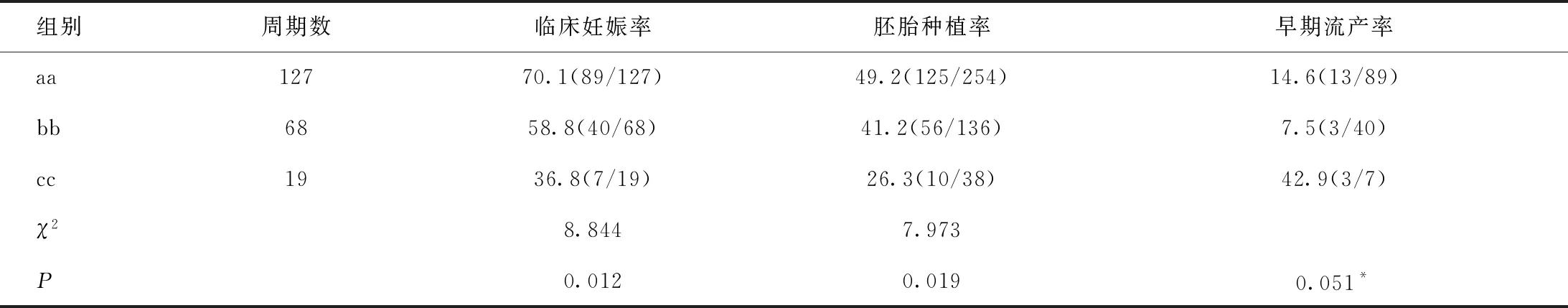
表5 aa、bb、cc 3組臨床妊娠情況的總體比較[%,(n/N)]
3討論
3.1對凍融胚胎復蘇后繼續發育情況進行評估的重要性
隨著FET技術的普及,廣大人類輔助生殖技術專家及工作者希望可以在提高妊娠率和種植率的同時,降低多胎率和流產率,增加FET的安全性[3]。這就要求我們對FET周期中的胚胎發育潛力進行判斷,不僅僅要評估冷凍前的胚胎評分,還需結合解凍后胚胎的繼續發育情況進行綜合考量。
有研究認為凍融胚胎復蘇后即使有卵裂球損傷或死亡,過夜培養后如能繼續生長,仍可獲得較好的種植率,而且是否能繼續生長對此類胚胎的種植潛力非常關鍵[4]。還有研究發現,隨著胚胎復蘇后卵裂球增長數目的增加,臨床妊娠率似有升高的趨勢[5]。卵裂期胚胎解凍后過夜培養如能繼續發育并且發生致密化將會有更高的活產率[4]。低質量胚胎過夜培養后如能獲得更多的卵裂也會有比較不錯的妊娠率,盡管這個比率會低于高質量胚胎[6]。眾多研究表明,復蘇后胚胎的發育潛能至關重要,且其影響因素需要從多個角度進行探索,本研究旨在通過觀察解凍后過夜培養的2枚胚胎繼續發育情況與患者妊娠情況的關系,以期更加細化、精準地評價胚胎的種植潛能,為臨床解凍移植策略提供最優的胚胎選擇依據。
3.2為優化臨床結局制定最佳的胚胎選擇策略
本研究中,A2、A1、A0這3個組間的臨床妊娠率和種植率比較均有統計學差異,且A2組>A1組>A0組,說明胚胎解凍過夜培養后是否有卵裂球增長與臨床妊娠情況息息相關,這與之前研究一致[7]。本研究結果還顯示:A0組(2枚胚胎均無卵裂球增長)臨床妊娠率和胚胎種植率大大降低,表明如果解凍胚胎過夜培養18~20h后仍無卵裂球增長,提示妊娠失敗的可能性較大。Laverge等[8]在1998年研究報道,對復蘇后經過夜培養后沒有卵裂球增長的胚胎,進行熒光原位雜交發現染色體異常比例很高,僅有20%左右的胚胎為正常二倍體。若移植此類胚胎,不但胚胎著床率低,且因染色體異常而發生流產的幾率增加[9-10]。如此高的染色體異常比例,臨床結局可想而知。因此本研究提示,提前解凍胚胎過夜培養時,應該把是否有卵裂球增長作為一個重點觀察指標,來指導凍融胚胎移植策略;2枚胚胎均無卵裂球增長的周期、除非患者不同意其它移植策略或已經沒有凍存胚胎可供選擇,否則建議繼續行胚胎培養至囊胚移植,尤其對于反復種植失敗的患者,不建議對此類胚胎進行移植。
對A2組(即2枚胚胎均有卵裂球數生長組)進一步分層分析,aa、ab、ac這3個小組的比較數據表明,無論臨床妊娠率還是胚胎種植率均與胚胎繼續增殖發育情況有關。而且隨著另一枚胚胎增長卵裂球數的下降,臨床妊娠率和胚胎種植率均出現下降趨勢,這與之前的研究報道一致[11]。aa組在臨床妊娠率和種植率上均高于ac組(P<0.05),且ab組的胚胎種植率高于ac組(P<0.05)。可以看出,從臨床妊娠角度來看,a類胚胎(即過夜培養后出現致密化、融合或者形成早期囊胚的胚胎)發育潛能有明顯的優勢,其次為b類胚胎(即胚胎增長卵裂球個數>2個)。aa、bb、cc這3個組比較,aa組的臨床妊娠率和胚胎種植率顯著高于cc組(P<0.05);bb組的早期流產率顯著低于cc組(P<0.05),aa組和bb組早期流產率差異無統計學意義(P>0.05)。從早期流產率的角度來看,b類胚胎繼續發育的潛能優于c類胚胎,后期需要加大樣本量進一步研究。本研究結果表明,過夜培養后胚胎卵裂球個數增長越多,尤其是已經出現致密化、融合或形成早期囊胚的胚胎,患者將獲得較好的臨床結局,與Solé等2011年研究結果一致,因此,我們有理由認為選擇過夜培養后出現致密化、融合或形成早期囊胚的a類胚胎及卵裂球數目增長較多的b類胚胎進行移植,是獲得成功妊娠的一個很關鍵的胚胎選擇策略。
胚胎種植率增加的同時必然會伴有臨床多胎妊娠率的增加,凍融胚胎過夜培養后,如果同時移植2枚都能達到b類以上的胚胎,則胚胎種植率均可達到40%以上,從患者妊娠安全性角度考慮,移植前需要綜合考慮各方面因素盡量降低多胎率。如果是單角子宮、剖宮產術后的疤痕子宮及任何原因期望為單胎妊娠的患者,最好繼續培養至囊胚行單囊胚移植或選擇a類或b類胚胎進行移植,在保證較高臨床妊娠率的前提下,能有效地降低多胎率,增加FET的安全性。當然,對于獲得胚胎非常不容易且胚胎較少的患者,可能面臨囊胚培養后無可移植囊胚的風險,在臨床實際工作中,要根據患者的胚胎發育情況、子宮內膜、身體狀況、家庭經濟及患者意愿進行綜合分析,最終決定凍融胚胎移植的最優方案。
3.3總結
綜上所述,凍融胚胎過夜培養后移植2個以上卵裂球增長的胚胎,尤其是已經發生致密化、融合或形成早期囊胚的胚胎,能獲得比較高的臨床妊娠率、種植率和相對較低的流產率;單胚胎移植時可優先選擇胚胎已經致密化、融合或者形成早期囊胚的胚胎。對于反復移植失敗的患者,不建議移植卵裂球數目未增加或者卵裂球數增加≤2個的胚胎,可考慮繼續培養至囊胚再移植。

