合金成分對熔煉法制備ODS鋼的影響
王 政, 馮 越, 張元祥
(東北大學 軋制技術及連軋自動化國家重點實驗室, 沈陽 110819)
受環境制約、氣候變化等因素影響,未來能源發展方向將向綠色、高效、低碳、清潔轉變[1].核能是滿足能源供應的重要支柱之一,受到了人們的廣泛關注[2].由于核聚變是宇宙中產生能量的主要來源,也是幾乎所有陸地能源的間接來源,對未來能源供應具有巨大貢獻[3].目前材料問題是限制聚變能發展的一個重要因素[4-5].氧化物彌散強化(ODS)鋼由于具有良好的高溫性能和抗中子輻照能力,是核聚變堆包層結構的首選材料[6].因此,制備出高性能ODS鋼對加速商用聚變堆的應用具有重要意義.
ODS鋼中的氧通常由氧化物引入,研究學者相繼向合金中引入SiO2、Al2O3、MgO、TiO2、ZrO2和Y2O3等不同氧化物并進行了大量研究[7],相應結果表明,相對于其他氧化物,彌散分布的Y2O3粒子不僅可以更加有效地釘扎位錯,提高室溫強度,并且還具有良好的高溫強度,提高了合金的抗高溫蠕變性能,除此之外,Y2O3還可以吸納輻照產生的空位與核聚變堆內嬗變產生的氦,進而改善合金的抗輻照性能[8-10],因此,人們對Y2O3為主要彌散相的ODS鋼的制備工藝進行了大量研究.
自ODS鋼被提出以來,主要采用粉末冶金法進行制備且性能最佳,可以使Y2O3氧化物質點均勻分布在鋼中.然而,這種方法制備ODS鋼存在工藝流程長、單批次產量小、批次間穩定性差等缺點[11-12].此外,Tanigawa等[13]對聚變示范堆所需的包層結構材料進行了估算,發現包層結構材料總質量將達到76 t,若每兩年更換一次,運行30年也需要1 140 t結構材料.由于缺乏大型生產裝備,粉末冶金工藝很難生產出如此大規模的ODS鋼構件,這也成為粉末冶金制備ODS鋼的致命缺陷.因此,利用工藝簡單、經濟性好且易工業化生產的熔煉工藝制備ODS鋼引起了人們的廣泛關注.但是由于Y2O3的熱穩定性高、與鋼液的潤濕角大且密度低于鋼液的密度,導致其在熔煉過程中短時間內團聚上浮而無法引入到鋼中[14-15].
針對以上問題,本文通過對合金成分進行設計,采用真空銅模吸鑄工藝制備4種Fe-Cr-Y-O試樣,分析試樣的顯微組織特征和力學性能,對比研究熔煉法制備ODS鋼時不同試樣中Y2O3的上浮情況,為利用熔煉工藝制備性能優異的ODS鋼提供了有益指導.
1 試 驗
1.1 合金的原料與成分設計
試驗原料包括:工業純鐵、金屬鉻、金屬釔、單質硅、鈦鐵、氧化亞鐵粉末和前驅粉.工業純鐵、金屬鉻、金屬釔、單質硅的純度均大于99.9%,鈦鐵中鈦含量為40%,氧化亞鐵粉末為微米級顆粒且純度為99.999%.利用高能球磨制備前驅粉,包含5%鈦、5%氧化釔和90%鐵.共設計了4種試驗鋼,其編號和化學成分如表1所示.
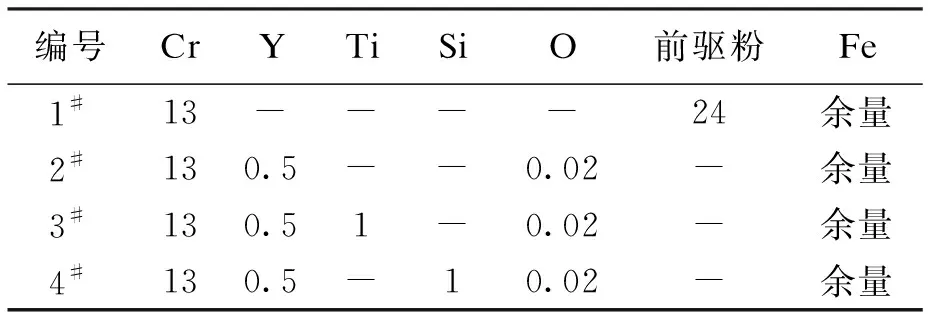
表1 試驗鋼的化學成分(w)Tab.1 Chemical compositions of experimental steels (w) %
1.2 合金制備與熱處理工藝
利用真空吸鑄工藝制備試驗鋼,首先在真空電弧熔煉爐中對配好的原料進行熔化,得到合金鑄錠,其質量約60 g.為了避免成分的不均勻性,鑄錠需反復熔化3次以上,每次熔化時間為30 s,熔化電流為400 A,熔化過程中觀察鑄錠表面狀態并計時.對合金鑄錠進行最后一次熔化后快速吸鑄,使得鋼液在模具中快速凝固成型,便可獲得所需合金成分的小型板狀試樣,其尺寸為74 mm×20 mm×4 mm.幾種不同試驗鋼的熔化過程分別為:1#鋼:所有原料同時熔化;2#鋼:先將Fe、Cr、FeO粉末熔化成鑄錠后,再加入Y進行熔化;3#鋼:先將Fe、Cr、FeO粉末熔化后加入Y和Ti進行熔化;4#鋼:先將Fe、Cr、FeO粉末熔化后加入Y和Si進行熔化.為了檢驗Y2O3最終是否以固溶的形式存在于鋼中,將上述板料經過線切割取樣后進行高溫時效處理,并在1 000 ℃下分別保溫0.5、1、1.5、2、2.5、3、5和8 h后空冷.
1.3 合金組織與性能表征
將時效處理后的試樣預磨后進行拋光,然后對其進行化學腐蝕,腐蝕劑選用濃度為4%的FeCl3溶液,最后采用OLYMPUS型金相顯微鏡對其顯微組織進行觀察.為了進一步觀察材料的微觀組織形貌并對其化學成分進行分析檢測,采用附帶能譜儀(EDS)的ZEISS ULTRA 55型掃描電鏡(SEM)對經過金相拋光腐蝕后的試樣進行觀察,采用維氏顯微硬度計測量其顯微硬度,所用載荷為200 g,保壓時間為10 s,測試多個點位,取其平均值作為最終結果.采用FEI G2 F20型透射電子顯微鏡(TEM)觀察試樣的微觀形貌,并采用JEOLJXA-8530F型電子探針(EPMA)觀察試驗鋼中元素的分布情況.
2 試驗結果
2.1 金相顯微組織
對在1 000 ℃下保溫2 h后的4種試驗鋼分別進行金相顯微組織觀察,結果如圖1所示.由圖1可見,1#鋼晶粒比較粗大,柱狀晶貫穿試樣的整個厚度范圍;2#鋼中晶粒的長寬比約為2.96,長約145.87 μm,寬約49.28 μm;3#鋼出現枝晶,一次枝晶間距較小,組織細密,分布在枝晶間的元素偏析范圍較小,成分較為均勻;4#鋼呈現出鑄件的典型組織,可觀察到垂直于型壁排列的柱狀晶和中心等軸晶組織.此外,4種試驗鋼基體的組織類型均為鐵素體.

圖1 試驗鋼的金相組織Fig.1 Metallographic microstructures of test steels
2.2 SEM和EDS結果
由于受到金相顯微鏡放大倍數的限制,未觀察到合金中的第二相,因此,為了進一步研究合金中的第二相分布情況,采用掃描電鏡對在1 000 ℃下保溫2 h后的4種試驗鋼進行觀察,結果如圖2所示.由圖2可見,1#鋼中顆粒數量極少,密度較低,幾乎不可見,而在2#和3#鋼內發現了平均直徑約為2~4 μm的顆粒,其形狀近似圓形,4#鋼中的顆粒數量較多,分布密集,且顆粒尺寸相對較小,平均直徑約為0.5~2 μm.此外,2#和4#鋼中的顆粒隨機均勻地分布在鑄錠內部,而3#鋼中的顆粒大多分布在晶界附近.

圖2 試驗鋼的SEM照片Fig.2 SEM micrographs of test steels
為了進一步確定上述顆粒的組成,對4種合金試樣的第二相顆粒進行了能譜分析,結果如表2所示.由表2可見,1#鋼僅含有元素Fe、Cr、O、Ti,不存在元素Y.2#、3#和4#鋼中均包含元素Y和O,可以推斷基體內含有由元素Y和O構成的第二相.可見,采用2#、3#和4#鋼的鑄造方法可以將微米級Y2O3顆粒引入鋼基體中.

表2 試驗鋼的EDS結果(w)Tab.2 EDS results of test steels (w) %
2.3 時效硬化曲線
為了探究4種試驗鋼內第二相粒子的析出情況,分別將其在1 000 ℃下保溫不同時間后空冷,從而進行時效處理,隨后測定顯微硬度,結果如圖3所示.由圖3可見,在整個時效過程中1#、2#和3#鋼的顯微硬度值基本保持不變,其中1#和2#鋼的硬度相近,且明顯低于3#鋼,這是由于3#鋼中Ti可以細化合金晶粒,晶粒尺寸的降低能夠提高位錯運動阻力與合金抵抗局部變形的能力,從而提高了鋼的硬度.此外,4#鋼的硬度相對較高,且隨著時效時間的增加,4#鋼的硬度呈現先逐漸升高隨后達到飽和的變化趨勢.當時效時間為0.5 h時,4#鋼的硬度約為143 HV,當時效時間為1.5 h時,4#鋼的硬度達到飽和,飽和值約為164 HV.
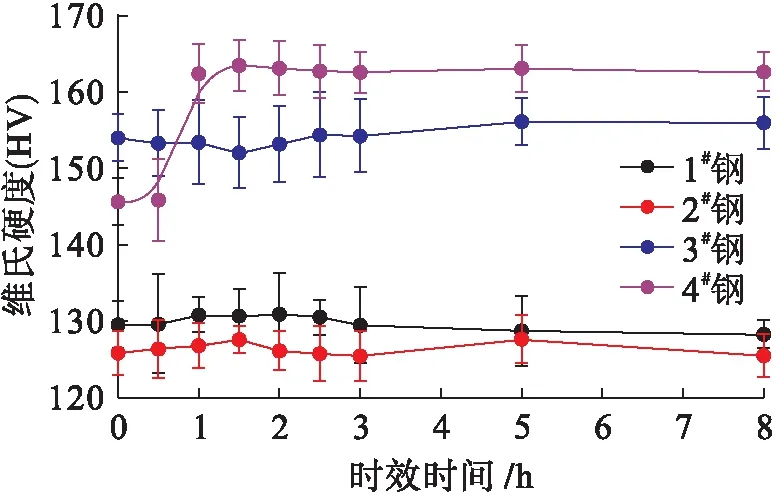
圖3 試驗鋼的顯微硬度Fig.3 Microhardness of test steels
3 分析與討論
3.1 納米級第二相顆粒存在證明
針對4#鋼硬度的變化趨勢,對時效時間為2 h的試樣進行透射觀察,結果如圖4所示.由圖4可見,試驗鋼內部含有彌散細小的納米級顆粒,即4#鋼經過一定時間的時效后內部可以析出第二相.

圖4 1 000 ℃時效2 h后4#鋼的TEM圖像Fig.4 TEM image of 4# steel after aging at 1 000 ℃ for 2 h
合金的宏觀力學性能變化與時效過程中微觀組織演化密切相關,因此,顯微硬度的變化可以很好地反映晶粒內部第二相的析出過程.1#、2#和3#鋼的顯微硬度隨著時效時間的增加變化不大,而4#鋼的顯微硬度隨著時效時間的增加變化較大,且該顯微硬度的變化正好可與晶粒內部納米級第二相的析出過程一一對應.初始時效階段合金元素固溶于基體內部,固溶強化起主導作用,強化效果較弱,材料的硬度值較低.隨著時效過程的進行,第二相逐漸脫溶析出,材料基體成分逐漸降低,位錯弓出第二相所需要的力更大,即細小彌散的第二相對位錯的阻礙作用更強,此時彌散強化作用的增加程度大于固溶強化作用的減少程度,彌散強化起主導作用,因而試驗鋼的硬度逐漸升高.隨著時效時間的繼續增加,材料基體元素逐漸減少,第二相析出的驅動力逐漸降低,最終第二相析出達到飽和狀態,其含量不再變化,因而試驗鋼的硬度也達到最大值.可見,在材料成分中添加合金元素Si可以促進含有納米級顆粒ODS鋼的制備.
3.2 納米級Y2O3形成機理
3.2.1 熔池反應過程
在熔化過程中對試驗鋼的觀察發現,1#鋼液熔化時其表面未發生變化,而熔化后爐腔內發現了脫落的表皮;2#鋼在熔化10 s的時間內,鑄錠上表面出現了明顯的膜層;3#鋼在熔化時間約為15 s時鑄錠表面出現了膜層;而4#鋼在熔化24 s之后其表面才會發生變化.可以推測這是由于1#鋼在熔化過程中Y和O的反應十分迅速,Y2O3以極快的速度在短時間內團聚上浮致使來不及觀察到相應現象.而4#鋼中Si先和O發生反應,隨后Y爭奪O并與O結合形成Y2O3,即在一定的熔化時間內,Si的加入能夠有效推遲Y和O的反應,延長了Y2O3的形成時間,從而對Y2O3的上浮起到抑制作用,具體反應過程示意圖如圖5所示.

圖5 熔池反應過程示意圖Fig.5 Schematic diagram of molten pool reaction process
3.2.2 鑄錠上表面成分
為了進一步探究Y2O3在熔煉過程中的上浮情況,通過電子探針采用面掃方式對4種試驗鋼在熔化后形成鑄錠的上表面部分進行觀察,結果分別如圖6~9所示.
由圖6可見,在1#鋼表皮和內部未發現元素Y的存在,表明Y2O3不僅未存在于鋼的內部,而且也未在鋼表面聚集,結合熔化過程中的觀察結果可知,Y2O3熔化時由于上浮速度過快導致其大部分成為爐渣,因此,采用這種方法制備ODS鋼是不可行的.由圖7可見,在2#鋼中Y和O元素在表皮部分聚集,厚度約為22 μm.雖然2#鋼內部存在含Y的氧化物顆粒,但僅是由一小部分Y2O3聚集粗化形成的,大量Y2O3在熔化過程中上浮到了鋼表面,形成一層Y2O3膜層.由圖8可見,3#鋼中表皮部分富集的Y和O相比于2#鋼較少,但仍有較多的Y和O存在于鑄錠表面.由圖9可見,4#鋼表皮部分基本不存在Y元素,且O含量也較少,這與熔化時觀察到的4#鋼表面在熔化較長時間后才發生變化的結果一致,再次驗證了在利用熔煉法制備ODS鋼時Si元素抑制Y2O3上浮的有效性.

圖6 1#鋼面掃結果Fig.6 Surface scanning results of 1# steel
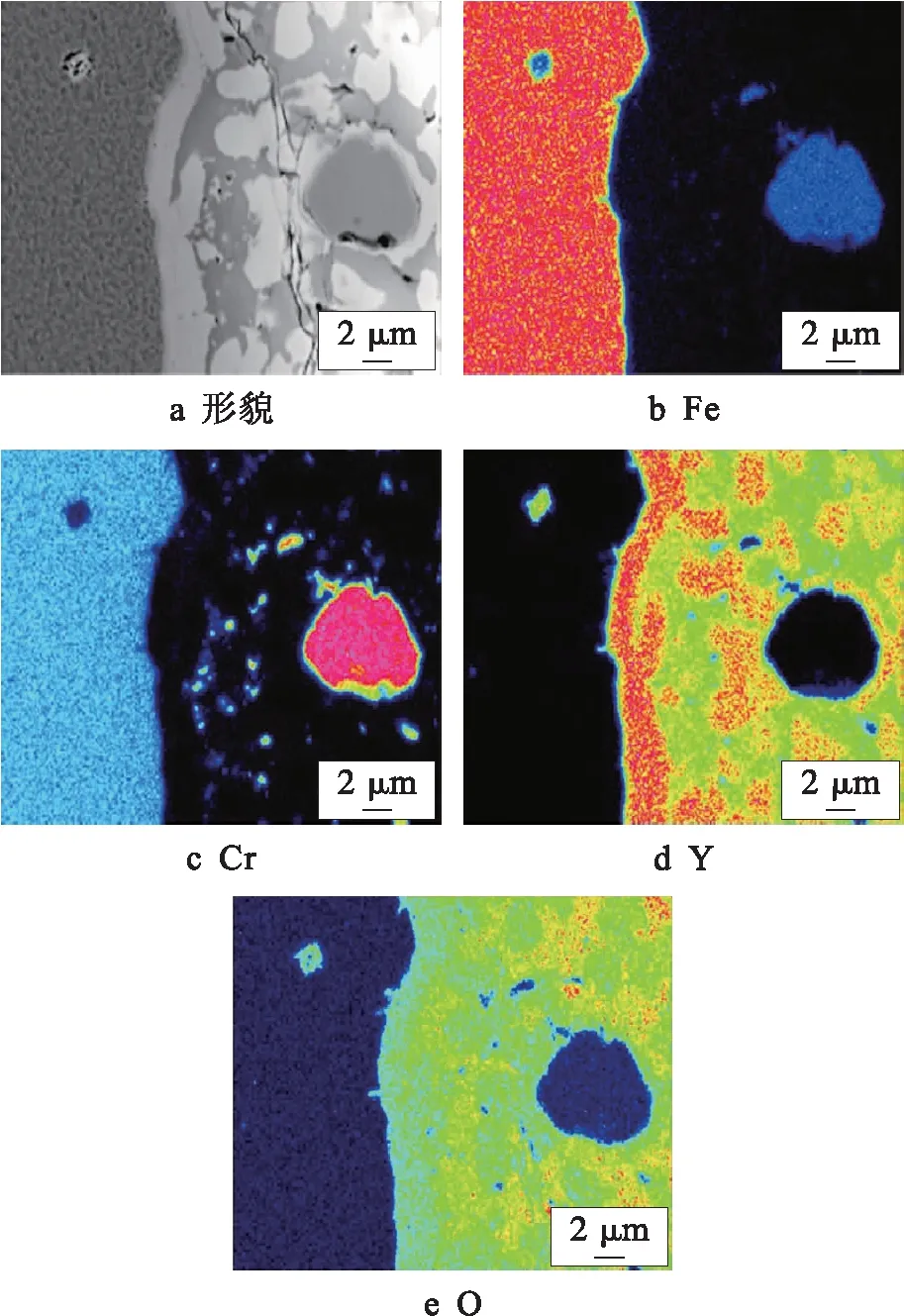
圖7 2#鋼面掃結果Fig.7 Surface scanning results of 2# steel

圖8 3#鋼面掃結果Fig.8 Surface scanning results of 3# steel

圖9 4#鋼面掃結果Fig.9 Surface scanning results of 4# steel
3.3 成分工藝優化
基于上述試驗結果可知,利用熔煉法制備ODS鋼時可以添加微量的合金元素Si,并采用先加氧,最后添加Si和Y的熔煉方式.由于Si的加入使得鑄錠表面在熔化24 s后發生變化,因此,可將熔化時間控制在20 s以內,從而更好地抑制Y2O3的上浮,最終獲得含有更多納米級顆粒且性能優良的ODS鋼.
4 結 論
通過以上分析可以得到如下結果:
1) 熔煉時通過最后熔化Y的工藝進行ODS鋼的制備,可以引入少量微米級Y2O3顆粒,在此基礎上添加合金元素Ti可以細化晶粒,提高硬度,對抑制Y2O3上浮起到一定作用.
2) 在最后熔化Y的基礎上添加合金元素Si可以推遲Y2O3的形成及上浮時間,鑄錠表面基本不存在Y元素,且O含量也較少,并通過一定時間的時效處理,鑄錠中可以析出呈彌散分布狀的納米級第二相粒子.元素Si的加入能夠制備出含納米級氧化物顆粒的ODS鋼,并使其力學性能得到改善.

