磁共振彌散張量成像對兔肝缺血再灌注損傷晚期階段肝損傷程度的評估價值
郭成偉,郝 永,張小燕,金正印,崔現成,王紅素,張寶華,吳清華,顏林軍
肝缺血再灌注損傷(IRI)是肝臟外科手術需要預防的病理生理過程。目前研究認為肝IRI分為早期(急性期)和晚期(亞急性期)兩個階段[1-2]。多數研究將IRI后2 h或6 h內界定為早期、12~48 h界定為晚期階段,筆者已經在前期研究證實彌散張量成像(DTI)對兔急性肝IRI具有較好診斷價值[3],本研究旨在研究磁共振DTI對兔肝IRI后晚期階段成像參數的變化特點,并與臨床常采用評價肝損傷程度的生化指標、炎性因子,以及病理形態學積分行多元相關性分析,以了解平均擴散系數(DCavg)和各向異性系數(FA)對肝IRI的評估價值。
1 材料與方法
1.1肝IRI模型制備及分組 肝IRI模型制作:24只新西蘭大白兔[由南方醫科大學實驗動物中心提供(SCXK2016-0015)],普通飼養,3~4月齡,體質量2.0~3.0 kg,分為IRI組(18只)與假手術組(6只)。IRI組給予苯巴比妥鈉1 ml/kg耳緣靜脈麻醉,中上腹部剪毛、清潔、消毒,腹部正中切口8~10 cm,采用3號手術線活結夾閉肝左葉動脈、門靜脈,為保證肝IRI成功率、保留肝右葉血供,60 min后,松開手術活結、恢復肝左葉血供,關閉腹腔。依據血供時間分為12 h、24 h與48 h組,每組6只。假手術組打開腹腔、暴露肝門,不阻斷肝血供,解剖肝十二指腸韌帶。手術過程中,注意保暖,術后置于兔專門飼養室,并適當補液。
1.2MR掃描及參數 設備GE Signa HDxt 3.0T掃描儀,體位:仰臥位,線圈:8通道膝部線圈,靜脈麻醉后,用兔實驗專用腹帶以減輕呼吸運動偽影。MRI-DTI掃描參數:TR/TE 2200/50.3 ms,激勵次數(NEX)4次,掃描視野(FOV)20 cm×20 cm,Phase FOV 0.75,矩陣196×128,層厚3 mm。梯度因子b=100、300、600 s/mm2(6個方向),掃描時間:106 s。
1.3MR圖像分析 應用GE AW4.6 FuncTool Performance,對原始圖像首先應用Correction進行圖像校正,后重建出FA、DCavg圖。后設定感興趣區(ROI):15 mm2。在不知實驗分組的前提下,具有5~10年工作經驗的臨床影像學診斷醫師2名,分別對DTI圖像采用雙盲法獨立閱片、分析、測量、分析數據2次;在肝損傷區域、邊緣部分及未發生明顯損傷的區域,測量連續三個層面DCavg及FA值,計算均值。
1.4生化、炎性因子水平測定及病理組織學分析 MRI檢查結束后,各組實驗兔經下腔靜脈抽取靜脈血5 ml,置于37 ℃水浴箱中2 h,待血液凝固后以60 mm離心半徑、3500 r/min的速度4 ℃離心5 min,分離血清。血清丙氨酸轉氨酶(ALT)、天冬氨酸轉氨酶(AST)水平采用自動生化分析儀測定;腫瘤壞死因子-α(TNF-α)采用ELISA測定,每組連續測量3次,取平均值。實驗結束后、靜脈空氣栓塞法處死實驗兔摘取肝左葉,在10%甲醛溶液中固定,后逐級脫水、石蠟包埋,制成4 μm厚切片,HE染色,光學顯微鏡下觀察肝IRI組織形態學,并參照文獻[4-5]進行組織形態學積分。
1.5觀察指標 ①磁共振DTI參數:DCavg和FA變化情況;②肝損傷評價指標:ALT、AST、TNF-α水平及病理形態學積分。
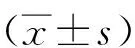
2 結果
2.1兔血清AST、ALT、TNF-α水平及形態學積分 各IRI組血清ALT、AST、TNF-α水平及形態學積分均高于假手術組(P<0.05)。IRI 12 h ALT達峰值,IRI 24~48 h逐漸下降;AST在IRI后持續升高,48 h達峰值;TNF-α在IRI后24 h達峰值,后開始下降。IRI 12 h組ALT均高于IRI 24 h和48 h組,AST和形態學積分均低于IRI 24 h和48 h組(P<0.05);IRI 12 h組TNF-α低于IRI 24 h組,高于IRI 48 h組,且IRI 24 h組高于IRI 48 h組(P<0.05)。見表1。
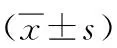
表1 4組兔血清ALT、AST、TNF-α水平及形態學積分比較
2.2病理組織評分與AST、ALT、TNF-α相關性分析 鏡下各組病理形態學積分與AST、ALT及TNF-α均存在高度正相關(r=0.72、0.91、0.80,P<0.01)。
2.3肝IRI各組DCavg、FA變化情況 DCavg在肝IRI 12~24 h均呈下降趨勢。b=100 s/mm2時,IRI 24 h組DCavg低于假手術組,IRI 48 h組高于IRI 12、24 h組(P<0.05);b=300 s/mm2時,IRI 48 h組DCavg高于假手術組及IRI 12 h、24 h組(P<0.05);b=600 s/mm2,IRI 48 h組DCavg高于假手術組和IRI 24 h組(P<0.05)。隨著肝IRI損傷加重,FA在肝缺血再灌注損傷后12~48 h呈逐漸下降趨勢。b=300、600 s/mm2時,IRI 24 h組FA低于假手術組(P<0.05),b=100、300、600 s/mm2時,IRI 48 h組FA低于假手術組及IRI 12 h、24 h組(P<0.05)。見表2、圖1。
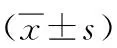
表2 4組不同b值時DCavg及FA值比較

圖1 兔肝缺血再灌注損傷24 h組磁共振彌散張量成像(b=300 s/mm2)1a.壞死組織表現為高信號;1b.平均擴散系數較正常組織明顯升高(ROI 1~2 vs ROI 3~4);1c.各向異性系數呈相反的變化趨勢;ROI為感興趣區
2.4MRI-DTI參數與肝損傷指標相關性多元線性回歸分析 將DCavg、FA作為因變量,AST、ALT、TNF-α及病理形態學積分作為自變量行多元線性回歸分析,標準篩選P為0.05~0.10,將不顯著的變量DCavg(b=100、600 s/mm2)排除。DCavg(b=300 s/mm2)、FA(b=100、300、600 s/mm2)與病理形態學積分、AST、ALT、TNF-α存在較好的相關性(P<0.01)。見表3。

表3 病理形態學積分、AST、ALT、TNF-α與DCavg、FA相關性的多元線性回歸分析
3 討論
磁共振DTI是依據組織內水分子的三維彌散特性來探測生物體微觀結構的一種功能成像方法,較彌散加權成像(DWI),其更主要反映出水分子對方向的依賴性,即各向異性彌散[6-7]:生物體內水分子各方向的彌散強度大小不一致,與生物體微結構走行平行方向上彌散最強,而與其方向垂直彌散能力最弱,基于這種生物體內微觀組織結構的不同影響水分子自由彌散的方向和速率,FA和DCavg是客觀評價參數:FA(0~1)反映水分子運動的方向性,水分子運動的方向越一致,FA值越大;DCavg是所有方向上表面擴散系數(ADC)平均值,較DWI-ADC更加精確描述分子各個方向擴散能力,DCavg值越高表示該處水分子的運動能力越強,否則表示水分子的運動受限[8]。因而DTI成像時間較DWI延長,對磁場不均勻性更為敏感,其有利之處是對肝內微小病灶更易檢查,但對DTI圖像質量控制帶來困難。DTI作為臨床一種非創性的早期檢測大腦缺血、腦損傷、腦腫瘤鑒別等的敏感方法[9-11],FA值與神經纖維、髓鞘的完整性、神經纖維的致密性及平行性呈正相關。肝臟內肝竇或纖維結構具有方向性解剖特征,肝細胞外間隙空間大小或纖維結構走行的方向決定肝竇間隙內水分子彌散主軸方向和能力,肝竇或具有方向性纖維結構的解剖特征是肝臟磁共振DTI基礎[12]。因此,肝細胞外間隙容積改變、肝膠原纖維排列或數量改變,對應的FA值、DCavg隨之發生改變,因此,DTI成像在肝纖維化及肝臟局灶性病變中已廣泛應用[13]。肝IRI后肝細胞彌漫性水腫會導致肝竇或細胞外間隙縮小、水分子方向性增高(FA增高),而水分子運動能力相應下降(DCavg降低),所以,DCavg、FA可作為臨床檢測肝IRI病理機制的一種影像評價方法。
有研究發現大鼠肝I/R后60 min,DCavg顯著下降、FA上升,而在I/R后24 h DCavg明顯上升、FA下降[14],本研究與其結果存在差異。因此,對于DTI功能成像技術對肝IRI機制及診斷價值等方面的研究還需進一步探索。
本研究結果顯示,在IRI后12~48 h,隨著微循環障礙的改善、動靜脈短路等血流動力學改變,DCavg、FA出現緩慢上升或下降,這與肝IRI早期(急性期1~6 h)因肝竇淤血、肝細胞腫脹等所致水分子在細胞膜內外各個方向上的運動能力下降(DCavg下降),增加了水分子細胞外間隙運動方向迂曲性致FA上升明顯不同[3,15]。在IRI后24 h,DCavg也出現與DWI-ADC類似的一過性下降現象[16],但與DWI-ADC比較,其下降幅度減小,究其原因可能是 DCavg為各個方向上ADC的平均值,更趨向于穩定,但DTI掃描時間較DWI明顯延長,對DTI圖像質量控制需要更高的要求[17]。至于IRI 48 h組DCavg顯著上升,是由于肝細胞逐漸加重溶解壞死致水分子運動彌散受限減低,但同時也存在著較ADC上升幅度較小的征象,其原因可能是二者成像機制的不同所致[3]。
本研究結果顯示,IRI 24、48 h組FA低于假手術組,分析原因,此階段病理基礎是隨著肝損傷的加重(鏡下組織形態學積分逐漸升高),肝細胞的正常微觀結構喪失,致維持其方向性的細胞網架結構逐漸遭到破壞、溶解,從而使擴散的各向異性減低。因此,FA下降是IRI后肝組織病理過程的體現,這對于評價IRI晚期階段肝組織損傷、壞死具有重要的意義。
在肝IRI病理過程中,隨著肝損傷、壞死的繼續加重,AST、ALT變化趨勢與鏡下組織學評價并不完全一致,本研究結果顯示,ALT在肝IRI后12~24 h維持峰值,隨后出現下降,與肝IRI繼續進展的病情并不一致,肝轉氨酶的變化較大,其應用價值也有所受限。而多元線性回歸分析可以分析變量間的相對作用大小,達到準確的預后評估和定量診斷目的。本研究結果表明,FA(b=100、300、600 s/mm2)與肝轉氨酶、炎性因子、病理學評分存在較好的線性相關,且FA較DCavg具有更高的診斷價值。從b值的選取來看,在b較小時(100 s/mm2)對肝IRI診斷價值較大,這與以往實驗結果基本一致[15]。而采用更小的b值(50 s/mm2)可能增加T2投射效應而降低其診斷價值;b值較大(600 s/mm2)時,可能由于肝TE時間較短,使DWI及DTI圖像質量降低,影響ADC/DCavg準確性。
綜上所述,肝IRI晚期階段(12~48 h)磁共振DTI能更好、客觀反映肝細胞的正常微觀結構喪失,細胞網架結構逐漸遭到破壞、溶解等微觀病理機制,且該方法具有檢查時間短、圖像分辨率高及對肝內隱性微小病灶敏感,并能對肝組織的生理狀態(肝細胞生理活性和微循環)進行定量和定性評價,符合精準醫學的發展要求,肝IRI實驗研究可使更多患者受益。

