基于網絡藥理學和實驗驗證探討降糖通脈方治療糖尿病肺損害的作用機制
丁 念,鄭承紅
(1.湖北中醫藥大學,湖北 武漢 430000;2.武漢市中醫醫院,湖北 武漢 430014)
1976 年,Schuyler 提出糖尿病肺損害屬于糖尿病微血管病變,因肺臟血供豐富,所以肺臟也是糖尿病損害的靶器官之一[1]。 肺臟有豐富的血管系統,極易受到高糖狀態的影響。 糖尿病微血管病變是造成糖尿病肺損害的主要原因。 彭麗媛等[2]發現糖尿病患者的肺臟微血管通透性及肺臟結構破壞明顯高于健康對照組。 KODOLOVA 等[3]觀察了不同嚴重程度和不同病程的糖尿病患者肺血管組織,發現這些肺血管組織的微血管病變與其他臟器(如腎臟)的微血管病性改變極其相似。 糖尿病肺損害的基本病機是陰虛燥熱、絡脈瘀阻,陰虛為本,燥熱、氣滯、痰濕、瘀血為其標,而瘀血貫穿疾病的始終。針對“虛”“瘀”兩個核心, 臨床采用降糖通脈方以滋陰清熱、 活血化瘀。 降糖通脈方主藥為女貞子12 g、黃連5 g、川芎10 g,其中:女貞子補肝腎之陰、清虛熱,發揮養陰之力,以治其本;消渴日久,臟腑虛弱,必生痰濕、瘀血等內毒,黃連清熱解毒燥濕;川芎行氣活血化瘀治其標。前期研究發現,降糖通脈方可以下調糖尿病大鼠TGF-β1 表達,減少細胞外基質的堆積,改善血管的超微病理結構來干預糖尿病微血管病變[4]。 臨床研究也發現,降糖通脈方可以改善糖尿病患者的肺功能損害。為進一步探究降糖通脈方治療糖尿病肺損害的分子學機制,通過網絡藥理學的方法,探究降糖通脈方治療糖尿病肺損害的物質基礎和作用機制,并結合糖尿病肺損害模型大鼠對其中的關鍵信號通路進行驗證,可為后續基礎研究和臨床實踐提供依據。
1 材料
1.1 實驗動物
選用健康的SPF 級雄性8 周齡SD 大鼠60 只,體質量180~200 g,實驗動物使用許可證號:SYXK(鄂)2018-0104,購于三峽大學實驗動物中心。 飼養環境為溫度22~26 ℃,濕度50%~60%,人工光照明、暗各12 h。 在本次實驗過程中,按照《實驗動物管理條例》等相關文件標準進行飼養與處置。
1.2 主要試劑
戊巴比妥鈉(批號P3761)、鏈脲佐菌素(STZ)(批號S0130)均購自美國Sigma 公司;二甲雙胍(批號M107827,阿拉丁試劑有限公司);二甲苯(批號10023418)、無水乙醇(批號10009218)、碳酸鋰(批號20022818)、冰乙酸(批號10000218)均購自國藥集團化學試劑有限公司;伊紅(批號E8090)、中性樹脂(批號G8590)、蘇木素(批號G1004)均購自武漢賽維爾生物科技有限公司;蛋白質Marker(批號X1109A,美國Helix 公司);十二烷基硫酸鈉(SDS)(批號1019Y032)、TEMED(批號CT29143440)、過硫酸銨(批號603B0313)、BCA 蛋白濃度測定試劑盒(批號120720210514)、RIPA(強)組織細胞快速裂解液(批號20201027)、Tween-20(批號C2011141)均購自北京索萊寶科技有限公司;PVDF 轉移膜(批號R9JA64128)、化學發光試劑(批號20345A4/20345A4)均購自德國Millipore 公司;TGF-β 一抗(批號20201014)、SnoN 一抗(批號20200312)、Smad2一抗(批號20200525)、Smad3 一抗(批號20200218)、Smad7 一抗(批號20200622)、p-Smad2 一抗(批號GR200003-85)均購自英國Abcam 公司;p-Smad3 一抗(批號15,CST)、p-Smad7一抗(批號20201012)、GAPDH 一抗(批號20200525)、Goat anti-Rabbit IgG(批號20200507)均購自華聯科股份有限公司。
1.3 主要儀器
正置顯微鏡(型號DM1000,德國徠卡顯微系統有限公司);TB-718L 型生物組織包埋機-冷凍機、GNP-9080 型隔水式恒溫培養箱均購自泰維科技股份有限公司;電泳儀(型號mini protean 3 cell,美國BIO-RAD 公司);全自動化學發光分析儀(型號Tanon-5200,上海天能有限公司)。
2 方法
2.1 降糖通脈方治療糖尿病肺損害的網絡藥理學研究
2.1.1 藥物有效活性成分的篩選 應用TCMSP 數據庫(https://tcmsp-e.com/)及BATMAN-TCM 數據庫(http://bionet.ncpsb.org/batman-tcm/)檢索藥物方中主要藥物女貞子、黃連、川芎的所有活性成分。 根據研究結果,以口服生物利用度(oral bioavailability, OB)>30%、類藥性(drug-likeness, DL)≥0.18 為限制條件進行篩選,得到藥物的有效活性成分。
2.1.2 藥效成分-靶點互作網絡構建 應用TCMSP數據庫及BATMAN-TCM 數據庫平臺檢索藥物所有活性成分的靶基因,并將TCMSP 數據庫篩選所得所有靶蛋白名稱導入DrugBank 數據庫(https://www.drugbank.ca/) 以及UniProt 數據庫(https://www.uniprot.org),設置物種為人類(Homo sapiens),對得到的靶蛋白進行比對和基因名校正,轉換成標準的基因名,并刪除無對應基因名的靶蛋白。
2.1.3 糖尿病肺損害的疾病靶點篩選 設置檢索詞為“type 2 diabetes lung injury”,通過GeneCards數據庫(https://www.genecards.org/)進行檢索,篩選得到糖尿病肺損害疾病靶點,并應用UniProt 數據庫(https://www.uniprot.org)對疾病靶點進行標準化,獲得Swiss-Prot ID。
2.1.4 活性成分與疾病的共同靶點篩選及蛋白質-蛋白質相互作用(protein-protein interaction, PPI)網絡構建 明確糖尿病肺損害相關靶點與藥物潛在靶點之間的相互作用,應用R 語言(https://www.r-project.org/)軟件及Perl 語言程序將疾病靶點與藥物靶點進行交集,并輸入Venny 2.1 軟件(http://bioinfogp.cnb.csic.es/tools/venny/index.html)繪制韋恩圖。 應用STRING(https://string-db.org/) 插件構建共同靶點PPI,將蛋白種類設置為“Homo sapiens”,將Settings 設為“high confidence:0.9”,并隱藏無關系的靶點,其他參數保持默認設置,獲得PPI 網絡。 應用count.R 插件獲得共同蛋白靶點出現的頻次。
2.1.5 GO 生物功能分析和KEGG 富集 應用R 語言(https://www.r-project.org/)軟件中clusterProfiler GO.R 包及Perl 語言對活性成分與糖尿病肺損害的共同靶點進行GO 分析,GO 分析主要用于描述基因產物的功能, 其中包括細胞組分 (cellular component, CC)、分子功能(molecular function, MF)和生物學過程(biological process, BP),并應用clusterProfiler KEGG.R 包進行KEGG 富集分析。 利用Cytoscape 3.7.2 軟件構建核心靶基因-信號通路互作網絡圖。根據富集因子值分析核心通路富集程度,查閱相關文獻, 基于構建的網絡探討降糖通脈方治療糖尿病肺損害的潛在機制。
2.2 降糖通脈方治療糖尿病肺損害藥理學實驗驗證
2.2.1 大鼠糖尿病肺損害模型的復制與鑒定 根據隨機數字表法取10 只大鼠作為正常對照組(NC組),另取50 只大鼠作為糖尿病造模組。大鼠均予高糖高脂飼料(含蔗糖10%、豬油10%、蛋黃粉10%、膽固醇1.5%、膽酸鈉0.5%、全價飼料68%)喂養4 周,后造模,大鼠禁食不禁水12 h 后,在配制好的0.1 mol/L檸檬酸-檸檬酸鈉緩沖液(pH=4.2)的基礎上,配制1% STZ溶液,按照35 mg/kg 腹腔注射1% STZ 溶液,72 h后采尾靜脈血及檢測,隨機血糖值大于16.7 mmol/L、尿糖≥(+++)的大鼠為糖尿病造模成功[5]。 大量研究表明持續高糖環境可以直接引起糖尿病肺損傷[6-8]。本實驗研究,在制備出具有2 型糖尿病特征的大鼠模型后,繼續高糖高脂飼料喂養8 周。 在飼養第8周末,取大鼠肺組織做病理檢查,發現肺泡腔減少,肺泡腔增厚,部分肺泡腔萎縮甚至塌陷,有大量炎性細胞滲透、纖維組織增生,纖維細胞浸潤明顯,說明已經成功復制了大鼠糖尿病肺損害模型。
2.2.2 動物分組和樣本采集 造模成功后,將大鼠分為6 組進行藥物干預,每組10 只大鼠。 (1)NC組:不給藥,普通飼料喂養;(2)糖尿病模型組(DM組):等體積生理鹽水灌胃,每天灌胃一次,連續8周,繼續使用高脂飼料喂養;(3)降糖通脈方低劑量組(JTTM 低劑量組):JTTM 63 mg/mL 混懸液灌胃給藥1 mL/(kg·d),持續8 周后繼續高脂飼料喂養;(4)降糖通脈方中劑量組(JTTM 中劑量組):JTTM 126 mg/mL混懸液灌胃給藥1 mL/(kg·d),持續8 周后高脂飼料喂養;(5)降糖通脈方高劑量組(JTTM 高劑量組):JTTM 252 mg/mL 混懸液灌胃給藥1 mL/(kg·d),持續8 周后,高脂飼料喂養;(6)二甲雙胍組(Met 組):二甲雙胍54.3 mg/mL 水溶液灌胃給藥1 mL/(kg·d),持續8 周后,繼續高脂飼料喂養。
于第8 周末藥物干預完成后,頸椎脫臼法處死各組大鼠,將血標本離心,取上清液置-80 ℃冰箱保存。 取一側肺組織用4%多聚甲醛固定,另一側肺臟組織放入液氮保存。
2.2.3 HE 染色觀察大鼠肺組織形態學變化 石蠟切片,常規二甲苯脫蠟,梯度乙醇水化至蒸餾水洗;蘇木素染色8 min,自來水沖洗;鹽酸乙醇分化30 s(提插數下);溫水返藍;置伊紅液中2 min;常規梯度乙醇脫水,二甲苯透明,中性樹膠封片;觀察肺組織的病理變化,拍照分析。
2.2.4 Western blot 法檢測大鼠肺組織中的TGFβ1、Smad2、Smad3、Smad7 和SnoN表達 將凍存于-80 ℃冰箱的肺組織取出備用,使用RIPA 裂解液將細胞裂解,按說明書步驟配制總蛋白溶液,置于組織勻漿器中,13 800 r/min, 離心15 min 離心半徑6 cm,取上清液,使用BCA 試劑盒測定蛋白質濃度。 取總蛋白上樣、電泳分離、切膠,轉至PVDF 膜上,5%脫脂牛奶封閉2 h,加入TGF-β1 一抗(1∶1000)、Smad2 一抗(1∶1000)、Smad3 一抗(1∶1000)、Smad7一抗(1∶1000)、p-Smad2 一抗(1∶1000)、p-Smad3一抗(1∶1000)、p-Smad7 一抗(1∶1000)、GAPDH一抗(1∶1000),4 ℃搖床過夜;PBST 洗膜, 加二抗(1∶20 000),4 ℃搖床過夜,PBST 洗膜, ECL 發光試劑盒顯色、顯影,以GAPDH 為內參蛋白,采用目標蛋白條帶灰度值/GAPDH 條帶灰度值來表示目的蛋白相對表達水平。
2.2.5 統計分析 采用SPSS 21.0 進行數據分析。計量資料以“±s”表示,兩組間比較采用獨立樣本t檢驗,多組間比較使用單因素方差分析,P<0.05 為差異有統計學意義。
3 結果
3.1 降糖通脈方治療糖尿病肺損害的網絡藥理學機制分析
3.1.1 降糖通脈方活性成分篩選 通過TCMSP、BATMAN-TCM 數據庫對女貞子、黃連、川芎的活性成分進行檢索,并以OB>30%和DL≥0.18 為限制條件進行篩選,其中得到川芎8 種有效活性成分、黃連14 種有效活性成分、女貞子14 種有效活性成分。詳見表1。
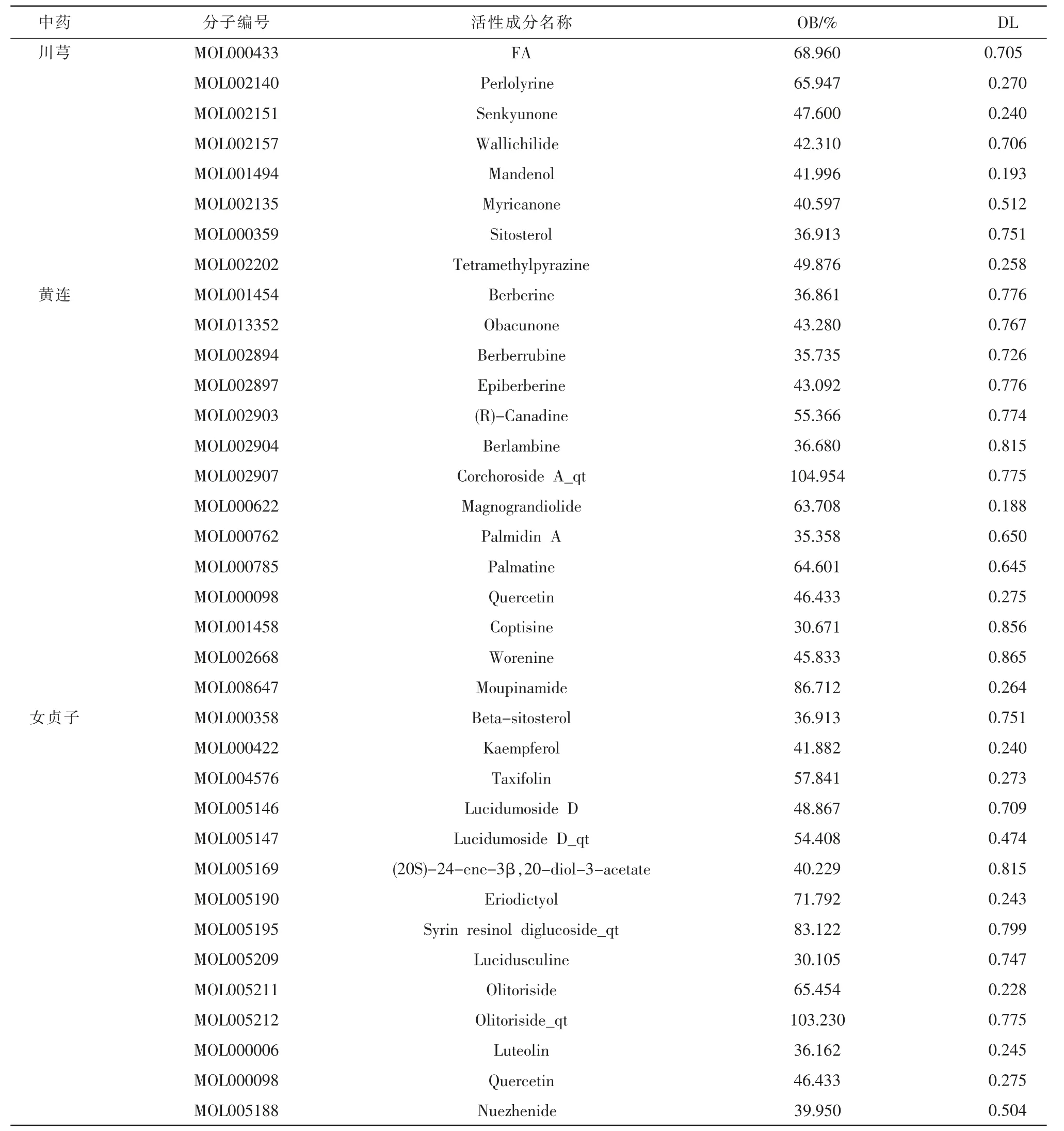
表1 有效活性成分信息表
3.1.2 糖尿病肺損害的疾病靶點篩選 通過檢索GeneCards 數據庫得到2 型糖尿糖肺損害的疾病治療靶點,刪去重復靶點后共得到584 個與2 型糖尿病肺損害的疾病治療靶點。
3.1.3 共同靶點篩選及PPI 網絡構建 得到的109個藥物活性成分靶點與584 個相關疾病靶點,分別導入在線韋恩圖制作網站InteractiVenn,相匹配映射得到降糖通脈方治療2 型糖尿病肺損害的潛在作用靶點共95 個,藥物有效活性成分-疾病交集靶點Venny 圖(圖1)。 將95 個潛在靶基因導入STRING在線分析網站(https://string-db.org/),設置隱藏未連接的靶點,設定最低互作評分中的“highest confidence>0.900”,并導出PPI 結果數據(圖2)。進一步通過Cytoscape 3.7.2 軟件得到潛在靶基因的PPI,運用其中的cytoHubba 插件篩選Hub 基因,使用Degree算法,得出排名前20 位潛在核心靶基因(圖3)。
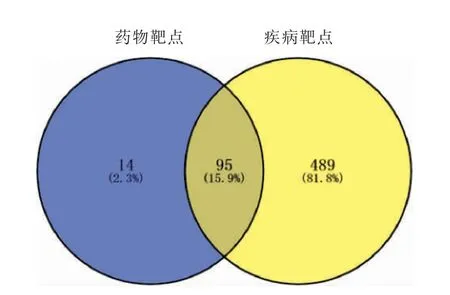
圖1 藥物活性成分靶點與2 型糖尿病肺損害疾病靶點Venny 圖
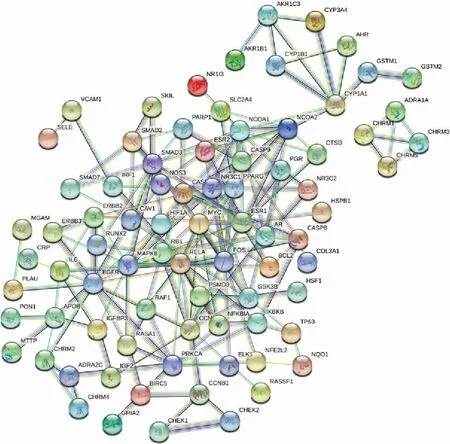
圖2 共同靶點的PPI 網絡圖
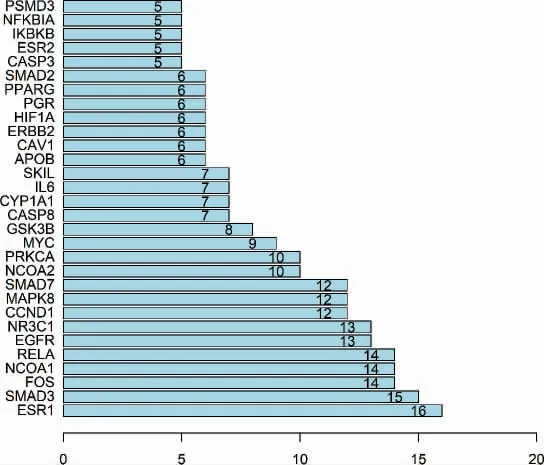
圖3 Degree 值排名前20 的靶點
3.1.4 活性成分-肺損害-靶點互作網絡構建 采用Cytoscape 3.7.2 軟件在中藥活性成分-2 型糖尿病肺損害-靶點互作網絡圖中,共獲得121 個節點、415 條邊(靶點95 個,活性成分24 個)(圖4)。

圖4 中藥活性成分-2 型糖尿病肺損害-靶點互作網絡
3.1.5 藥物治療糖尿病肺損害的生物功能(GO)分析及核心通路篩選 運用R 語言中的Bioconductor包、clusterProfiler 包對24 個中藥活性成分-疾病交集靶點進行GO 和KEGG 富集分析,結果顯示:95個潛在靶基因GO 分析可見其主要富集于DNA-轉錄因子結合、蛋白質異二聚化活性、配體激活的轉錄因子活性、SMAD 結合等(圖5)。 而KEGG 富集分析發現其主要集中于糖尿病并發癥中的TGF-β 信號通路、AGE-RAGE 信號通路以及TNF 信號通路等(圖6)。并對“3.1.3”中篩選得到的核心靶基因Smad2、Smad3、Smad7、Skil 相關蛋白(Ski-related novel protein,SnoN)中富集的信號通路進行展示,利用Cytoscape
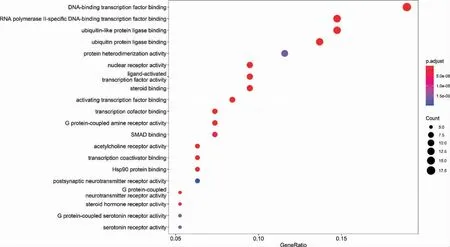
圖5 GO 生物功能分析氣泡圖
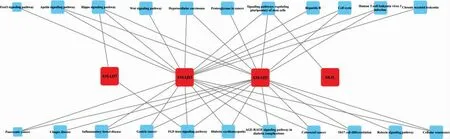
圖6 KEGG 富集分析氣泡圖
3.7.2 軟件構建核心靶基因-信號通路互作網絡圖(圖7)。

圖7 核心靶點與2 型糖尿病相關性肺損害信號通路之間的關系
3.2 降糖通脈方對糖尿病肺損害大鼠的干預作用
3.2.1 各組糖尿病大鼠肺組織病理結構的變化 NC組大鼠肺組織結構正常。 與NC 組相比,DM 組的肺泡腔減少,肺泡腔增厚,部分肺泡腔萎縮甚至塌陷,有大量炎性細胞滲透,纖維組織增生。 與DM 組相比,JTTM 各劑量組和Met 組均有明顯改善。 隨著JTTM 劑量的增加,肺組織損害明顯改善,炎癥細胞浸潤減少,纖維組織增生減少,肺泡間距恢復正常。詳見圖8。
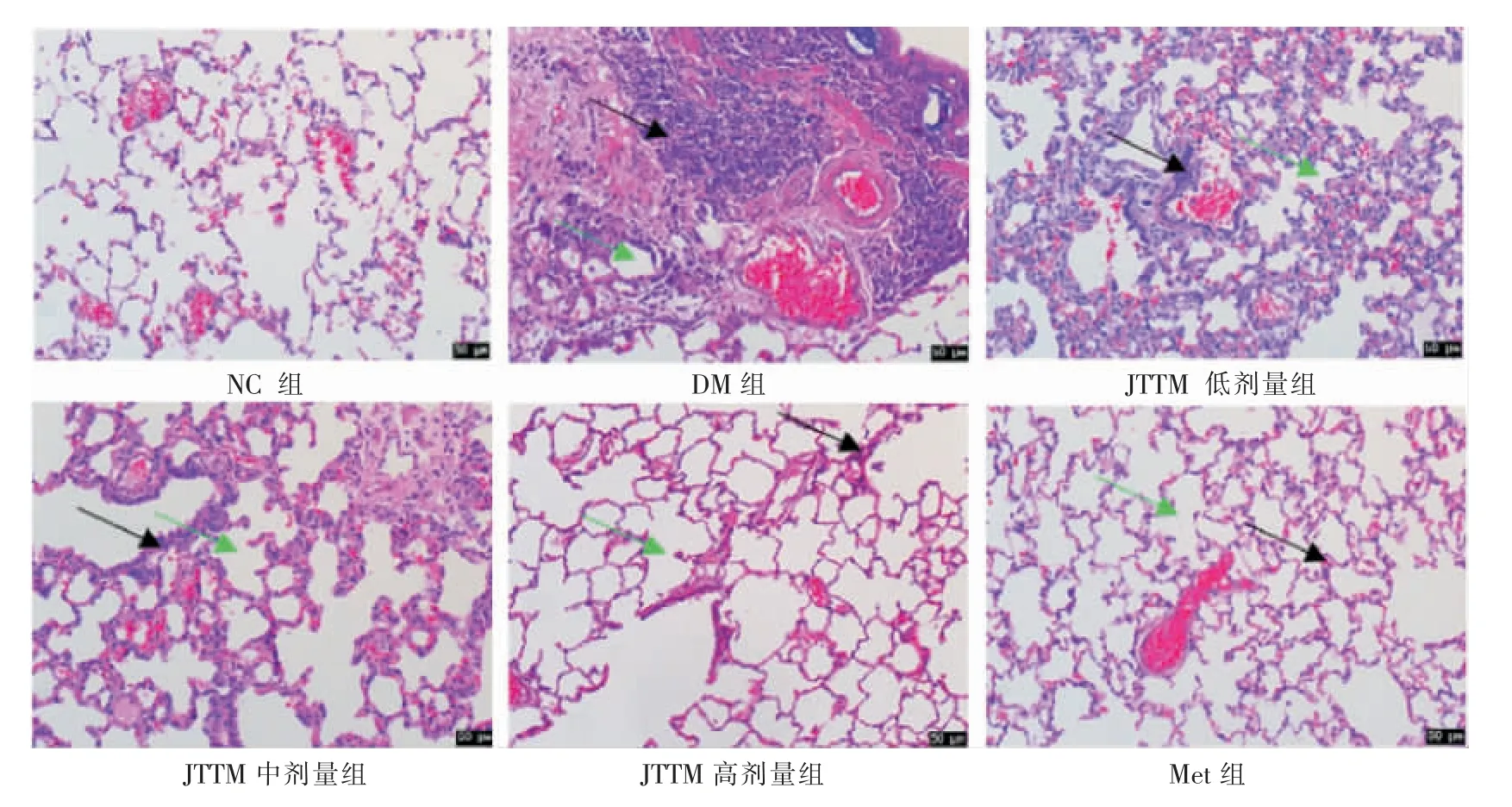
圖8 各組大鼠肺組織HE 染色病理結構改變(200×)
3.2.2 各組TGF-β1/Smads 信號通路上的相關蛋白表達 與NC 組相比,DM 組的Smad2、Smad3 和Smad7差異無統計學意義(P>0.05),而p-Smad2 和p-Smad3 在DM組中顯著升高(P<0.01)。 p-Smad2 和p-Smad3 在JTTM 組和Met 組中的表達均較DM 組降低(P<0.05)。隨著JTTM 劑量的增加,p-Smad2 和p-Smad3 表達水平顯著降低(P<0.05)。 而p-Smad7在DM 組中的表達低于NC 組,JTTM 組和Met 組p-Smad7 水平高于DM 組,隨著JTTM 劑量的增加,p-Smad7 表達水平顯著升高(P<0.05)。 DM組SnoN的表達低于NC 組(P<0.01),但JTTM 組和Met 組SnoN 表達較DM 組增加(P<0.05),與p-Smad7 的表達相一致。 與DM 組相比,JTTM 各劑量組中TGFβ1 降低(P<0.05)。 詳見圖9。

圖9 各組大鼠TGF-β1/Smads 信號通路上的相關蛋白表達
4 討論
現代研究認為,糖尿病引起的免疫功能下降、氧化應激和微血管病變均可導致肺損害,高血糖會導致肺泡慢性損傷,而細胞外基質(ECM)沉淀增多,破壞肺泡的正常結構,使其順應性降低,最終導致肺通氣和彌散功能喪失而危及生命[9]。 中醫學認為其病位在肺,涉及脾腎,屬本虛標實之證,本虛以肺脾腎虧虛為主,而陰虛血瘀貫穿糖尿病微血管病變始終,在治療糖尿病肺損害的過程中以滋陰化瘀為主要治法[10]。 降糖通脈方以女貞子滋陰、黃連清熱、川芎活血化瘀,標本兼顧,共奏滋陰化瘀之效,與糖尿病肺損害的病機對應。
通過網絡藥理學的研究方法,建立了“化合物-靶點”的關系網絡,為降糖通脈方多成分的復雜性、多靶點的不確定性、多通路的交叉性提供了科學依據。由“3.1.4”可知降糖通脈方的活性成分中阿魏酸、川芎嗪、小檗堿和女貞苷等與糖尿病肺損害的關系程度明顯高于其他。 研究表明,川芎提取物對STZ誘導的糖尿病大鼠具有明顯降血糖作用[11]。 阿魏酸通過抑制JAK2/STAT6 免疫信號通路抑制肺癌細胞增殖和轉移[12]。 川芎嗪可有效阻斷大鼠氣道壁中Ⅲ型膠原的合成,抑制網狀基底膜層增厚,進而抑制氣道重塑早期纖維化的發生[13]。 小檗堿通過cAMP/GP 信號通路可改善2 型糖尿病小鼠的肝糖原結構,修復受損糖原結構以調節肝糖代謝,從而發揮降糖作用[14]。 小檗堿可能通過與AngⅡ誘導IL-1β/NF-κB 通路介導的促炎性反應顯著降低2 型糖尿病小鼠血糖[15]。 黃連素可抑制LPS 刺激下大鼠Ⅱ型肺泡上皮細胞促凝及纖溶抑制相關因子表達凝和纖溶抑制[16]。 女貞苷通過提高細胞中AMP 與ATP 濃度的比值激活AMPK 通路從而促進脂聯素的高聚化,而脂聯素的高聚化對于提高葡萄糖耐受性和胰島素敏感性具有重要意義[17]。女貞子通過上調T-bet 基因表達和下調GATA3 基因表達, 調節Th1/Th2 之間的平衡,抑制IgE 生成和炎性細胞因子表達,減輕肺和氣道的炎癥反應[18]。由此可以發現,降糖通脈方的活性成分在治療糖尿病肺損害方面可能發揮了重要的作用。
根據網絡藥理學PPI 網絡分析篩選得到的核心基因Smad2、Smad3、Smad7、SnoN(Skil)等靶點與文獻報道相一致[19]。 GO 生物功能分析中,與降糖通脈方作用靶點即相關聯的有DNA-轉錄因子結合、蛋白質異二聚化活性、 配體激活的轉錄因子活性、Smad 結合等。 KEGG 信號通路分析得出,降糖通脈方作用靶點主要通過TGF-β 信號通路、AGERAGE 信號通路以及TNF 信號通路等干預糖尿病肺損害,同時也與糖尿病其他微血管并發癥存在密切的關系[20]。
通過數據庫及文獻篩選,降糖通脈方中共得到36 個活性分子、作用靶點有109 個,其中與糖尿病肺損害相關的作用靶點有95 個。 PPI 網絡中主要節點有Smad2、Smad3、Smad7、SnoN(Skil)等。分析結果顯示,降糖通脈方主要通過蛋白質異二聚化活性、配體激活的轉錄因子活性、Smad 結合等BP 參與糖尿病肺損害,通過TGF-β 信號通路、AGE-RAGE信號通路以及TNF 信號通路等干預糖尿病肺損害。前期研究發現,此方可以下調TGF-β1 基因表達來干預糖尿病血管損害[21-22]。相關研究也表明,SnoN(Skil)和TGF-β1/Smads 通路與糖尿病肺損害最為密切,可能是其危險因素或共用信號通路[23]。
動物實驗結果表明,DM 組肺組織病理結果發現大鼠肺組織的肺泡腔縮小,炎性細胞浸潤,肺泡腔被破壞增厚,大量膠原纖維增生,顯示早期肺纖維化表現,這與文獻報道的糖尿病肺損害大鼠肺組織病理結果是一致的[24-26]。隨著JTTM 藥物干預劑量的增加,各炎癥因子的表達逐漸減少,降糖通脈方可以減輕糖尿病肺損害,有助于糖尿病肺損害的治療和預后。Smads 作為TGF-β1 家族的下游信號分子,也是TGF-β1 的唯一底物[27]。 在外界刺激下,TGF-β1 受體Ⅰ直接磷酸化Smad2 和Smad3,最后與Smad4 形成三聚體,并在內部轉移到細胞核參與調節靶基因轉錄[28]。 Smad7 是一個抑制Smads 的蛋白,可降低TGF-β1 的表達,通過負反饋調節TGF-β1 信號轉導,對糖尿病肺組織起到保護作用[29]。
本研究表明,DM 組TGF-β1 蛋白水平明顯高于NC 組,提示糖尿病肺損害與TGF-β1 的過度表達密切相關。 糖尿病大鼠Smad2/3 表達增加、Smad7表達降低,提示TGF-β1 參與糖尿病的肺損害的機制是上調Smad2/3 的表達和下調Smad7 表達。 各組經JTTM 干預后,Smad2/3 表達降低、Smad7 表達上調[30-32]。SnoN 蛋白屬于Ski 蛋白家族,它最重要的功能是通過結合Smad 蛋白相互作用,以負向調控TGFβ1 信號轉導,有效抑制糖尿病肺損害的發生[33]。 未受TGF-β1 刺激時,SnoN 蛋白與Smad4 結合在DNA 特異性結合位點(Smad binding element, SBE)上,SBE 是Smad2、Smad3、Smad4 多聚體與Smad7基因啟動因子的結合位點;反之,SnoN 會與SBE 分離,而Smad2、Smad3、Smad4 多聚體與SBE 結合,使負調控因子Smad7 基因的轉錄蛋白啟動,Smad7 表達增多從而抑制TGF-β1 信號傳導[34-35]。 在本研究中,當糖尿病肺損害發生時,TGF-β1/Smads 信號通路與SnoN 蛋白相互作用,可以抑制炎癥信號。
綜上所述,本研究通過網絡藥理學預測降糖通脈方治療糖尿病肺損害的作用機制,并通過動物實驗對降糖通脈方治療糖尿病肺損害的作用效果和潛在的信號通路進行驗證,為中醫藥治療糖尿病肺損害提供了新的思路。

