基于網(wǎng)絡(luò)藥理學(xué)探討侗藥血水草活性成分抗腫瘤的作用機制*
梁 沛 胡芷茵 楊翠玉 周小強 周永濤 周 群
湖南醫(yī)藥學(xué)院,湖南省懷化市 418000
腫瘤被認(rèn)為是全世界的醫(yī)學(xué)難題之一,一直以來腫瘤疾病對人類的身心健康造成著嚴(yán)重的危害。腫瘤疾病有著發(fā)病機制復(fù)雜、治療效果差及復(fù)發(fā)轉(zhuǎn)移率高等一系列問題。由世衛(wèi)組織公布的全球癌癥報告數(shù)據(jù)顯示,全球癌癥患者和死亡病例每年都在呈上升趨勢,腫瘤疾病被認(rèn)為是人類死亡的重要因素之一[1]。一直以來天然產(chǎn)物在抗腫瘤方面具有一定的潛力與優(yōu)勢[2],隨著中醫(yī)藥在臨床實踐的應(yīng)用,其在治療腫瘤疾病方面取得的作用不斷突顯。血水草(Eomecn chionantha Hance)為罌粟科多年生草本植物,侗藥地方名為娘嫩帕(Nyangt naemx padt)主要分布于湖南、廣西、貴州交界的山區(qū)地帶,是侗族地區(qū)特有的藥用植物,侗藥血水草常生于溝邊或低平濕地,其形態(tài)為多年生草本,含紅黃色汁液,根狀莖橫生,葉基生,具長柄;葉片卵狀心形;花瓣4個,白色;果實為朔果,種子多數(shù)。侗族人常用于跌打損傷、毒蛇咬傷、便血痢疾等疾病的治療。現(xiàn)代研究表明,血水草活性成分主要為生物堿類,包括血根堿、白屈菜紅堿、原阿片堿、別隱品堿等活性成分[3-4],具有抗炎、抗菌、抗腫瘤等作用。目前侗藥血水草在抗腫瘤方面的研究不多,作用機制尚不明確。本研究主要基于網(wǎng)絡(luò)藥理學(xué)的方法,挖掘與預(yù)測侗藥血水草活性成分與抗腫瘤靶點之間的聯(lián)系,構(gòu)建藥物成分—關(guān)鍵靶點—通路之間的相互作用網(wǎng)絡(luò),揭示侗藥血水草抗腫瘤的作用機制,從而為侗藥血水草在治療腫瘤疾病方面提供新的研究思路及依據(jù)。
1 材料與方法
1.1 數(shù)據(jù)庫及軟件 TCMSP數(shù)據(jù)庫(http://tcmspw.com/tcmsp.php);PubChem數(shù)據(jù)庫(https://pubchem.ncbi.nlm.nih.gov/); SwissTargetPrediction數(shù)據(jù)庫(http://www.swisstargetprediction.ch/);GeneCards 數(shù)據(jù)庫(https://www.genecards.org/)和Draw Venny Diagram(http://bioinformatics.psb.ugent.be/webtools/Venn/); STRING(https://string-db.org/);生物信息注釋數(shù)據(jù)庫(DAVID,https://david.ncifcrf.gov/);軟件:Cytoscape3.7.1和R語言。
1.2 活性成分、藥物及腫瘤相關(guān)基因的篩選 TCMSP數(shù)據(jù)庫根據(jù)口服生物利用度(OB)≥25%、類藥性(DL)≥0.18的標(biāo)準(zhǔn)驗證前期從侗藥血水草中分離得到的生物堿類化合物是否具有藥效活性。利用PubChem 數(shù)據(jù)庫在搜索框內(nèi)分別輸入4種化合物的英文名稱,獲得4種化合物的化學(xué)結(jié)構(gòu)式和canonical SMILES 結(jié)構(gòu)式輸入 SwissTargetPrediction 平臺預(yù)測化合物的相關(guān)基因。以 “tumour”為關(guān)鍵詞在GeneCards 數(shù)據(jù)庫中搜索腫瘤相關(guān)靶點基因。使用Venny2.1.0軟件獲取兩者的交集靶點基因,即為化合物作用于腫瘤的交集靶點基因。
1.3 PPI網(wǎng)絡(luò)構(gòu)建及Hub基因篩選 運用 STRING數(shù)據(jù)庫,選用 Multiple proteins工具,限定物種為人,獲取化合物與疾病的交集靶點基因的蛋白互作網(wǎng)絡(luò)(PPI),將其保存為TSV 格式文件。應(yīng)用Cytoscape3.7.1軟件對TSV格式文件內(nèi)容進(jìn)行可視化的分析,且通過“Network tools”進(jìn)行網(wǎng)絡(luò)拓?fù)鋮?shù)分析,以節(jié)點BetweennessCentrality,ClosenessCentrality,degree 值均大于三者中位數(shù)作為Hub基因的篩選標(biāo)準(zhǔn), Cytoscape3.7.1軟件構(gòu)建“藥物成分—關(guān)鍵靶點—疾病”三者的相互關(guān)系網(wǎng)絡(luò)。
1.4 GO生物功能和KEGG通路富集分析 使用DAVID6.8數(shù)據(jù)庫對Hub基因進(jìn)行GO生物功能 和 KEGG 通路富集分析,以P<0.05 為篩選條件。 在DAVID的Functional Annotation模塊進(jìn)行富集分析。選擇物種參數(shù)為homo sapiens,標(biāo)識符參數(shù)為official gene symbol,列表類型參數(shù)為gene list,其余參數(shù)為默認(rèn)值。獲得生物過程(BP)分子功能(MF)和細(xì)胞組分(CC)的富集結(jié)果。同時KEGG通路富集分析,得到藥物治療腫瘤的顯著富集信號通路。
2 結(jié)果
2.1 活性成分及靶點預(yù)測前期通過分離侗藥血水草得到了的4個生物堿類活性成分血根堿、原阿片堿、別隱品堿、白屈菜紅堿,在TCSMP數(shù)據(jù)庫中進(jìn)行藥效活性篩選,結(jié)果為這4個化合物都符合要求(表1)。藥物靶點預(yù)測數(shù)據(jù)庫獲得4個活性成分的靶點共計239個,疾病靶點預(yù)測數(shù)據(jù)庫獲得腫瘤對應(yīng)的靶點為9 910個,兩者取交集得到199個交集基因(見圖1)。

表1 活性成分參數(shù)列表
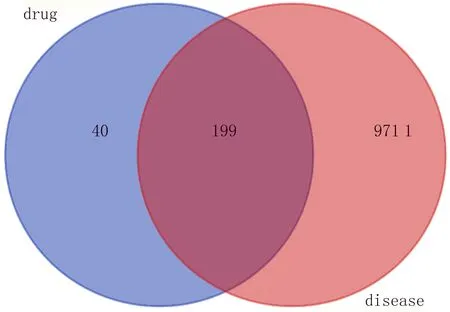
圖1 化合物與腫瘤靶點的venn圖
2.2 PPI網(wǎng)絡(luò)構(gòu)建及hub基因 將交集靶點導(dǎo)入STRING數(shù)據(jù)庫中得到PPI網(wǎng)絡(luò),其中相關(guān)節(jié)點有PTGS2、PTGS1、BTK、SIRT1、BCL2、MTOR、MAPK8、CHEK1、AR、HCRTR2、DRD2、AGTR1等,并對其進(jìn)行網(wǎng)絡(luò)分析,篩選得到Betweenness Centrality(0.002 1),ClosenessCentrality(0.442 4),degree(15)3個拓?fù)鋮?shù)均大于所有節(jié)點中位數(shù)的靶點共計66個,即為網(wǎng)絡(luò)的Hub節(jié)點(關(guān)鍵基因),其中主要的節(jié)點有HSPOAA1、MAPK1、MTOR、SRC、PIK3CA、SIRT1、PTGS2、CSNK2A1、SLC9A1、TYMS,這些基因可能是對腫瘤起主要治療作用的靶點(Degree值排名前十的靶點,如表2所示)。然后將篩選后得到的靶點利用Cytoscape 3.7.1 軟件,構(gòu)建血水草活性成分治療腫瘤“成分—靶點—疾病”網(wǎng)絡(luò)圖,并進(jìn)行可視化分析,結(jié)果反映血水草活性成分對腫瘤的治療作用與HSP90AA1等基因密切相關(guān)。

表2 4種藥物與腫瘤核心靶點的相關(guān)拓?fù)鋮?shù)
2.3 GO生物功能富集分析 DAVID 數(shù)據(jù)庫進(jìn)行 GO 生物功能富集分析,共獲得323個富集結(jié)果,利用R語言對富集結(jié)果排名前十的功能進(jìn)行了可視化編輯(見圖2),其中生物過程(BP) 主要包括pro-tein phosphorylation,peptidyl-serine phosphorylation,response to drug,protein autophosphorylation等;細(xì)胞組分(CC) 主要包括cytosol,plasma membrane,mitochondrion,phosphatidylinositol 3-kinase complex等;分子功能(MF)主要包括protein binding,ATP binding,protein kinase activity,kinase activity,protein serine/threonine kinase activity等。
2.4 KEGG 通路富集分析 運用DAVID 數(shù)據(jù)庫進(jìn)行了KEGG通路富集分析,結(jié)果共獲得了92條信號通路,利用R語言對這些通路富集的結(jié)果進(jìn)行了可視化展示,這些通路主要涉及Pathways in cancer(癌癥通路)、Proteoglycans in cancer(癌癥中的蛋白多糖)、Neurotrophin signaling pathway(神經(jīng)營養(yǎng)因子信號通路)、Prostate cancer(前列腺癌)等,這可能是血水草生物堿類活性成分參與發(fā)揮抗腫瘤作用的主要調(diào)控途徑(見圖3)。
3 討論
Hopkin首次提出了網(wǎng)絡(luò)藥理學(xué)的概念,開啟了一種全新的研究模式。網(wǎng)絡(luò)藥理學(xué)是融合生物學(xué)的研究方法,借助信息網(wǎng)絡(luò)學(xué)、藥理學(xué)、統(tǒng)計學(xué)等學(xué)科,構(gòu)建藥物—成分—靶點—疾病之間的相互關(guān)系,闡明并詮釋藥物多成分與疾病之間的網(wǎng)絡(luò)關(guān)系,打開了藥物與疾病研究模式的新視角[5-6]。網(wǎng)絡(luò)藥理學(xué)系統(tǒng)整體地揭示藥物與靶蛋白作用對疾病的影響,成為發(fā)展創(chuàng)新藥物的重要途徑,具有重要的理論和實際應(yīng)用價值。近年來網(wǎng)絡(luò)藥理學(xué)被應(yīng)用于多種領(lǐng)域,尤其在中醫(yī)藥研究中的應(yīng)用日漸凸顯,在治療腫瘤疾病的研究中也取得了廣泛進(jìn)展,突出了在分子層面闡明多靶點、多通路的特點[7]。中藥單體在腫瘤藥物方面的研發(fā)越來越受到重視,以網(wǎng)絡(luò)藥理學(xué)為契機開拓一條中藥單體與疾病之間機制研究的新路徑。
目前對血水草的研究發(fā)現(xiàn)生物堿類活性成分具有抗腫瘤活性,但具體機制還有待進(jìn)一步闡明。本研究分析發(fā)現(xiàn)侗藥血水草生物堿類活性成分發(fā)揮抗腫瘤作用的信號通路主要集中在癌癥通路、癌癥中的蛋白多糖、神經(jīng)營養(yǎng)因子信號通路等,這些途徑與腫瘤的發(fā)生發(fā)展直接有關(guān)。有研究報道血根堿對腫瘤細(xì)胞具有抗炎、抗氧化、促進(jìn)凋亡及抑制生長的作用[8]。血根堿通過調(diào)控MMP-2、MMP-9、cyclinD、CDK4蛋白的表達(dá),抑制胃癌細(xì)胞的增殖,降低細(xì)胞的遷移[9],還能經(jīng)MAPK/JNK途徑抑制胃癌細(xì)胞增殖[10]。血根堿參與調(diào)控乳腺癌缺氧誘導(dǎo)通路,通過抑制MAPK/ERK/HIF-1α通路的激活抑制腫瘤的生長[11]。血根堿還能通過PI3K/AKT/MTOR通路抑制卵巢癌的發(fā)生[12]。原阿片堿在抑制腫瘤細(xì)胞生長和誘導(dǎo)腫瘤細(xì)胞凋亡方面表現(xiàn)出一定的優(yōu)勢,原阿片堿分別可以通過激活線粒體凋亡通路[13]及P53途徑[14],抑制PI3K/AKT通路[15]參與抗腫瘤細(xì)胞的生長。有報道稱白屈菜紅堿通過調(diào)節(jié)MMP/TIMP系統(tǒng)抑制NF-κB通路從而抑制人前列腺癌細(xì)胞的增殖和轉(zhuǎn)移[16],且鹽酸白屈菜紅堿通過PI3K/AKT/MTOR/BAD信號通路引發(fā)線粒體凋亡達(dá)到抑制HeLa 細(xì)胞增殖的作用[17]。目前別隱品堿抗腫瘤的研究國內(nèi)外文獻(xiàn)報道甚少,可在網(wǎng)絡(luò)藥理學(xué)分析的基礎(chǔ)上進(jìn)一步展開新的研究。由此可見血水草生物堿類活性成分在抑制腫瘤細(xì)胞的生長、遷移方面主要與MAPK、PI3K通路、線粒體凋亡通路有著密切的聯(lián)系,也是目前研究較多的方向。
另外,本研究對血水草活性成分進(jìn)行檢索分析,運用網(wǎng)絡(luò)藥理學(xué)方法共收集到活性成分的靶點239個;疾病靶點9 910個;藥物成分和疾病的交集靶點199個,活性成分和腫瘤的關(guān)鍵核心靶點有HSP90AA1、MAPK1、MTOR、APP等。其中有研究指出HSP90AA1可作為預(yù)測癌癥發(fā)生和轉(zhuǎn)移風(fēng)險的指標(biāo)[18],提示HSP90AA1是在腫瘤發(fā)生過程起著重要的作用。APP 在癌細(xì)胞中過表達(dá),與DR6結(jié)合可啟動壞死凋亡途徑導(dǎo)致腫瘤細(xì)胞外滲和轉(zhuǎn)移[19]。MAPK1和MTOR可調(diào)節(jié)細(xì)胞的生長、存活、代謝、分化、蛋白質(zhì)合成等多種生物學(xué)過程,在癌癥的發(fā)生發(fā)展中起到了關(guān)鍵作用[20-22],有研究已經(jīng)證實血水草生物堿類活性成分通過調(diào)控MAPK、MTOR抑制腫瘤細(xì)胞的生長。但是目前血水草生物堿類活性成分通過調(diào)控HSP90AA1、APP參與癌癥發(fā)生的相關(guān)研究還較少,我們可以通過對關(guān)鍵核心靶點進(jìn)行深入研究,進(jìn)一步探索在抗腫瘤方面的機制與作用。
通過對侗藥血水草抗腫瘤作用的網(wǎng)絡(luò)藥理學(xué)研究分析發(fā)現(xiàn),血水草生物堿類活性成分通過多靶點、多通路發(fā)揮抗腫瘤的作用,為下一步實驗驗證血水草活性成分抗腫瘤作用機制提供科學(xué)理論依據(jù)與新思路,同時為民族藥的藥理機制研究提供新的方向。

