50例晚期惡性腫瘤患者免疫治療副反應的臨床觀察
葉蘊瑤,韓高華,徐 潔,李祎萍,張思慧
(泰州市人民醫院 腫瘤科,江蘇 泰州 225300)
免疫檢查點抑制劑是惡性腫瘤治療的重要突破,特別是對于晚期腫瘤而言,它改變了惡性腫瘤的治療模式,提高了患者的生存期。但會引起一系列自身免疫性疾病和炎癥性疾病,即免疫治療相關副反應(irAEs)[1]。
針對程序性死亡蛋白1(programmed cell death 1,PD-1)/程序性死亡蛋白配體1(programmed cell death ligand 1,PD-L1)抑制劑是目前臨床最常用的免疫檢查點抑制劑,在使用抗PD-1/PD-L1抗體治療的患者中,任何級別和高級別的irAEs發生率分別為64%和15~20%[2],它可以累及任何一個器官或系統,內分泌腺、胃腸道、肺、皮膚、肝臟最常受累,中樞神經系統、心血管、腎臟、眼較少受累[3]。irAEs大多是短暫和輕微的,且較傳統化療而言,發生率相對較低,暫停ICI治療和免疫抑制可以成功逆轉多數副反應,但某些副反應,如免疫性心臟毒性、免疫性神經毒性,間質性肺炎致死率較高,可導致器官功能的永久損害,死亡率高達45%[4]。irAEs的臨床特征相對隱匿,影像學改變不典型,早期難以發現,但進展迅速。特別是在目前免疫聯合治療模式廣泛應用的背景下,某些癥狀體征往往被忽略或遮蓋。因此,臨床醫生了解irAEs的表現形式、臨床演變,對于早期發現、早期干預,避免嚴重副反應的發生至關重要。
本研究納入了近2年我科收治的采用免疫聯合治療或免疫單藥治療的晚期惡性腫瘤患者,分析了irAEs的類型及發生率,采取的治療措施及其預后。
1 材料與方法
1.1 臨床資料選取2020年1月~2022年1月我科行免疫聯合治療或單免疫治療的50例患者,肺癌13例(其中小細胞肺癌3例,非小細胞肺癌10例),食管癌9例,腎癌2例,膽管癌1例,胰腺癌3例,乳腺癌3例,卵巢癌2例,惡性黑色素瘤4例,肝細胞肝癌5例,胃癌5例,結腸癌3例。所有患者均為惡性腫瘤晚期,基線檢查排除免疫治療禁忌,ECOG評分0~2分。
1.2 方法本研究納入患者采用免疫聯合治療(化療或靶向治療)或行免疫單藥治療,直至病情進展或不可耐受副反應。均采用PD-1治療,包括特瑞普利單抗、信迪利單抗、卡瑞利珠單抗、帕博利珠單抗。采用的免疫治療方式為特瑞普利單抗240mg靜滴q3w(15例),信迪利單抗200mg靜滴q3w(7例),卡瑞利珠單抗靜滴200mg q3w(16例),帕博利珠單抗靜滴200mg(12例)。結合患者臨床檢查及既往病史,排除其他藥物(化療及靶向)引起的不良反應。
2 結果
本組患者的中位年齡為52歲(32~83歲),男性38名(76%),所有患者均為IV期,有胸部放療史5例(10%),行二線或三線治療46例、一線治療4例,采用單藥PD-1單藥共12例,采用PD-1聯合化療13例,PD-1聯合靶向治療25例。接受免疫治療的中位治療時間為8.3周期。50例接受免疫治療的患者中,20例出現irAEs,其中特瑞普利單抗有5例出現irAEs,發生率為33.3%(5/15),卡瑞利珠單抗有8例出現irAEs,發生率為50%(8/16),帕博利珠單抗有3例出現irAEs,發生率為25%(3/12),信迪利單抗有4例出現irAEs,發生率為57.1%(4/7)。在研究總人群中,13例(26%)出現甲狀腺功能減退,3例(6%)免疫性肺炎,1例(2%)免疫性肝炎,1例(2%)III°房室傳導阻滯,1例(2%)糖尿病酮癥酸中毒,1例(2%)動眼神經炎,7例(14%)出現反應性毛細血管增生癥,均為卡瑞利珠單抗所致。甲狀腺功能減退出現的中位時間為ICI治療后10周,予以左旋甲狀腺素片對癥治療同時繼續免疫治療患者耐受性好。3例出現免疫性肺炎者均有胸部放療史。2例為II級免疫性肺炎,經積極抗感染、激素治療后好轉未再行免疫治療。1例為IV級免疫性肺炎,因呼吸困難入院,入院即出現呼吸衰竭,病情進展迅速,入院當日患者死亡,見圖1。1例采用單藥免疫治療,ICI治療7周后出現免疫性肝炎,經大劑量激素治療后好轉,6周后恢復免疫治療,耐受性良好。1例免疫性心肌炎,在首次ICI治療后4周出現,心電圖示III°房室傳導阻滯,經大劑量激素及心臟起搏器置入治療后好轉,永久停用免疫治療,見圖2。1例患者基線無糖尿病,治療22周后(單藥免疫維持階段)出現糖尿病酮癥酸中毒,經積極補液等支持治療后好轉,持續使用胰島素控制血糖,4周后恢復免疫治療,耐受性良好。1例患者ICI治療后22周出現動眼神經炎,表現為復視,右眼球運動受限,經激素、營養神經等對癥處理后癥狀好轉繼續免疫治療。具體見表1。
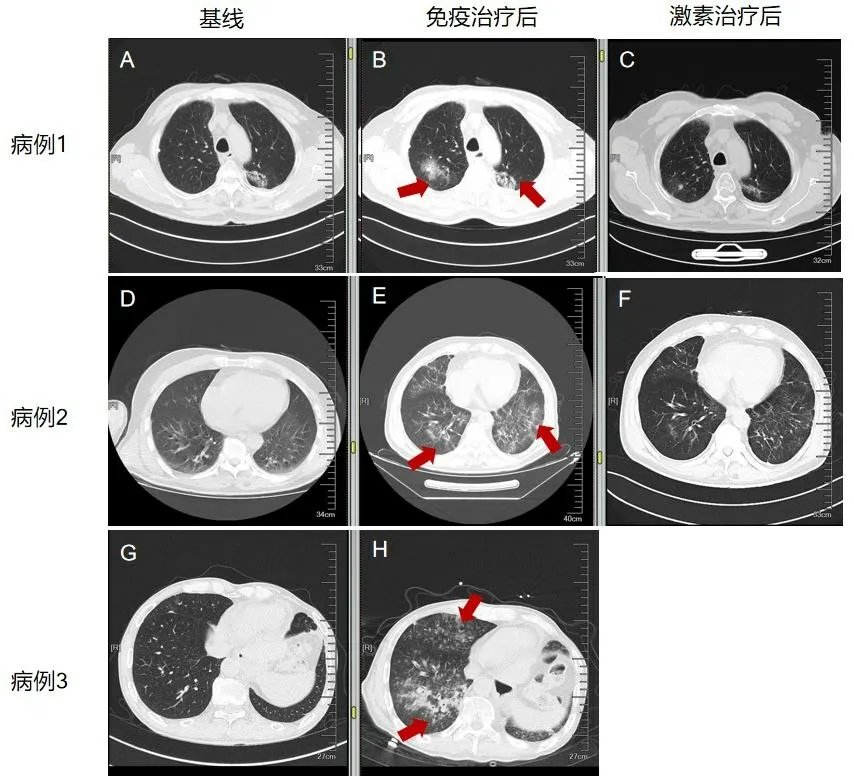
圖1 3例免疫性肺炎胸部CT
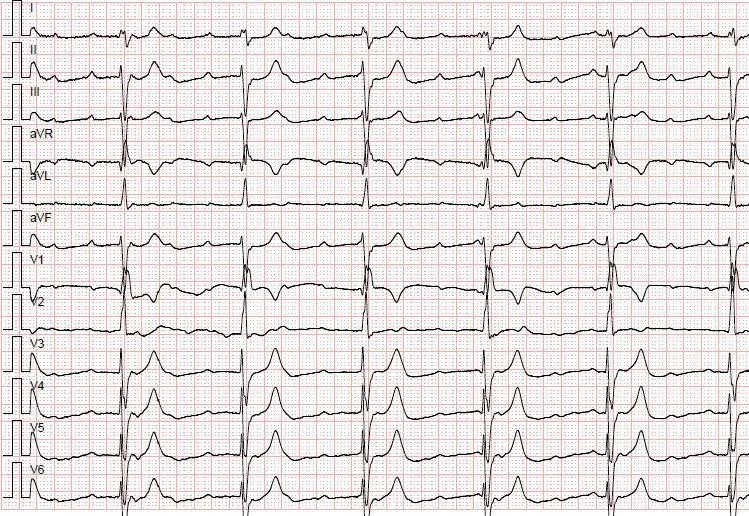
圖2 1例免疫性心肌炎
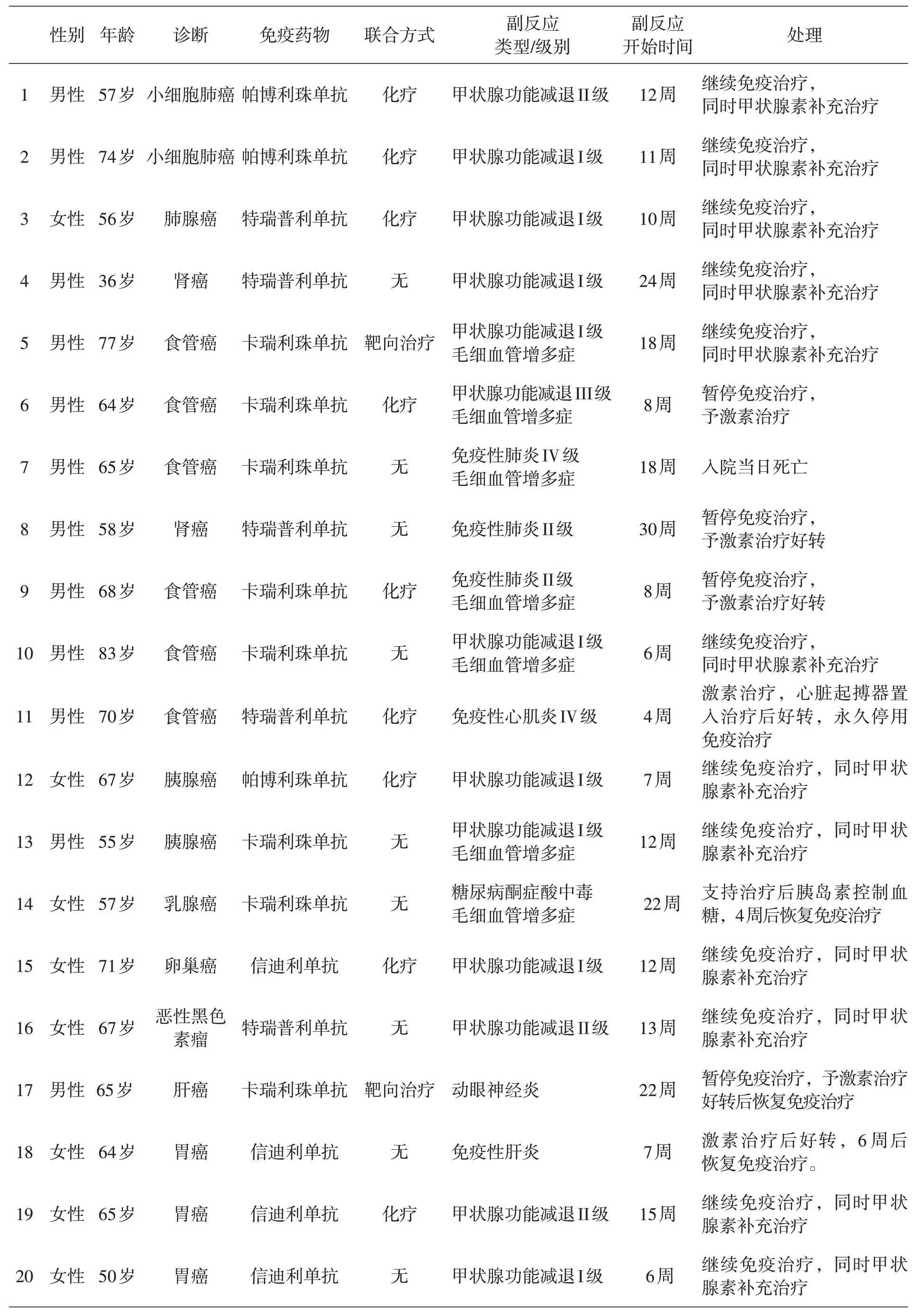
表1 20例免疫相關副反應患者臨床特征
3 討論
免疫檢查點抑制劑ICIs治療是腫瘤治療的里程碑。ICIs通過抑制免疫應答的內在下調因子,從而增強宿主對腫瘤細胞的免疫應答。PD-1抑制劑在臨床中得到了廣泛應用。目前,除了進口的PD-1抑制劑,國產PD-1抑制劑特瑞普利單抗、信迪利單抗、卡瑞利珠單抗等相繼在國內上市,患者有了更多的治療選擇。由于免疫治療獨特的作用機制,其毒性表現形式也有別于傳統的化療、放療、靶向治療。但臨床研究及真實世界研究中關于irAEs的發生率數據差異較大,一項真實世界研究數據顯示來自ICIs單藥的任何級別的irAEs的發生率高達90%[5],另一項Betrand等的meta分析顯示,PD-1的總發生率超過27~78%[6]。除了瘤種的差異外,不同的藥物在irAEs的發生率及毒性譜方面也存在一定的差異。阿替利珠單抗引起甲狀腺功能減退、消化道副反應風險較高,帕博利珠單抗引起肺毒性及肝毒性發生率較高[7]。除此外,人種差異、疾病發展階段、既往治療、基礎疾病均會對ICI毒副反應的發生率及毒性譜產生影響。
本研究納入50例我科近2年來收治的采用PD-1治療(包括免疫單藥及免疫聯合治療)的惡性腫瘤患者,irAEs的發生率為40%(20/50),與既往報道相比,發生率相對稍低。這可能源于本研究多數患者采用免疫聯合治療,某些副反應諸如惡心嘔吐、腹瀉、血小板下降與化療副反應無法鑒別,故未納入副反應統計中。本研究中的ICI的毒性譜涉及內分泌、肺、心臟、肝臟、皮膚及神經系統。其中,發生率最高的為甲狀腺功能減退,并且我們發現在這些患者中大都出現TSH一過性的升高后很快轉別為甲狀腺功能減退,這與文獻報道一致。內分泌毒性是ICI最常見的毒性反應之一[8],受ICI影響的最常見內分泌器官為甲狀腺,通常表現為甲狀腺功能減退,有研究顯示80%的患者經歷最初的臨床或亞臨床甲狀腺毒癥后轉變為甲狀腺功能減退,轉變中位時間為4~7周,提示其發生機制為甲狀腺損傷引起的甲狀腺炎。本研究中甲狀腺功能減退患者均未出現明顯臨床癥狀,可能與定期甲狀腺功能監測及即時干預有關,免疫治療均繼續且未出現不良后果。1例基線無糖尿病患者出現糖尿病酮癥酸中毒,其繼發于胰島素缺乏性糖尿病(insulin-deficient diabetes,IDD),是一種罕見但致命性的內分泌副反應,高血糖進展迅速,很快進展為胰島素缺乏癥狀,若無胰島素即時干預,很快進展為糖尿病酮癥酸中毒。在1項包含46例IDD的研究中,有71%(32/46)均發展為糖尿病酮癥酸中毒才被診斷,可見其進展迅速[9]。本研究中1例患者出現免疫性心肌炎,在進行第二周期化療聯合免疫治療前常規檢查發現肌鈣蛋白異常升高,患者無任何不適,心電圖示完全性右束支傳導阻滯,心臟彩超無異常發現。10小時后患者突然出現胸悶,頻死感及暈厥,心電圖檢查示III°房室傳導阻滯。免疫性心肌炎發病率約為1~2%,但死亡率高達27~46%[10]。聯合ICI治療的患者預后更差,死亡率高達76%。心肌肌鈣蛋白是一種最為有效的心肌損傷標志物,對心肌炎的敏感性高達94~100%。此外腦利鈉肽(n末端前)及肌酸激酶同工酶異常及重復心電圖有助于早期診斷ICI免疫性心肌炎,心電圖表現可見嚴重傳導系統疾病(如完全性心臟傳導阻滯)和室性心動過速。該例患者的診治提示在ICI治療期間的每次就診中,無論患者有無臨床癥狀,都應進行仔細的體格檢查及實驗室檢查。本研究中唯一的死亡病例為1名免疫性肺炎患者,為食管癌晚期患者,既往有胸部放療史,放療期間出現過放射性肺炎,放療結束后半年開始行卡瑞利珠單抗免疫治療,但治療18周后即因免疫性肺炎而死亡。本研究中3例放射性肺炎患者雖診斷及治療經過不同,但既往均有胸部放療史,放射治療聯合免疫治療的協同效應已在多個臨床試驗和病例報告中顯示。但胸部放療與PD-1抑制劑引起的重疊肺毒性是值得關注的一個重要問題。還可能引起一種獨特的肺炎模式——放射回憶肺炎(radiation recall pneumonitis,RRP),即在患者先前照射野出現炎癥。
irAEs的早期診斷對于后續的治療至關重要,但診斷的困難在于這些癥狀常常與癌癥相關或其治療相關的并發癥重疊。治療的核心為免疫抑制治療。最為有效的藥物為糖皮質激素,但對于某些特殊人群,如糖尿病患者、消化道潰瘍病史患者等,糖皮質激素的使用可能會加重基礎疾病,甚至引發其他并發癥,需要密切監測。
綜上所述,隨著聯合免疫治療時代的到來,免疫治療的應用范圍和治療人群不斷擴大。影響多個器官的irAEs已成為ICIs應用前景的主要障礙。但本研究僅為小樣本研究,存在一定的研究偏倚。還需要大樣本研究,進一步深入探討免疫治療的毒性譜及各類型PD-1毒性譜的差異。對于irAEs的管理,特別是早期發現和早期干預,能使患者從免疫治療中獲得最大的臨床效益。

