SGK-1通過軟骨破壞和炎性疼痛傳導參與顳下頜關節骨關節炎
程慧欣,白苗苗,沈振國,季華鋒,張 政,邢 田,王元銀,3
顳下頜關節骨關節炎(temporomandibular joint osteoarthritis,TMJ-OA)是一種以下頜髁突軟骨(mandibular condylar cartilage,MCC)退變為特征的進行性退行性關節疾病[1],患者主要表現為關節疼痛、下頜運動異常及功能障礙。目前對于TMJ-OA的臨床治療方案多以對癥治療為主,尚無有效的預防和根治措施。血清和糖皮質激素誘導的蛋白激酶1(serum-and glucocorticoid-induced kinase 1,SGK-1)作為絲/蘇氨酸蛋白激酶家族成員之一,參與離子通道調節、細胞增殖分化、自噬抑制等多種臨床生理和病理過程[2]。近年來有研究[4-6]表明,SGK-1在膝骨關節炎(knee osteoarthritis,KOA)及外周神經系統的痛覺傳導中發揮作用,但SGK-1在TMJ-OA中的作用尚無研究報道。本研究旨在探究SGK-1是否參與調控TMJ-OA軟骨破壞及以痛覺傳導進程,以期為臨床預防和治療TMJ-OA提供新靶點。
1 材料與方法
1.1 實驗動物6周齡雄性SPF級SD大鼠16只體質量(200±20)g,購于安徽醫科大學實驗動物中心,保持室溫(22±2)℃,濕度(50±10)%,自由進食水,每12 h變換晝夜節律,實驗開始前適應性喂養7 d,本實驗采用的實驗方法均符合實驗室動物倫理準則(動物倫理批號:LLSC20190123)。
1.2 實驗材料碘乙酸鈉(monosodium iodoacetate,MIA)購自美國Sigma-Aldrich公司;逆轉錄試劑盒(日本Takara公司);qRT-PCR引物( 上海生工生物工程股份有限公司);擴增試劑盒(中國南京諾唯贊公司);超微量紫外分光光度計(美國Thermo Fisher公司);實時熒光定量PCR儀(瑞士Roche公司)。
1.3 實驗方法
1.3.1實驗性大鼠TMJ-OA模型建立 將16只6周齡雄性SPF級SD大鼠隨機分為兩組,即TMJ-OA組和Control組。按3 ml/kg腹腔注射10%水合氯醛麻醉,雙側TMJ區域消毒,以大鼠外耳道和眼角連線上,距外耳道約3 mm處,相當于顴弓下方作為進針點,向上向前向內,抵骨壁后后退后退約1 mm,回抽無血后,雙側關節腔分別注射50 μl MIA(10 mg/ml),留針1 min,Control組雙側關節腔按同樣的方法,注射等量0.9%氯化鈉溶液,見圖1。造模后28 d,過量麻醉處死大鼠,分別取各組大鼠左側完整TMJ及三叉神經節(trigeminal ganglion,TG)用于HE染色和番紅固綠染色,取右側MCC及TG用于qRT-PCR。

圖1 TMJ-OA動物模型構建
1.3.2行為學檢測 采用von-Frey毛刷測定大鼠頭退縮閾值(head withdrawal threshold,HWT),分別在造模前3 d測定大鼠基礎閾值,篩除過于遲鈍或敏感的大鼠,并在造模后1 、7、14、21、28 d測定大鼠HWT值變化;檢測HWT前,將大鼠分別置于不同小籠中適應30 min,待大鼠安靜后,用von-Frey毛刷按照從小到大的力度刺激TMJ區域,每個力度重復刺激10次,以出現至少6次頭退縮,或抓撓TMJ區域視為陽性,記錄最小陽性值作為HWT值。
1.3.3HE染色 將取出的完整左側TMJ在4%多聚甲醛中固定24 h后,10%EDTA脫鈣30 d,至探針可以輕松穿過組織,然后常規脫水、浸蠟、包埋、切片、HE染色;左側TG多聚甲醛中固定24 h后,直接脫水、浸蠟、包埋、切片,HE染色,在顯微鏡下觀察組織病理變化。
1.3.4番紅固綠染色 將左側TMJ石蠟切片脫蠟,脫水,經固綠、番紅染液染色后快速脫水,封片,顯微鏡下觀察。
1.3.5qRT-PCR檢測mRNA表達水平 將右側MCC和TG分別在液氮中研磨至粉末狀,轉移至無酶EP管, TRIzol法提取RNA,DEPC水溶解,測定總RNA濃度、純度,定量后,逆轉錄成cDNA,SYBR法擴增,用2-ΔΔCt法計算,β-actin校準。引物序列詳見表1。


表1 各基因qRT-PCR引物序列一覽表
2 結果
2.1 行為學檢測結果Control組和TMJ-OA組大鼠體質量變化無明顯差異(t=4.76,P>0.05)(圖2);Control組大鼠HWT值未見明顯變化,TMJ-OA組HWT值低于Control組 [ Control組(21.53 ± 0.72)g,TMJ-OA組(12.29 ± 3.46)g ],差異有統計學意義(t=2.61,P<0.05),且1 d后即出現HWT降低(t=4.29,P<0.001),約在7 d左右達到閾值最低點(t=5.64,P<0.000 1),此后HWT值出現緩慢上升,但是28 d左右閾值仍然明顯低于Control組(t=3.17,P<0.05),表明TMJ-OA組大鼠出現機械痛覺過敏,見圖3。

圖2 大鼠體質量變化
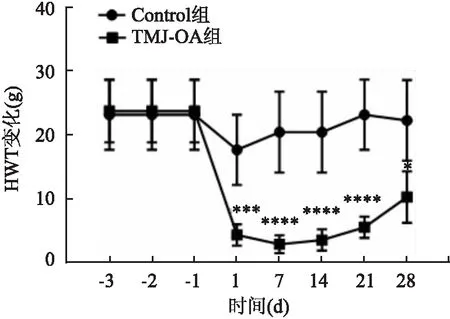
圖3 大鼠HWT變化
2.2 組織病理學結果
2.2.1TMJ組織病理學變化 取出大鼠MCC后肉眼可見Control組大鼠MCC表面光滑透亮, TMJ-OA組MCC表面缺損,粗糙失去光澤(圖4)。HE染色結果顯示(圖5A、B),Control組大鼠MCC由層次分明的四層組成:纖維層、增殖層、肥大層、鈣化軟骨層。注射MIA 28 d后,TMJ-OA組大鼠出現典型的骨關節炎樣病變:MCC表面部分缺損,軟骨纖維化,纖維層部分細胞核丟失(黑色箭頭),肥大層變薄甚至消失(綠色箭頭),細胞層次紊亂、界限不清(黃色箭頭),出現無細胞區(紅色箭頭),軟骨細胞簇形成(白色箭頭)。番紅固綠染色結果顯示(圖4C、D),Control組大鼠MCC肥大細胞層基質均勻紅染;TMJ-OA組軟骨基質淡染,甚至部分區域紅染消失(黑色箭頭),表明軟骨受到損傷,軟骨細胞釋放過量蛋白多糖,使軟骨基質分布不均。
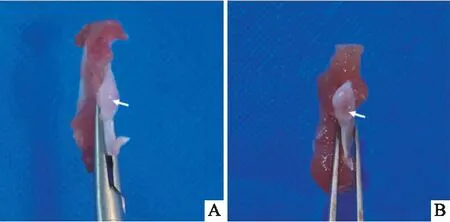
圖4 大鼠髁突大體觀A:Control組;B:TMJ-OA組
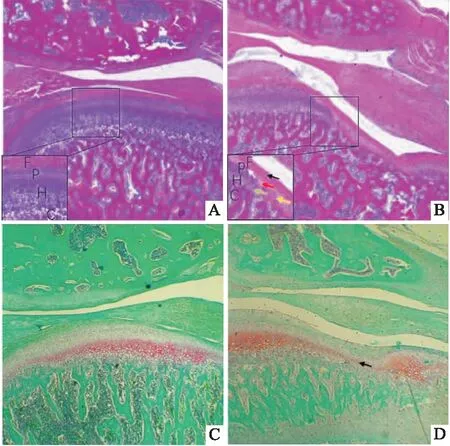
圖5 TMJ組織病理學變化 ×40
2.2.2TG組織病理學變化 Control組大鼠 TG神經纖維排列整齊緊密,施萬細胞分布均勻。注射MIA 28 d后,TMJ-OA組神經纖維排列紊亂松散(黃色箭頭),出現空泡樣變,即脫髓鞘改變(紅色箭頭),施萬細胞增多(綠色箭頭)等(圖6)。

圖6 TG組織病理學變化 HE染色 ×400A:Control組;B:TMJ-OA組
2.3 大鼠MCC中mRNA表達qRT-PCR檢測大鼠MCC中SGK-1、IL-1β、環氧合酶(cyclooxygenase,COX)-2、基質金屬蛋白酶(matrix metalloproteinases ,MMP)-13 mRNA的表達,結果顯示:與Control組相比,TMJ-OA組SGK-1(t=2.21,P<0.05)、IL-1β(t=2.81,P<0.05)、COX- 2 (t=3.11,P<0.05)、MMP-13(t=3.21,P<0.01)的mRNA表達量均有不同程度的上調,差異有統計學意義(圖7)。

圖7 大鼠MCC中mRNA表達與Control組比較:*P<0.05,**P<0.01
2.4 大鼠TG中mRNA表達qRT-PCR檢測TG中SGK-1、COX-2 mRNA的表達,結果顯示:與Control組相比,TMJ-OA組SGK-1(t=4.76,P<0.01)、COX-2(t=2.76,P<0.05) mRNA的表達量均有不同程度的上調,差異有統計學意義(圖8)。

圖8 大鼠TG mRNA表達 與Control組比較:*P<0.05,**P<0.01
3 討論
TMJ-OA特征是細胞應激和細胞外基質降解,表現為局部炎癥及軟骨損傷。本研究參照Wang et al[7]的方法通過關節腔內局部注射MIA構建大鼠TMJ-OA模型,大體觀及組織病理學結果顯示MIA注射可引起OA特征性改變,與臨床TMJ-OA患者具有相似的組織病理變化[1, 8]。本研究發現IL-1β及COX-2在MCC中高表達,提示MIA可以引起MCC炎癥反應及氧化應激損傷,這與臨床患者和其他動物模型疾病進程相一致[9-10]。軟骨細胞主要功能是合成膠原蛋白等對細胞外基質進行補充,MMP通過分解Ⅱ型膠原維持TMJ的生理結構的平衡;在本研究中,TMJ-OA組軟骨基質淡染,同時MCC中MMP-13 mRNA高表達,推測可能是在炎性微環境下,軟骨細胞損傷,產生細胞因子可能刺激MMPs等的合成,加重軟骨基質降解,從而加劇了OA 的發展。
TMJ關節區疼痛是TMJ-OA患者最亟待解決的問題,TG作為頭面部外周痛覺信號樞紐接收TMJ軟骨下骨及滑膜組織中游離神經末梢傳導的神經沖動,并將它們上傳至中樞神經系統,產生疼痛。本研究中TMJ-OA組大鼠HWT顯著降低,且TG神經纖維出現顯著脫髓鞘改變,形成慢性疼痛損傷。有研究指出,氧化應激可能直接損害神經元功能或導致膠質細胞過度激活,這可能有助于神經退行性疾病中的慢性持續性炎癥及神經元功能障礙[11],在高糖誘導的背根神經節神經元細胞損傷模型中,抑制COX-2 的表達可減輕神經元細胞的損傷和氧化應激水平[12],而在TMJ-OA模型中TG內COX-2的表達鮮有報道,本研究結果顯示COX-2在TMJ-OA組TG內表達顯著上調。盡管MCC中無神經分布,但發生TMJ-OA時,持續的炎癥狀態、關節內炎性因子誘導TG神經元細胞損傷及神經遞質的變化也可能對疼痛的放大和遷延具有促進作用。
SGK-1 是Webster et al[13]在對糖皮質激素誘導的大鼠乳腺癌細胞進行基因表達的差異篩選時發現的一個絲/蘇氨酸蛋白激酶。近年來研究報道SGK-1與KOA的軟骨破壞相關,研究發現,臨床患者和小鼠KOA模型中,損傷的軟骨細胞高表達SGK-1,敲低軟骨細胞SGK-1基因表達后,受到炎癥刺激的軟骨細胞增殖明顯,且膠原合成增加[4-5]。盡管同為關節軟骨,TMJ軟骨與膝關節軟骨具有不同的組織結構:TMJ是纖維軟骨,由Ⅰ、Ⅱ型膠原蛋白組成[14]。本研究發現與Control組相比,TMJ-OA組MCC中SGK-1的mRNA表達水平上調。除了參與炎癥免疫性疾病的病理過程,SGK-1還與學習記憶、神經元興奮、中樞神經系統性疾病相關;研究發現,SGK-1可以通過促進背根神經節中Nav1.7上調從而誘導慢性手術后疼痛,抑制SGK-1減輕周圍傷害感受器中Nav1.7的失調可能是防止慢性手術后疼痛向中樞神經痛發展的有效途徑[6]。但目前SGK-1在TG中是否表達尚無文獻報道,本研究發現TMJ-OA組TG中SGK-1的表達水平上調。以上實驗結果提示,SGK-1通過關節局部軟骨破壞和炎性疼痛傳導兩種途徑參與TMJ-OA的病理過程。
綜上所述,MIA關節內注射可以得到與TMJ-OA患者相似的病理表現和疼痛癥狀,SGK-1在破壞的MCC中和損傷的TG中均表達上調,將SGK-1作為治療靶點,抑制患者異常表達的SGK-1,可能具有抗炎和緩解疼痛的雙相效應。但SGK-1參與TMJ-OA進程的分子機制及涉及的信號通路調控途徑尚不清楚,還需進一步在動物實驗和細胞水平深入研究。

