殼聚糖-β-磷酸三鈣復合層狀支架的制備與研究
陸依凡,鄒多宏,丁如愿,侯愛兵
外傷、感染、腫瘤切除等原因通常會造成骨組織缺損,小范圍的缺損常可以自愈,較大范圍的缺損如臨界骨缺損則無法實現自我修復。目前,臨床上常用的方法有自體骨移植、異體骨移植,但供源短缺或者免疫反應等限制了其應用[1]。應用骨組織工程修復臨界骨缺損近年來逐漸成為研究的熱點,其中生物支架在整個修復過程中起到至關重要的過程,被稱為組織工程的“基石”[2]。
殼聚糖(chitosan, CS)是一種豐富的天然多糖,具有良好的生物相容性、生物降解性、抗菌性、價格低廉等優點被廣泛應用于組織工程研究中[3-5]。β-磷酸三鈣(β-TCP)具有優異的降解性能和骨傳導性,能夠較好的修復骨缺損。本實驗將CS和β-TCP混合,通過雙向凍干技術制備了具有互相平行的薄層狀、多孔狀生物支架,該支架具有優異的壓縮強度和彈性形變能力,良好的生物相容性以及誘導間充質干細胞成骨分化能力,具有修復臨界骨缺損的潛力。
1 材料與方法
1.1 實驗動物SD雄性大鼠,3周齡,體質量(50±5)g,購自安徽醫科大學實驗動物中心,整個實驗過程對動物處置均符合醫學倫理學要求(批號:LLSC20200362)。
1.2 合成材料殼聚糖(85%去乙酰化程度)、 β-TCP(生物醫用級,≥ 98%,β-phase basis,<0.2 μm,美國aladdin公司)。
1.3 主要試劑和儀器DEME、胰酶消化液(美國Hyclone公司);胎牛血清(美國Gibco公司);BCIP/BNT堿性磷酸酯酶顯色試劑盒(上海碧云天公司);二氧化碳孵育箱(美國Thermo公司);CCK-8試劑(日本同仁公司);酶標儀(美國Bio-tek公司);激光掃描共聚焦顯微鏡LSM880、掃描電子顯微鏡(德國蔡司公司);X線衍射儀(荷蘭帕納科公司);高溫高壓滅菌鍋(日本Hirayama公司)。PCR引物(上海生物工程股份有限公司);實時熒光定量PCR儀(美國Stratagene公司);力學萬能機(美國英斯特朗公司)。
1.4 方法
1.4.1大鼠骨髓間充質干細胞的分離與培養 3周齡雄性SD大鼠脫頸處死,在超凈工作臺中去除表皮及肌肉組織。將后肢股骨兩端骨骺端剪去,用5 ml注射器將骨髓沖出至培養皿中,加入含有20%胎牛血清的DMEM培養基,在37 ℃,5%二氧化碳條件下進行培養,3 d后更換培養基,培養至7 d后對原代細胞進行傳代。
1.4.2雙向凍干制備CS-β-TCP支架 將CS-β-TCP溶液倒入預制的硅膠模具中,模具的一側浸入液氮,使得冰核在溶液底生成并且呈現平行的、長程排列的冰片。冷凍完成后將其轉入真空凍干機凍干,使用0.3 mol/L NaOH乙醇溶液對樣品進行除酸,隨后用去離子水反復清洗樣品。
1.4.3 力學測試將凍干的復合組(CS-β-TCP支架)支架制備成10 mm×10 mm×10 mm的測試樣品,通過力學萬能實驗機對樣品進行壓縮循環測試,以1 mm/s的速度將樣品壓縮40%、60%、80%,觀察其回彈能力。記錄壓縮-回彈過程并繪制壓縮循環曲線。
1.4.4結構表征 將CS-β-TCP支架制備成2 mm×2 mm×2 mm的測試樣品,將樣品截面以導電膠固定于樣品臺,低真空下噴金后使用掃描電子顯微鏡(scanning electron microscope, SEM)在5 kV的加速電壓下拍攝樣品,能量分散光譜(energy disperse spectroscopy, EDS)觀察各元素分布。將復合組支架平鋪于試件臺上,用X線衍射儀分析進行掃描,分析其組成成分。
1.4.5細胞生物相容性實驗 用打孔器將復合組支架制備成直徑5 mm,厚度2 mm的圓形樣品。每個樣品接種1×104個大鼠骨髓間充質干細胞,空白對照組僅在96孔板底接種細胞,每組5個副孔。1 d、4 d、7 d分別吸除培養基,PBS清洗兩遍后,加入CCK-8溶液(CCK-8 ∶DEME=1 ∶9)200 μl/孔,37 ℃孵育2 h后使用酶標儀檢測每孔在450 nm處的吸光度值。
1.4.6細胞活力和細胞黏附實驗 ①細胞活力實驗(活死染法):大鼠骨髓間充質干細胞接種在支架上于96孔板中培養1、4、7 d后棄除原有培養基,PBS清洗3遍后,將10 μl calcein-AM和15 μl propidium iodide溶解于5 ml PBS中混勻,每孔加入100 μl 混合液,37 ℃孵育15 min后,PBS清洗3遍,使用激光共聚焦檢測細胞染色情況,其中活細胞為綠色熒光,死細胞為紅色熒光。②細胞黏附實驗:大鼠骨髓間充質干細胞接種在復合組支架上3 d后,PBS清洗3遍,用4%多聚甲醛固定樣品30 min。0.1%的Triton-X 100對支架上細胞破膜10 min,隨后用1%的BSA溶液封閉樣品1 h。使用0.1%的羅丹明標記的鬼筆環肽染色30 min,DAPI對細胞核染色5 min。隨后用激光共聚焦進行檢測。
1.4.7細胞成骨分化的檢測 將5×105個鼠骨髓間充質干細胞分別接種在純殼聚糖組和復合組支架上培養,每3 d換液1次,7 d時用TRIzol提取細胞中的RNA并根據試劑說明書逆轉錄合成cDNA。采用qRT-PCR檢測骨形態發生蛋白2(bone morphogenetic protein 2, BMP2)、RUNX相關轉錄因子2(RUNX family transcription factor 2, RUNX2)、一型膠原(collagen type I, COL1)的基因表達水平(引物序列見表1)。并對支架進行堿性磷酸酶(Alkaline phosphatase, ALP)染色,檢測ALP活性。

表1 PCR引物序列
2 結果
2.1 CS-β-TCP支架表征CS-β-TCP支架的掃描電鏡下呈現相互平行的薄層多孔結構,孔徑大小均勻,且具有良好的貫通性。見圖1A。圖1B為CS-β-TCP支架的壓縮循環曲線,結果表明CS-β-TCP支架具有良好的壓縮性能,支架壓縮80%后仍可恢復原有形狀。
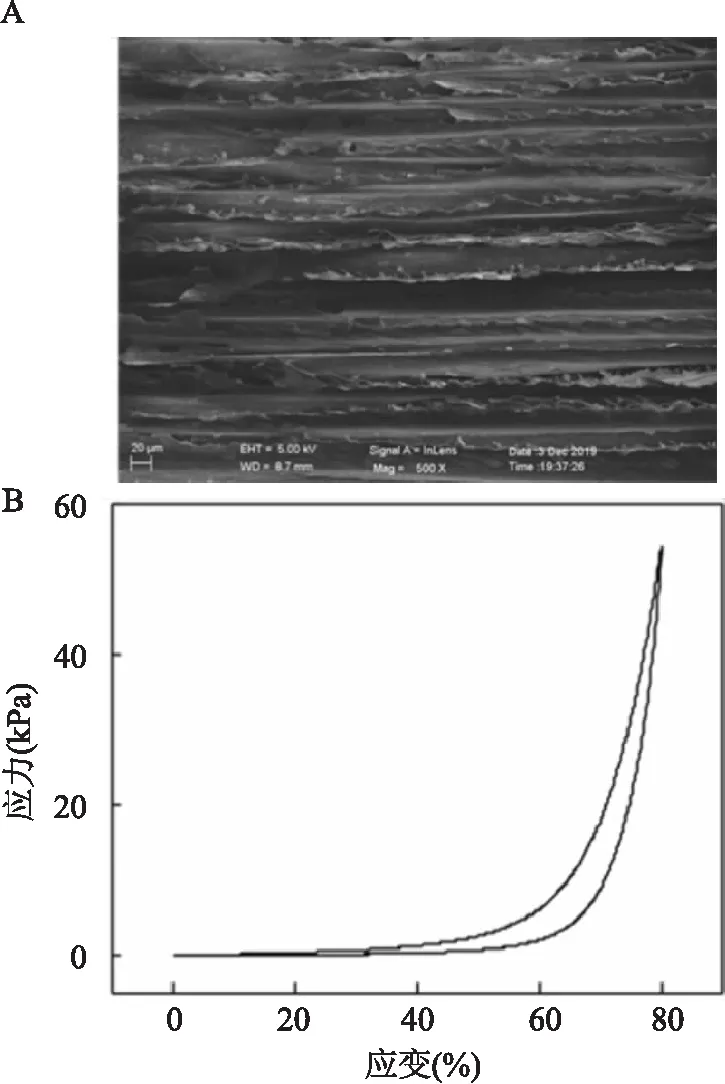
圖1 CS-β-TCP支架的力學表征
2.2 CS-β-TCP支架的成分檢測XRD結果顯示,復合組支架中含有β-TCP顆粒,EDS結果表明,β-TCP顆粒均勻的分布在復合組支架的薄層結構上。見圖2。

圖2 CS-β-TCP支架成分分析
2.3 CS-β-TCP支架生物相容性實驗CCK-8結果顯示,大鼠骨髓間充質干細胞與材料共培養1、4、7 d后,與空白對照相比,純殼聚糖組和復合組的吸光度無明顯差異,細胞增殖未受到抑制,仍保持較高的增殖活性,見圖3。
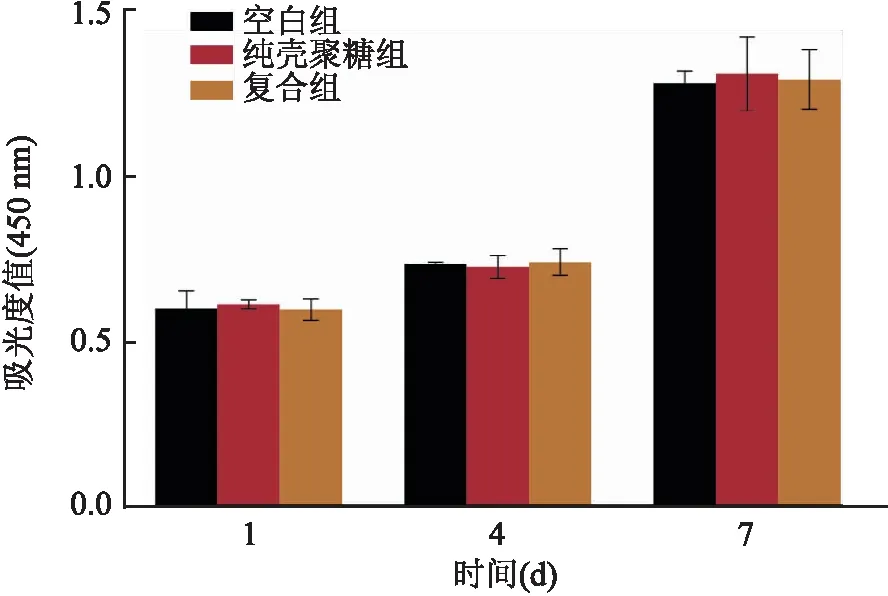
圖3 支架與細胞共培養后的生物相容性
2.4 細胞活性檢測結果如圖4所示,支架上死細胞較少,細胞活性高,同時細胞表現出良好的增殖能力。復合組支架對細胞活性無影響。
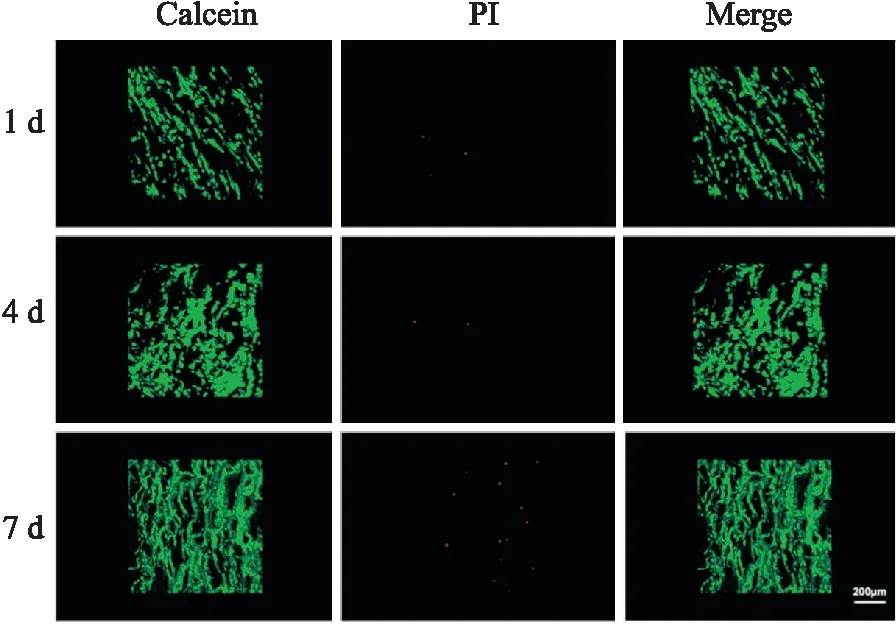
圖4 CS-β-TCP支架接種細胞后細胞活力檢測Calcein:鈣黃綠色,活細胞為綠色;PI:碘化鉀,死細胞為紅色
2.5 細胞黏附能力大鼠骨髓間充質干細胞接種在CS-β-TCP支架72 h 后,熒光染色結果表明細胞可以較好的黏附在復合組支架上。此外,細胞能夠較好的張入層狀微孔結構中,為細胞的黏附和分化提供了良好的力學刺激,見圖5。

圖5 細胞接種在CS-β-TCP支架72h后,細胞黏附的檢測DAPI:染細胞核為藍色;Phalloidin:染細胞骨架為紅色
2.6 支架的促成骨分化能力qRT-PCR結果表明,和純殼聚糖組相比,復合組的成骨相關基因BMP2, RUNX2 以及COL1 的表達增強,差異有統計學意義(P=0.000 3,F=55.78;P=0.000 3,F=38.20;P=0.021 5,F=15.91),且培養至第7 d、14 d時,ALP染色結果顯示,復合組的ALP陽性結果更加明顯,見圖6。

圖6 CS-β-TCP支架的促成骨分化能力的檢測A:成骨相關基因表達的檢測;B:堿性磷酸酶染色
3 討論
β-TCP是目前臨床上較為常用的骨科材料,具有良好的生物相容性,骨傳導性以及降解性[6-7], 廣泛應用于臨床骨缺損的再生修復。然而單純的磷酸鹽生物支架脆性較高,成分較為單一,不能較好的模擬天然骨的結構。常用的骨水泥作為骨組織缺損修復策略也具有一定局限性,其較小的孔徑阻礙血管的長入,導致其中間部位營養缺乏而造成組織壞死,進一步影響缺損修復的效果。殼聚糖作為天然多聚物,其結構與骨組織中的糖胺聚糖相似,在成骨細胞的附著和礦化方面具有重要的作用[8-9],但單純殼聚糖的機械性能較差,作為支架修復骨缺損時不能提供足夠的機械支持,從而影響骨組織的修復。本實驗將β-TCP顆粒與殼聚糖溶液混勻,通過雙向凍干技術制備的復合物支架,不僅能夠降低β-TCP的生物脆性,提高殼聚糖的機械強度,同時有機物和無機物的結合使得CS-β-TCP復合層狀支架能夠更好的模擬骨組織的結構。雙向凍干技術使得支架具備較多的孔徑結構以允許血管組織的長入,能夠更好的進行營養的交換和代謝物的更新,從而保證支架中心營養充足,加速骨缺損的修復。此外,平行的薄層狀結構賦予支架優異的彈性性能,可以保證支架處于壓縮狀態而植入缺損部位,殼聚糖骨架的形狀記憶能力使得支架能夠自適應缺損的形狀,這些特點使得CS-β-TCP復合層狀支架在不規則缺損的修復和微創領域中具有一定的潛力[10]。
CS-β-TCP復合層狀支架的掃描電鏡可以觀察到β-TCP顆粒均勻的分布在層狀結構內,使得層狀結構具有較為粗糙的表面,這種結構對于細胞的黏附可能具有一定的幫助,同時殼聚糖表面的正電荷可以吸引帶負電的細胞膜,促進細胞的黏附[11-12]。間充質干細胞黏附于支架后,同時受到機械張力和鈣離子的刺激而向成骨細胞分化。此外,殼聚糖可通過募集巨噬細胞從而減少炎癥反應,使得CS-β-TCP復合層狀支架在修復骨缺損的同時抑制炎癥的發生,更好的促進骨缺損的修復[13]。體外細胞實驗結果表明細胞可以較好的與支架共存,同時能夠隨培養時間的延長而增殖。這些結果證明該CS-β-TCP復合層狀支架具備生物支架的基本要求,不會對機體產生毒副反應。
體外檢測BMP2、RUNX2和COL1的變化可以反映間充質干細胞向成骨細胞分化的程度。qRT-PCR實驗表明與陰性對照組(純殼聚糖組)相比,復合組支架能夠促進骨髓間充質干細胞顯著表達BMP2、RUNX2和COL1基因,表明該復合組支架可以促進間充質干細胞向成骨細胞分化。ALP是成骨分化的標志性酶,在骨礦化過程中起到重要作用[14],對復合組支架進行ALP染色,與陰性對照組相比,復合組支架的陽性結果更為明顯,表明該組支架上的間充質干細胞骨礦化程度更高。qRT-PCR和ALP染色結果共同表明復合組支架具有明顯的促進間充質干細胞成骨分化能力。但本文所研究材料結構較為單一,成分上不存在梯度變化,對于復雜的缺損和位于兩種組織交界處的缺損修復效果較局限,例如關節處缺損常涉及表面的軟骨和軟骨下骨組織,且骨和軟骨組織具有不同的硬度和礦物質含量,單一支架難以同時修復骨和軟骨缺損。因此該材料需進一步改進,使其能夠適應復雜缺損處的梯度變化,從而實現復雜缺損的修復。
綜上所述,本實驗制備的CS-β-TCP復合層狀支架具有良好的機械性能和生物相容性,體外實驗表明能夠促進間充質干細胞的成骨向分化,為骨缺損的修復提供一種新的思路。

