康寧木霉固態發酵改善茶渣營養價值
崔藝燕,李家洲,田志梅,鄧盾,魯慧杰,劉志昌,容庭,馬現永,2*
(1. 廣東省農業科學院動物科學研究所,畜禽育種國家重點實驗室,農業農村部華南動物營養與飼料重點實驗室,廣東省畜禽育種與營養研究重點實驗室,廣東畜禽肉品質量安全控制與評定工程技術研究中心,廣東廣州 510640;2. 嶺南現代農業科學與技術廣東省實驗室茂名分中心,廣東茂名 525000)
茶(Camellia sinensis)是中國的傳統飲料,是僅次于水的全球第二大最常用的飲料[1]。2019 年,全球茶葉產量約為650 萬t[1]。中國茶渣的排放量約為每年16 萬t[2]。大量茶葉廢料在開放的環境中產生和丟棄,這些可再生的生物質資源給環境帶來了巨大的壓力,同時也浪費了茶葉中的生物活性成分。茶渣的資源化利用已成為亟待解決的問題。
實際上,茶渣中含有許多營養物質。干茶渣的主要營養成分包括粗蛋白質(crude protein,CP)、粗脂肪(ether extract,EE)、碳水化合物、粗纖維(crude fiber,CF)等[3-4]。此外,茶渣所含的生物活性化合物與普通茶相同,且含量相似[5]。茶渣富含功能物質,如多酚、生物堿、皂苷、多糖和有機酸[5-8],以及具有抗氧化、免疫調節、抗肥胖和抗糖尿病等活性[5,8]。動物研究表明,茶渣不僅能提高動物的免疫力,調節肌肉纖維類型,還能改善動物的消化能力、肉品質、抗氧化能力和腸道形態[9-11]。因此,茶渣是一種很有前途的飼料添加劑。但茶渣中含有皂苷、咖啡因等抗營養因子[8],適口性差,不適合作為飼料添加劑直接使用。選擇綠色有效的生物技術改良茶渣,對于茶資源的可持續發展至關重要。
固態發酵是一種經濟有效的生產技術,具有規模小、操作簡單、生產成本低、不污染環境等優點。真菌的菌絲遍布表面,生長迅速,代謝活性高[12]。真菌可以產生代謝物并促進化合物的生物轉化[13]。真菌分泌豐富的蛋白酶、纖維素酶等酶系,使大分子物質分解為葡萄糖、氨基酸等小分子物質,從而改善飼料品質。康寧木霉(Trichoderma koningii)常用于植物病原菌的生物防治中,在各種農業廢棄物飼料轉化中也較為常見。康寧木霉能夠在不利的環境條件下繁殖,能夠使用多種碳源和氮源[12]。研究發現,康寧木霉發酵桑葉(Morus alba)后的CP 含量高達31.27%,產蛋白酶活性高達107.173 U·mL-1[14]。康寧木霉也是分解高粱(Sorghum bicolor)秸稈CF 的優勢菌種[15]。目前,茶渣的研究集中在有機肥[4,16]、蘑菇基質[17]、吸附重金屬、處理廢水[18]、制備磚[7]等方向,茶渣飼料化利用以直接飼喂反芻動物為主[3,9],對茶渣進行發酵處理的較少。同時,未見康寧木霉發酵茶渣的相關研究。因此,本研究目的是通過單因素和正交試驗,篩選出康寧木霉茶渣發酵條件。利用康寧木霉固態發酵生產發酵茶渣,以提高茶渣的營養價值和功能成分,降低抗營養因子的含量。
1 材料與方法
1.1 試驗材料
試驗于2020 年1-10 月在廣東省農業科學院創新大樓進行。茶渣由康師傅飲料有限公司提供,60 ℃干燥后,研磨成粉,過0.425 mm 篩。茶渣CP、EE、CF、中性洗滌纖維(neutral detergent fiber,NDF)和酸性洗滌纖維(acid detergent fiber,ADF)的含量分別為25.93%、2.67%、25.48%、45.45%和25.23%。康寧木霉從陳皮分離篩選所得,菌絲放射狀生長,菌落背面淺黃色,孢子為黃綠色。
1.2 試驗方法
1.2.1真菌擴增及孢子液的制備 馬鈴薯葡萄糖瓊脂(potato dextrose agar,PDA)培養基用作擴增培養基。將0.2 mL 2×108~3×108個孢子·mL-1孢子液涂布到PDA 培養基的表面,28 ℃培養5~7 d。為制備孢子液,首先用無菌刀片刮擦長滿真菌的培養基表面。用5 mL 無菌水把真菌及表面培養基轉移到15 mL 離心管中,加入3 顆玻璃珠,渦旋勻漿15 min。最后,采用無菌脫脂棉進行過濾,混合液過濾2 次得孢子懸浮液。使用血球計數板(XB.K.25,上海市求精生化試劑儀器有限公司)對孢子的濃度進行計數,使用濃度為1×107個孢子·mL-1。
1.2.2發酵培養基的制備 將40 g 茶渣混合物(相應基質比例)放入200 mL 培養瓶中,121 ℃滅菌20 min。冷卻后,在無菌條件下,每個瓶中加入相應量的孢子懸浮液,用無菌玻璃棒將孢子懸液和底物攪拌50 次以上,最后用透氣蓋封口。
1.3 單因素試驗
在自然pH 下,研究基質比例(茶渣∶玉米粉)、料液比(基質∶水)、接種量、溫度和時間對茶渣發酵效果的影響。以CP、EE、還原糖、黃酮、皂苷和咖啡因含量為測定指標,選出較好的單因素水平,據此進行下一個單因素試驗,每水平3 個重復。
1.3.1基質比例對發酵茶渣的影響 茶渣∶玉米粉比例設為6∶4、7∶3、8∶2、9∶1,料液比為4∶6,接種量為4%,溫度為28 ℃,時間為8 d。
1.3.2料液比對發酵茶渣的影響 按1.3.1 確定的基質比例,料液比設為3∶7、4∶6、5∶5、6∶4、7∶3,其他條件同1.3.1。
1.3.3接種量對發酵茶渣的影響 按1.3.2 確定的料液比,接種量設為2%、4%、6%、8%、10%,其他條件同1.3.2。
1.3.4溫度對發酵茶渣的影響 按1.3.3 確定的接種量,溫度設為25、28、31、34、37 ℃,其他條件同1.3.3。
1.3.5時間對發酵茶渣的影響 按1.3.4 確定的溫度,時間設為0、2、4、6、8、10、14、22 d,其他條件同1.3.4。
1.4 正交試驗
為了獲得發酵茶渣的優化組合,以基質比例(A)、發酵溫度(B)、接種量(C)和發酵時間(D)為影響因素,進行L9(34)正交試驗,設計依據為單因素試驗結果。正交試驗設計如表1 所示,每個因素設3 個水平,共9 組,每組3 個重復,試驗中發酵pH 自然,料液比為5∶5。
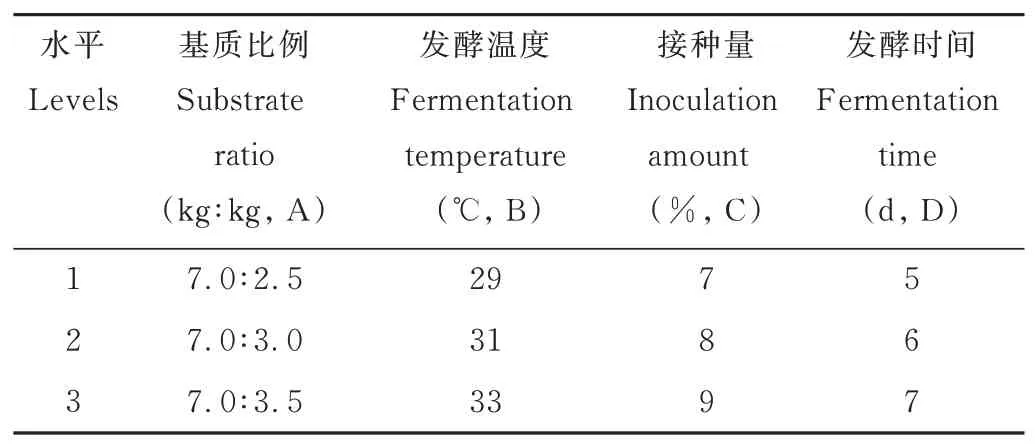
表1 正交試驗因素與水平Table 1 Factors and levels of orthogonal test
1.5 驗證試驗及對比試驗
根據正交試驗得出的最優組合(A1B2C1D2 或A1B2C1D3),進行茶渣發酵(6 個重復)。比較最優條件下發酵茶渣和正交試驗表中的各個指標,驗證最優組合發酵茶渣效果優于正交試驗各組合發酵。對比試驗即比較茶渣混合物在最優條件下發酵前后的營養價值。
1.6 指標測定
發酵產物冷凍干燥,粉碎過0.425 mm 篩。CP 含量測定參照GB/T6432-2018[19],EE 含量測定參照GB/T6433-2006[20],還原糖含量采用二硝基水楊酸法測定(DNS 試劑,D7800,Solarbio;按照說明書測定),黃酮含量測定根據Wang 等[21]的方法,皂苷含量測定參照孫萬里[22]的方法,咖啡因含量測定參照GB/T8312-2013[23]。
1.7 發酵效果評價
參照Wang 等[21]和Guarda 等[24]的方法,使用綜合評分評估發酵效果。CP、EE、還原糖、黃酮、皂苷、咖啡因分別占比25%、20%、10%、15%、15%、15%。每個樣品的總分是所有指標的總和。每個指標的平均值為平均分數,最佳結果定義為對應的最高分,最低結果定義為0 分,最佳/差結果與平均結果設置中間分(表2)。

表2 評分標準Table 2 Scoring criteria
1.8 數據處理
采用SPSS 19.0 軟件進行數據分析。單因素試驗、驗證試驗和對比試驗結果采用單因素方差分析(one-way ANOVA),用Duncan 氏法進行多重比較。正交試驗結果采用極差分析和一般線性模型進行方差分析。結果用平均值和均值標準誤表示,P<0.05 為差異顯著。
2 結果與分析
2.1 基質比例(茶渣∶玉米粉)對發酵茶渣的影響
由表3 可知,隨著茶渣含量的增加,發酵茶渣的CP、皂苷、咖啡因含量增加(P<0.05),而還原糖含量則降低(P<0.05)。當基質比例為9∶1 時,發酵茶渣的CP 和皂苷含量最高(P<0.05)。基質比例對發酵茶渣的黃酮含量無顯著影響(P>0.05)。基質比例為7∶3 的發酵茶渣綜合評分最高。
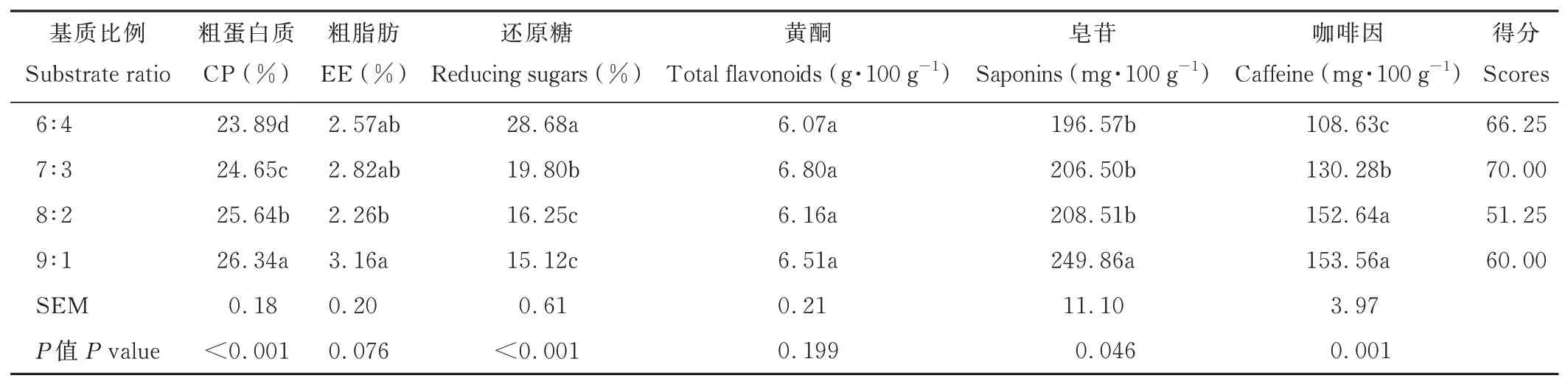
表3 基質比例(茶渣∶玉米粉)對發酵茶渣的影響Table 3 Effects of substrate ratio(tea dregs∶cornmeal)on fermented tea dregs(DM basis)
2.2 料液比(基質∶水)對發酵茶渣的影響
由表4 可知,EE 含量隨著基質的增加而顯著降低(P<0.05),而還原糖含量則顯著增加(P<0.05)。料液比為4∶6 時,黃酮含量最高,隨后是5∶5、6∶4、3∶7,7∶3 時最低(P<0.05)。料液比為3∶7 的茶渣皂苷含量顯著高于其他比例(15.03%~24.27%,P<0.05)。料液比為7∶3 的茶渣咖啡因含量顯著低于其他比例(10.95%~14.72%,P<0.05)。各組間CP 含量差異不顯著(P>0.05)。料液比為5∶5 的發酵茶渣綜合評分最高。

表4 料液比(基質∶水)對發酵茶渣的影響Table 4 Effects of solid-liquid ratio(substrate∶water)on fermented tea dregs(DM basis)
2.3 接種量對發酵茶渣的影響
由表5 可知,不同接種量對發酵茶渣CP、EE、皂苷和咖啡因含量無顯著影響(P>0.05)。接種量為8%和10%的茶渣還原糖含量顯著高于其他接種量(P<0.05)。接種量為2%、4%、8%的茶渣黃酮含量顯著高于6%和10%的發酵茶渣(P<0.05)。接種量為8%的發酵茶渣綜合評分最高。

表5 接種量對發酵茶渣的影響Table 5 Effects of inoculation amount on fermented tea dregs(DM basis)
2.4 溫度對發酵茶渣的影響
由表6 可知,當溫度為31 ℃時,發酵茶渣的CP 含量顯著高于25 和28 ℃(P<0.05),31~37 ℃的CP 含量無顯著差異(P>0.05)。25 和31 ℃時,發酵茶渣還原糖含量顯著高于其他溫度(P<0.05)。25 ℃發酵茶渣的黃酮含量較其他溫度顯著提高24.81%~46.12%(P<0.05)。34 ℃的皂苷含量最低。31 和34 ℃時,咖啡因含量顯著高于其他溫度(P<0.05)。不同溫度的發酵茶渣EE 含量差異不顯著(P>0.05)。溫度為31 ℃的發酵茶渣綜合評分最高。

表6 溫度對發酵茶渣的影響Table 6 Effects of temperature on fermented tea dregs(DM basis)
2.5 時間對發酵茶渣的影響
由表7 可知,隨著發酵時間的增加,CP 和咖啡因含量增加。與未發酵茶渣相比,發酵22 d 的茶渣CP 和咖啡因含量分別顯著提高34.15% 和45.60%(P<0.05)。發酵2 d 的茶渣還原糖含量較未發酵茶渣顯著增加1039.13%(P<0.05),此后隨著時間增加而顯著減少(P<0.05),但均顯著高于未發酵茶渣(P<0.05)。發酵6 d,黃酮含量顯著提高并達到最高值(P<0.05),隨發酵時間增加而逐漸降低。隨發酵時間的增加,茶渣皂苷含量逐漸降低。與未發酵茶渣相比,22 d 的茶渣皂苷含量顯著降低36.22%(P<0.05)。發酵時間對茶渣粗脂肪含量無顯著影響(P>0.05)。發酵6 d 的茶渣綜合評分最高。

表7 時間對發酵茶渣的影響Table 7 Effects of time on fermented tea dregs(DM basis)
2.6 正交試驗極差分析
通過極差分析法,比較表8 中極差(R)大小可知,對CP 含量影響因素大小排序為:發酵溫度(B)、發酵時間(D)、基質比例(A)、接種量(C)。根據Ki值的大小判斷最優水平,得到各因素對CP 含量的最優組合為A1B2C1D3。同理,對EE 含量影響因素大小排序為:A、C、B、D,EE 含量最優的組合為A3B1C1D3。還原糖、黃酮、皂苷、咖啡因的最優組合分別為A2B2C1D2、A3B1C2D3、A2B2C1D1、A1B1C1D1。根據綜合得分最優組合A1B2C1D3,茶渣發酵最優方案為A1B2C1D3,即基質比例為7.0∶2.5,發酵溫度為31 ℃,接種量為7%,發酵時間為7 d。

表8 正交試驗極差分析Table 8 Range analysis of orthogonal test
2.7 正交試驗方差分析
由表9 可知,基質比例(A)、發酵溫度(B)、發酵時間(D)顯著影響發酵茶渣CP 含量,說明因素A、B、D是影響發酵茶渣CP 含量的主要因素。根據F值得到,對CP 含量影響因素大小排序為:B、D、A、C。由表10 可知,對因素A分析,A1 的CP 含量顯著高于A2、A3,因此選擇A1。同理,因素B選擇B2,因素D選擇D2、D3。因素A、B、D對CP 含量的最優組合為A1B2CiD2 或A1B2CiD3。

表9 正交試驗方差分析Table 9 Analysis of variance of orthogonal test
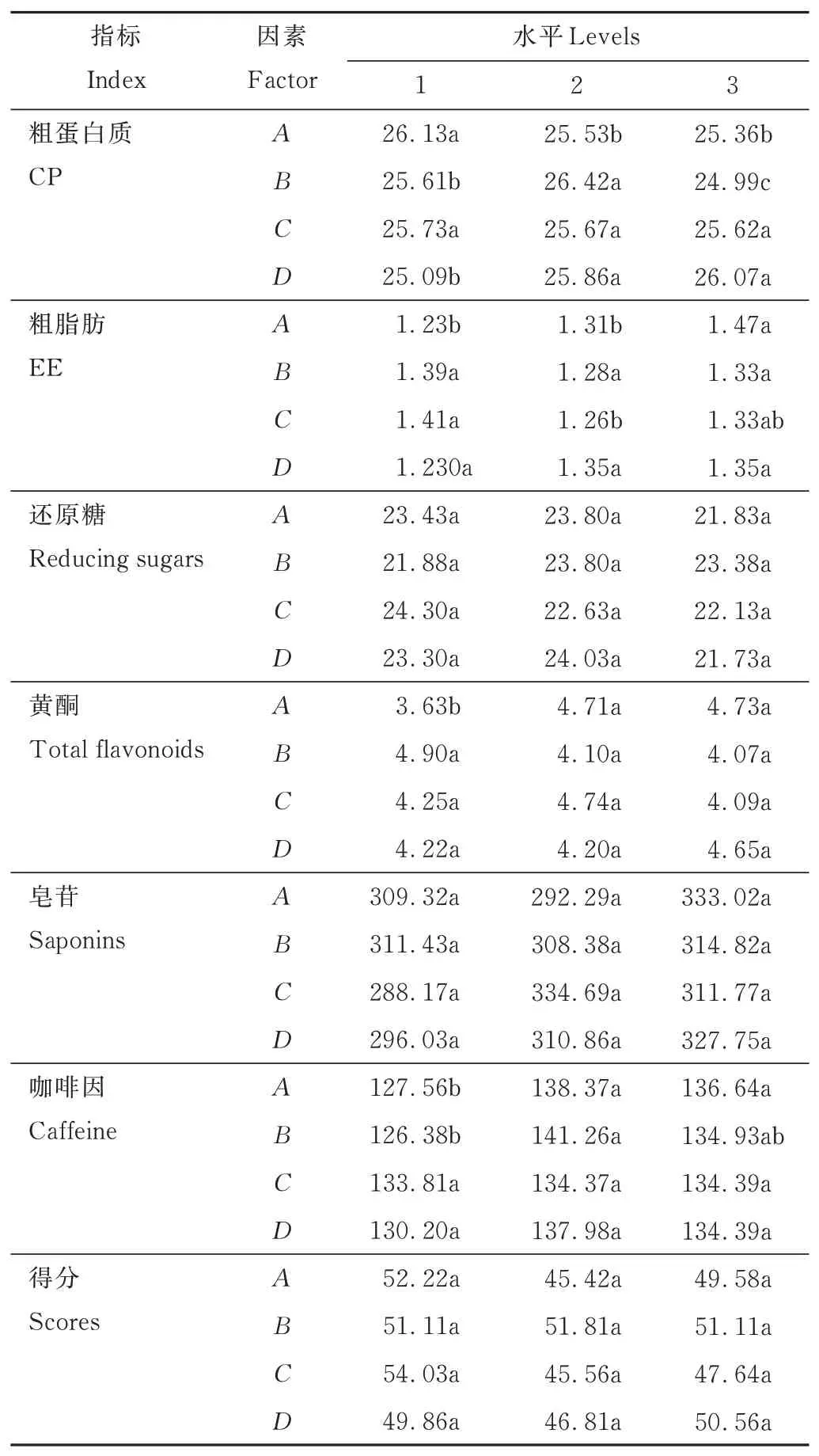
表10 正交試驗方差分析多重比較Table 10 Multiple comparison analysis of variance of orthogonal test
同理,因素A是影響EE、黃酮含量的主要因素,因素A、B是影響咖啡因含量的主要因素。對EE、黃酮、咖啡因含量的最優組合為A3BiCiDi、A2BiCiDi 或A3BiCiDi、A2B2CiDi 或A3B2CiDi。各 因 素 對 還 原糖、皂苷得分無顯著影響。
上述組合中A1、A2、A3、B2、D2、D3 出現次數最多。根據成分重要程度,CP 含量最為重要,選擇CP含量最優的組合A1B2CiD2 或A1B2CiD3 作為茶渣發酵最優方案。
2.8 驗證試驗
綜合極差分析(A1B2C1D3)和方差分析(A1B2CiD2 或A1B2CiD3)結果,茶渣發酵的最優組合為A1B2C1D2 或A1B2C1D3。由于分析得到的最優組合不在表1 正交試驗設計之內,因此對該組合進行了驗證試驗(表11)。測得發酵茶渣CP 和黃酮含量高于正交試驗表最高CP 含量(27.06%)和黃酮含量(5.92 g·100 g-1),咖啡因低于正交試驗表最低咖啡因含量(115.38 mg·100 g-1),EE 含量與正交試驗表最高EE 含量(1.53%)接近,還原糖和皂苷含量在正交試驗表的范圍內。
由表11 可知,與未發酵茶渣相比,發酵茶渣A1B2C1D2 和A1B2C1D3 的CP、還原糖、黃酮、咖啡因含量均顯著提高(P<0.001),皂苷含量顯著降低(P<0.001),EE 含量與未發酵茶渣無顯著差異(P>0.05)。發酵茶渣A1B2C1D2 和A1B2C1D3 的營養成分和活性物質含量無顯著差異(P>0.05)。
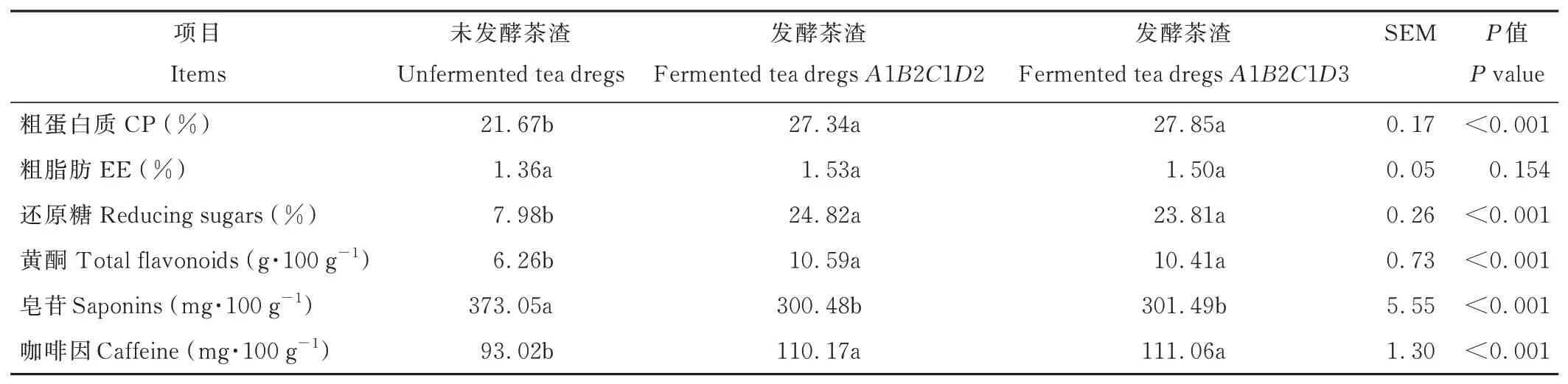
表11 發酵茶渣營養成分和活性物質Table 11 Nutrient components and active substance of fermented tea dregs(DM basis)
2.9 發酵對茶渣游離氨基酸的影響
由表12 可知,與未發酵茶渣相比,發酵茶渣(A1B2C1D2、A1B2C1D3)的異亮氨酸、亮氨酸、蘇氨酸、賴氨酸、精氨酸、牛磺酸、絲氨酸、磷酸絲氨酸、天冬酰胺、谷氨酸、丙氨酸、酪氨酸、γ-氨基正丁酸、必需氨基酸、非必需氨基酸、總氨基酸、風味氨基酸的含量以及必需氨基酸/總氨基酸、風味氨基酸/總氨基酸顯著提高(P<0.05 或P<0.001),氨含量和非必需氨基酸/總氨基酸顯著降低(P<0.05 或P<0.001)。發酵茶渣(A1B2C1D2、A1B2C1D3)生成了苯丙氨酸、谷氨酰胺、β-丙氨酸、半胱氨酸、胱硫醚、鳥氨酸。與A1B2C1D2 發酵茶渣相比,A1B2C1D3 發酵茶渣的蘇氨酸、牛磺酸、絲氨酸、磷酸絲氨酸含量顯著降低(P<0.05 或P<0.001),賴氨酸、精氨酸、天冬氨酸含量顯著提高(P<0.05 或P<0.001),兩種發酵茶渣的其他氨基酸含量差異不顯著(P>0.05)。
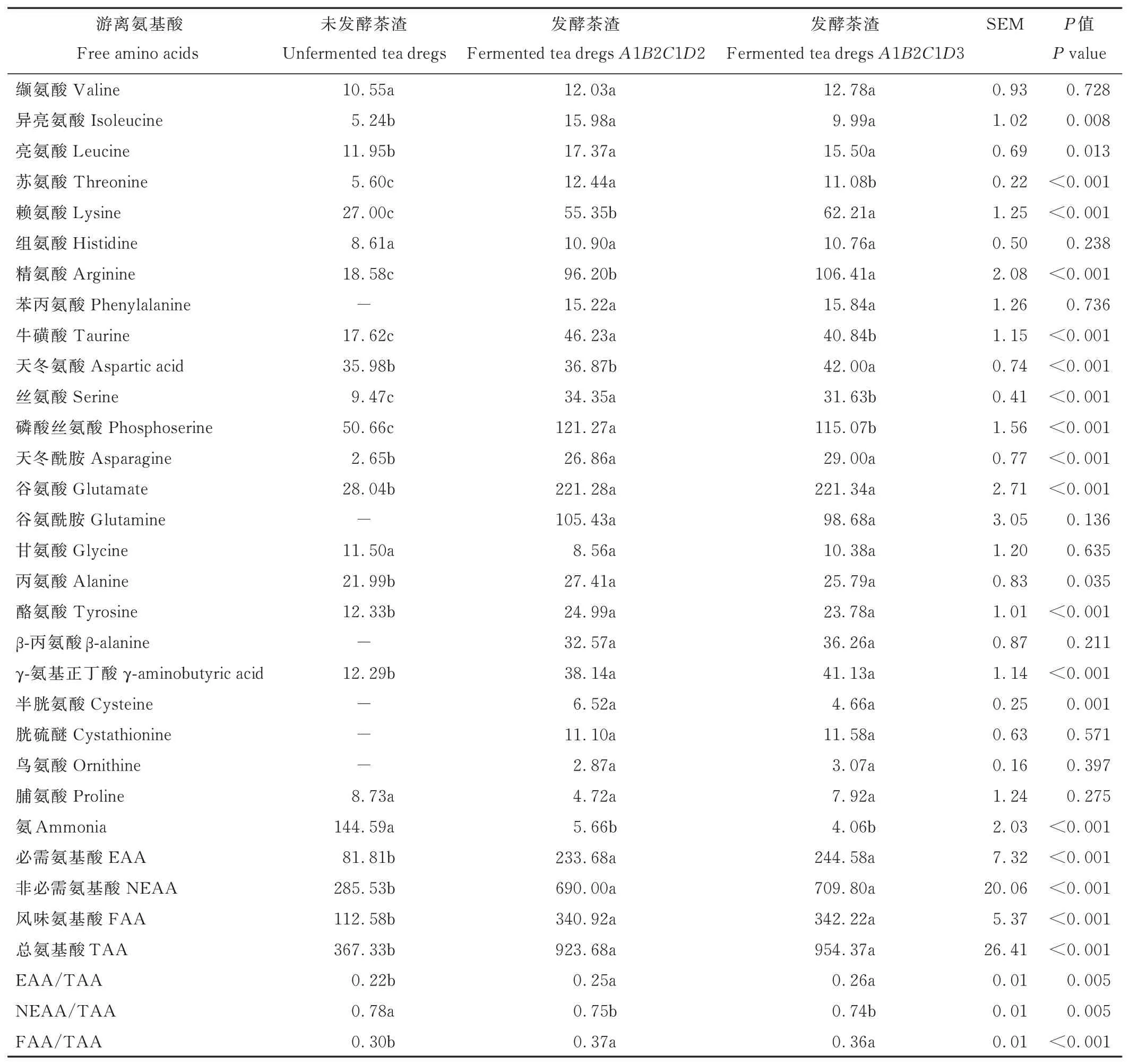
表12 發酵茶渣游離氨基酸Table 12 Free amino acids of fermented tea dregs(DM basis,mg·100 g-1)
3 討論
3.1 基質比例對發酵茶渣的影響
不同的基質比例影響著微生物的代謝活動。通過正交試驗得知,基質比例是影響發酵茶渣CP、EE、黃酮、咖啡因含量的主要因素。隨著茶渣含量的增加,發酵茶渣的CP、皂苷、咖啡因含量增加,而還原糖含量降低。這是符合猜測的,茶渣的CP、皂苷、咖啡因含量較高,當茶渣添加比例增加,這些成分的含量也隨之增加。還原糖含量降低主要是由于玉米粉添加比例的降低造成的。研究發現,發酵底物含糖量和生物質產量呈正相關[25]。玉米粉經過高溫高壓后,可產生大量還原糖。玉米粉添加量減少,發酵底物的還原糖含量隨之減少。即玉米粉含量較高的發酵底物能夠為康寧木霉提供更多的能量,有利于菌體生長。在相同條件下,孢子萌發生長需要消耗的還原糖含量相似,那么底物固有還原糖含量高,在被微生物消耗后余下的還原糖含量則高。另外,還原糖也來源于纖維素的降解。菌體代謝強,纖維素酶活性高,則產生的還原糖含量高。黃酮存在于茶渣中,在玉米粉中未檢測到。猜測隨著茶渣添加量的增加,黃酮含量應當提高,單因素試驗結果表明基質比例對發酵茶渣的黃酮含量無顯著影響。但是正交試驗方差分析表明,基質比例是影響黃酮含量的主要因素,7∶3 與7.0∶3.5 的黃酮含量顯著高于7.0∶2.5。這可能與康寧木霉對黃酮的代謝轉化有關,目前缺乏相關研究。單因素試驗中基質比為7∶3 的發酵茶渣綜合評分最高,即以較少的玉米粉配合茶渣發酵,生產含量較高的CP 和還原糖以及含量較少的皂苷和咖啡因的發酵產物。
3.2 料液比對發酵茶渣的影響
水分對微生物生長、生物合成和代謝產物的產生及分泌具有重大影響[26]。據報道,在水分增加或減少的情況下,酶的產生會受到不利影響[27]。隨著水分含量的增加,還原糖含量顯著降低,這可能由于高水分導致纖維素酶產生減少,對纖維素降解能力減弱,導致還原糖的減少。另外,水分含量高會改變底物顆粒的結構,減少氣體體積,減緩微生物生長[28]。康寧木霉是好氧菌,發酵基質水分高,則溶氧量較低,菌絲集中生長在發酵基質表面,內部菌絲較少或活力較弱,對纖維素降解不足,產生的還原糖含量則較低。料液比為7∶3 時,還原糖含量最高,而EE 含量是最低的,還原糖與EE 趨勢是相反的,這也說明了微生物代謝產生不同代謝物的適合條件是不同的。EE 的成分不是單一的,脂肪、色素、脂溶性物質的合成代謝是十分復雜的,可考慮研究脂肪酸的組成、脂溶性物質的含量來探討EE 的變化。結果表明,低水分有利于皂苷和咖啡因的降解,這可能與菌體生長速度較快和還原糖的大量生成有關。料液比為5∶5 的發酵茶渣綜合評分最高,與以往研究一致,即霉菌的生長繁殖所需的水分含量為40%~50%[29]。
3.3 接種量對發酵茶渣的影響
接種量可能會明顯影響發酵過程中的微生物生長速率[30]。較高的接種量可能會加快真菌的生長速度,但同時會增加營養物質的消耗速度[31],營養物質耗盡會減緩真菌的生長。接種量較小,延長了發酵過程所需的時間。在單因素和正交試驗中,不同接種量對發酵茶渣CP、EE、皂苷和咖啡因含量無顯著影響。可能由于接種量均處于一個較合適的范圍導致本試驗中接種量對這些指標無顯著影響。8 d 的生長,所有培養基中康寧木霉均達到了最大生物量,對茶渣的代謝轉化達到最高值。接種量為8%和10%的茶渣還原糖含量顯著高于其他接種量,可能是由于孢子初始數量較高,加快了康寧木霉的生長和代謝,還原糖是生命活動中末端代謝物,初始階段還原糖生成較多。二者沒有差異主要是孢子數已達到了能轉化利用的最大值,在底物一致的情況下,生長代謝強度不能繼續增加。結果表明,接種量為6%和10%的發酵茶渣黃酮含量較低,暫未能解釋不同接種量對黃酮含量的影響,可能是隨機效應。
3.4 溫度對發酵茶渣的影響
溫度對微生物代謝有重要影響,溫度過高過低均會抑制微生物的生長和代謝。發酵溫度一般為25~32 ℃,與微生物的生長動力學密切相關[32]。康寧木霉的最佳生長溫度是25~30 ℃,但是康寧木霉對外界條件的適應性相對較廣,生長溫度范圍較廣[33]。不同溫度對真菌代謝物的生成或轉化有重要影響,與最佳生長溫度不一定一致。發酵溫度為25~31 ℃時,CP 產量顯著增加。正交試驗中,發酵溫度是影響發酵茶渣CP 含量的主要因素,31 ℃的CP 含量顯著高于29、33 ℃的。這些結果表明,康寧木霉在31 ℃下能夠提高茶渣CP 含量。康寧木霉發酵茶渣在25 和31 ℃能產生較高含量的還原糖。還原糖的含量是還原糖的產生和消耗的差值,除了纖維素的降解外,菌體生長旺盛也會產生和消耗還原糖[34]。在25 ℃,菌體生長慢,消耗的還原糖較產生的少,則還原糖含量高。31 ℃菌體生長快,產生和消化還原糖均較多,有可能其差值與25 ℃的還原糖含量一致,具體機制需要更深入的研究才能解釋。25 ℃的黃酮含量最高,表明康寧木霉在較低溫度時累積黃酮。也有可能是,在較高的溫度條件下,菌體代謝加快,對茶渣黃酮的利用加強,黃酮被消耗,因此其他溫度的黃酮含量較低。這需要更多的研究來驗證這些猜測。康寧木霉在34 ℃降解皂苷的效果最佳,可能是降解皂苷的酶系在34 ℃時活力最高。咖啡因含量在31 和34 ℃時含量較高,說明康寧木霉在31~34 ℃時適合累積咖啡因。正交試驗表明,發酵溫度是影響發酵茶渣咖啡因含量的主要因素,31 ℃時咖啡因含量顯著高于29 ℃。咖啡因工業可考慮通過優化條件對茶渣資源再利用生產咖啡因。溫度過高或過低對康寧木霉的生命活動或產生一定的脅迫作用,對營養成分、功能成分的累積、合成效率有不同的效果。
3.5 時間對發酵茶渣的影響
發酵時間是影響茶渣營養價值的因素之一。康寧木霉發酵茶渣CP 含量隨時間增加而增加,這與朱飛等[35]的研究結果一致,黑曲霉發酵茶渣CP 含量隨時間的延長而提高。這可能是由于茶渣中菌體蛋白的不斷累積所致。EE 不受發酵時間影響,可能是康寧木霉對茶渣中的EE 利用較少,也有可能是康寧木霉代謝與合成的EE 成分相互抵消,如康寧木霉的綠色孢子,色素可溶于乙醚。還原糖是許多生物過程和酶反應的最終產物,真菌代謝產生的纖維素酶可以催化纖維素轉化為還原糖[36-37]。還原糖在第2 天達到最高值,與以往研究一致[34]。這是康寧木霉進入快速增長期,菌體生長迅速,代謝活性高的表現。菌體生長分泌各種淀粉酶、糖化酶將淀粉分解為低分子的還原糖,則還原糖含量提高。雖然,還原糖含量隨時間延長較第2 天下降,但依然高于未發酵的茶渣。這與綠色木霉發酵甘草(Glycyrrhiza uralensis)藥渣的還原糖含量先升后降的情況一致[38]。這說明,真菌發酵茶渣能產生大量的還原糖,為菌體的生長提供營養的同時,還改善了發酵茶渣的風味。黃酮含量在第6 天最高,此后下降。這說明菌體對黃酮的轉化達最高值,隨著康寧木霉的生長,黃酮又被吸收代謝。有研究表明,黑曲霉和綠色木霉發酵降低了桑葉茶黃酮含量[39]。隨時間延遲,康寧木霉對黃酮的消耗高于產生速度,表現為發酵6 d 后,隨時間延遲,黃酮含量降低。黃酮具有很強的抗氧化能力,這是改善動物腸道和免疫功能的主要特性之一[40-41]。微生物代謝降解抗營養因子被認為是最有前途的處理方法。高水平的皂苷會降低動物對營養的吸收,限制茶渣在飼料中的使用[42]。結果表明,隨著時間的延長,茶渣皂苷含量降低。以往有研究表明,真菌能降解皂苷[43]。但未有文獻表明康寧木霉能降解皂苷,暫不清楚降解機理。咖啡因是茶葉中含量最豐富的生物堿[5],其含量的提高降低了茶渣對動物的適口性。然而,適量的咖啡因具有抗氧化、抗糖尿病和減肥的作用[44]。結果表明,發酵茶渣的咖啡因含量隨時間增加而提高。咖啡因作為一種中樞神經系統的興奮劑[5],適量使用發酵茶渣可以刺激動物的中樞神經系統,促進血液循環。單因素試驗中發酵6 d 的綜合評分最高,可見茶渣發酵6 d 即可使用,同時6~10 d的評分接近,說明發酵茶渣在一定時間保存,營養價值不會降低。正交試驗中,發酵6 和7 d 的CP 含量差異不顯著,均顯著高于發酵5 d。在實際生產中,選擇發酵6 d 能減少生產成本,加快飼料的生產和應用。
3.6 發酵對茶渣營養成分和活性物質的影響
發酵后的茶渣CP 含量較高,原因可能是康寧木霉利用發酵基質的營養成分來合成菌體蛋白質,繼而增加了CP 含量。與以往研究一致,即黑曲霉發酵能夠提高茶渣的CP 含量[35]。CP 含量的提高,表明了茶渣經過微生物發酵可以作為動物飼料,這有利于推進廢棄物飼料化利用的研究。還原糖含量的提高主要與康寧木霉的代謝有關,菌體生長產生各種酶將淀粉、纖維素等分解為還原糖[36-37]。還原糖具有甜味,能改善發酵茶渣的適口性。還原糖作為小分子物質,容易被動物消化吸收。還原糖含量的增高主要來源于纖維素的降解,從這個角度來說,發酵茶渣能被動物較好地消化利用。康寧木霉增加了茶渣的黃酮含量,與以往研究結果不一致。黑曲霉和綠色木霉發酵降低了桑葉茶黃酮含量[39]。這歸因于康寧木霉與黑曲霉、綠色木霉酶系的不同、對營養物質代謝途徑的不同。發酵茶渣黃酮含量提高,有利于增加飼料的抗氧化能力,增強動物氧化應激的抵抗力[40-41]。真菌能降解皂苷[43],本試驗結果與此一致。皂苷含量的降低,有利于減少抗營養因子對動物生長的負面作用,可改善發酵茶渣的適口性。EE 含量與未發酵茶渣無顯著差異,可能是康寧木霉利用與生產EE 達到平衡狀態。
3.7 發酵對茶渣游離氨基酸的影響
游離氨基酸在蛋白質、脂肪和脂肪酸代謝、機體生長、免疫系統中起重要作用。必需氨基酸的含量與種類能反映出飼料的營養價值[45]。發酵茶渣中含有8 種必需氨基酸。康寧木霉發酵顯著提高了茶渣各種必需氨基酸和總氨基酸含量,即發酵有利于改善茶渣的營養價值。康寧木霉合成代謝中分泌多種蛋白酶,分解茶渣混合物中蛋白質,產生游離氨基酸。在康寧木霉的生長中,合成了苯丙氨酸、谷氨酰胺、β-丙氨酸、半胱氨酸、胱硫醚、鳥氨酸(未發酵茶渣中未檢測到)。經過發酵,茶渣中氨含量顯著降低,可以推測康寧木霉利用茶渣中的氨合成、轉化為游離氨基酸或蛋白質。游離氨基酸是重要的呈味物質[46]。發酵提高了茶渣的風味氨基酸含量和比例,能改善茶渣適口性。牛磺酸具有抗氧化、促生長、免疫調節等功能[47],γ-氨基正丁酸能減輕畜禽熱應激[48]。牛磺酸和γ-氨基正丁酸含量的提高,增強發酵茶渣作為動物飼料添加劑的功效。發酵6 或7 d 的部分氨基酸含量不同,這與發酵時間有關。不同時間下,微生物的新陳代謝有所不同,產生的游離氨基酸量則有差異。總之,康寧木霉發酵改善了茶渣的游離氨基酸含量和種類,是一種潛在的有價值的動物飼料。
4 結論
試驗表明,康寧木霉發酵茶渣(料液比為5∶5)的最佳條件是:基質比例為7.0∶2.5,發酵溫度為31 ℃,接種量為7%,發酵時間為6 或7 d。康寧木霉發酵改善了茶渣的營養成分、活性物質以及游離氨基酸含量。

