IL-38在胰腺癌中的表達水平及其臨床意義
王 盛 吳 耐 龔 帥 張蓬波 張 沖 張秀忠 任澤強
胰腺癌是一種起源于胰腺導管上皮細胞及腺泡細胞惡性轉變的致命性腫瘤,多發于男性和40~85歲人群,在無癥狀癌癥中居首位,具有高侵襲性、高病死率、高發生率特點[1]。因此,積極尋找早期診斷胰腺癌的生物學標志物,對于指導患者的臨床治療及改善預后具有重要意義。白細胞介素(interleukin,IL)-38是新近發現的一類能夠抑制炎癥作用的細胞因子,其歸屬于IL-1家族成員,因其能夠影響腫瘤微環境進而導致腫瘤細胞逃逸宿主免疫細胞對其殺傷作用,近年來其在腫瘤發生、發展中發揮的作用受到研究者廣泛關注[2~5]。既往研究表明,IL-38在乳腺癌、結直腸癌、肺癌、胃癌等惡性腫瘤中表達異常,并與患者的臨床病理資料相關[6~9]。然而,迄今為止國內外關于IL-38在胰腺癌中的研究目前尚無報道。本研究通過分析IL-38在胰腺癌中的表達水平以及與患者臨床病理資料的相關性,旨在評價IL-38是否可以作為胰腺癌篩查及評價腫瘤病期及預后的生物學指標,為臨床診療提供新的思路。
對象與方法
1.一般資料:選取2019年9月~2021年9月于徐州醫科大學附屬醫院普通外科限期行手術治療的胰腺癌患者(胰腺癌組)62例,收集其臨床病理資料、血液標本,其中男性35例,女性27例,患者平均年齡為57.56±10.13歲。另取同期筆者醫院健康體檢的志愿者55例作為健康對照組,其中男性31例,女性24例,平均年齡為53.65±12.17歲。兩組受試者的年齡、性別比較,差異均無統計學意義(P均>0.05)。患者納入標準:①術后病理證實為胰腺癌;②均為首次治療;③術前均未行放療、化療及其他抗腫瘤治療;④臨床資料完整。排除標準:①伴有自身免疫性疾病、免疫缺陷病或合并其他器官惡性腫瘤者;②存在全身感染性疾病者;③因其他因素使用免疫抑制和(或)調節劑者;④合并其他胰腺器質性疾病者。對照組納入標準:①各項體檢指標無異常;②半年內無外傷及其他疾病史;③無其他合并癥。本研究獲得徐州醫科大學附屬醫院醫學倫理學委員會的批準,所有受試者均簽署知情同意書。
2.酶聯免疫吸附法(ELISA)檢測血清中IL-38水平:使用人IL-38 ELISA試劑盒(美國ProteinTech Group公司)說明書操作來測定IL-38濃度。標本在室溫下解凍,再次離心。設置標準孔(8個)和樣品孔,每個孔加100μl待測標準品或樣品,在37℃孵育2h后,丟棄液體并甩干,向每個孔中加入抗生物素抗體100μl 在37℃孵育箱內孵育50min,洗3次,甩干,加入100μl過氧化物酶標記親和素工作液,孵育1h。棄液體,將其甩干,板洗5次,并向每個孔中添加90μl的底物溶液37℃孵育20min,然后加入50μl終止溶液終止反應,在450nm處檢測每個孔的吸光度(A)值,并自動轉換為濃度值。
3.流式細胞術檢測外周血單個核細胞(PBMC)中Treg和Th17細胞的表達:采集所有研究對象5ml抗凝靜脈血,采用人淋巴細胞分離液(天津灝洋生物公司)通過密度梯度離心法分離得到PBMC,一部分PBMC經PBS洗滌離心后加入鼠抗人CD4-FITC抗體,鼠抗人CD25-PE抗體,鼠抗人CD127-Alexa Fluor 647抗體(美國BD公司),同時設同型對照管,室溫避光孵育30min后,采用LSRF ortessa型流式細胞儀(美國BD公司)檢測Treg細胞,其表型為CD4+CD25+CD127-。另一部分PBMC加入2μl白細胞活化雞尾酒(leukocyte activation cocktail)和BD GolgiPlug刺激劑(美國BD公司),37℃細胞培養箱內孵育6h;流式管收集細胞,加入鼠抗人CD4-BV421抗體(美國BD公司),室溫避光孵育30min后加入固定破膜液固定細胞10min,洗滌離心后加入5μl鼠抗人IL-17A-PE抗體(美國BD公司),室溫避光孵育30min后,采用LSRF ortessa型流式細胞儀(美國BD公司)檢測Th17細胞,其表型為CD4+IL-17A+。

結 果
1.兩組患者血清IL-38水平比較:胰腺癌組患者血清IL-38為111.97±35.03pg/ml,健康對照組血清IL-38為156.39±36.98pg/ml。兩組血清白細胞介素水平比較,差異有統計學意義(t=6.668,P<0.001),詳見圖1。
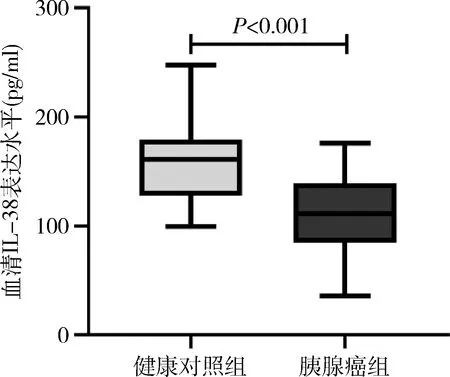
圖1 胰腺癌組及健康對照組血清中IL-38的表達水平
2.胰腺癌組患者血清IL-38水平與患者臨床病理資料的聯系:胰腺癌組患者IL-38水平與不同的腫瘤分期、不同的分化類型以及是否有淋巴結轉移有關,差異有統計學意義;與患者年齡、性別、腫瘤直徑及腫瘤部位無明顯相關性(P>0.05),詳見表1。
表1 IL-38 表達量與胰腺癌組患者臨床病理資料的關系
3.兩組外周血Treg和Th17細胞表達水平比較:胰腺癌組外周血中Treg細胞表達水平為3.18%±1.36%,健康對照組為4.91%±1.15%,兩組比較,差異有統計學意義(t=7.396,P<0.001),詳見圖2中A~E。胰腺癌組外周血中Th17細胞表達水平為2.87%±1.08%,健康對照組為2.05%±0.70%,兩組比較差異有統計學意義(t=-4.934,P<0.001),詳見圖2中F~H。

圖2 兩組外周血Treg細胞和Th17細胞百分率比較A~D.CD4+CD25+CD127-Treg細胞流式細胞術設門圖;E.兩組外周血Treg細胞百分率柱狀圖;F~G.CD4+IL-17A+Th17細胞流式細胞術設門圖;H.兩組外周血Th17細胞百分率柱狀圖
4.胰腺癌組血清IL-38水平與外周血Treg和Th17細胞表達水平相關性分析:Pearson相關性分析顯示胰腺癌患者血清IL-38水平與外周血Treg細胞表達水平呈正相關(r=0.44,P<0.01),詳見圖3A;胰腺癌患者血清IL-38水平與外周血Th17細胞表達水平呈負相關(r=-0.45,P<0.01),詳見圖3B。

圖3 胰腺癌患者血清IL-38表達水平與Treg和Th17細胞相關性分析
5.IL-38對胰腺癌的風險預測價值 ROC曲線分析:血清IL-38為150.65pg/ml時,預測診斷胰腺癌的曲線下面積為0.807(P<0.05),敏感度為63.6%,特異性為87.1%,詳見圖4。
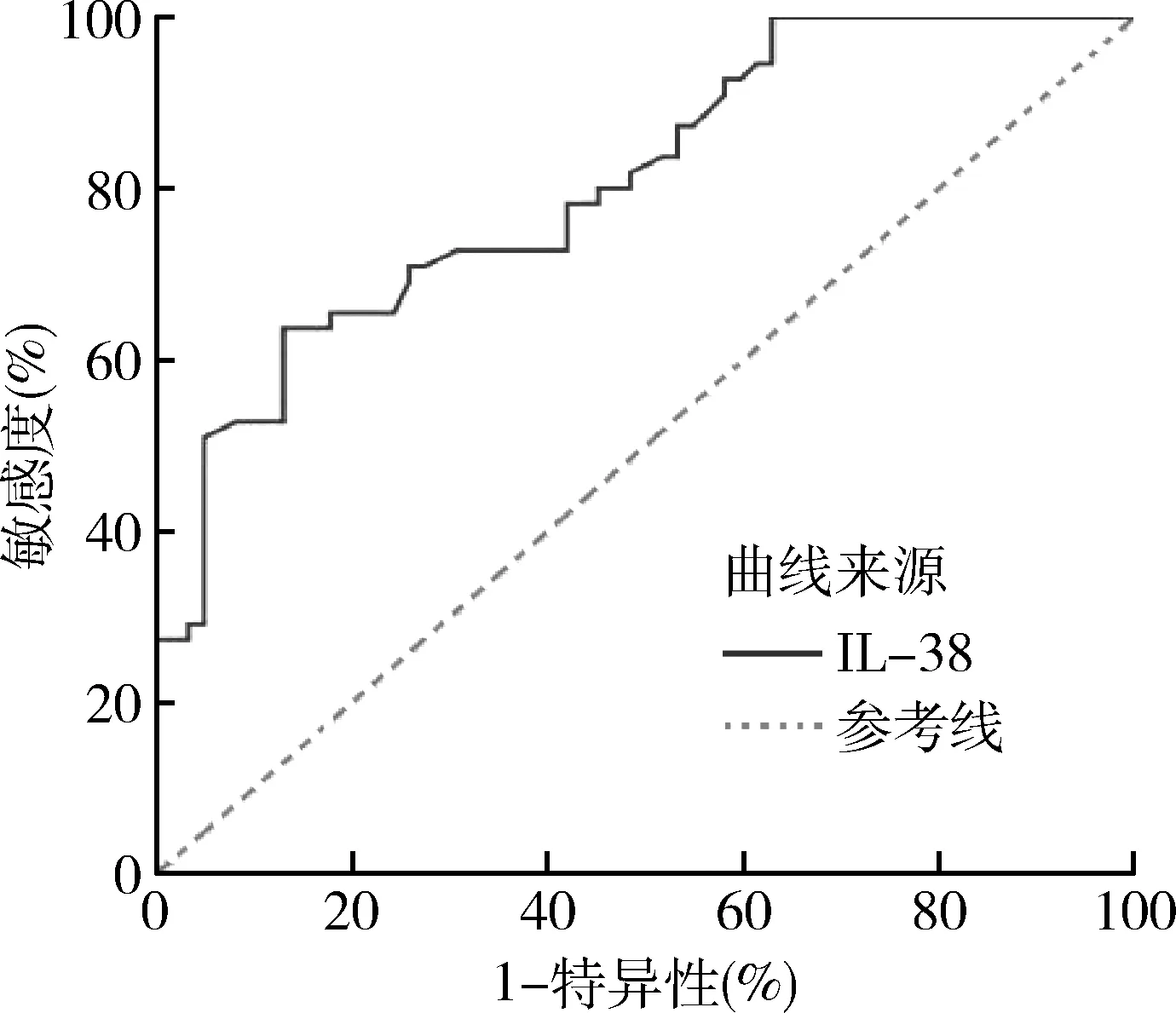
圖4 ROC曲線結果
討 論
近年來發現的細胞因子IL-38位于于人類第2號染色體長臂1區4帶1亞帶,相對分子質量為16.9kDa,由5個外顯子組成[10]。在序列上IL-38與IL-1受體拮抗劑(IL-1Ra)高度同源,能夠抑制IL-1α和IL-1β表達[11]。研究發現,過表達IL-1α和IL-1β均可促進胰腺癌細胞增殖、侵襲、轉移和腫瘤血管形成[12,13]。此外,另一項研究表明,外源性給予IL-1Ra可以抑制胰腺癌細胞增殖、侵襲,并提高抗腫瘤藥物的輸送能力[14]。鑒于IL-38與IL-1Ra高度同源,其在功能上同樣發揮抑炎作用,那么IL-38是否也參與胰腺癌的發病引起筆者極大的興趣。本研究結果表明,胰腺癌患者血清IL-38水平低于健康對照組,差異有統計學意義,這提示IL-38很可能在胰腺癌中發揮抗腫瘤作用。此外,本研究還發現IL-38在胰腺癌患者中的表達水平在較晚的腫瘤分期、較差的分化類型以及有淋巴結轉移患者中表達水平進一步降低,而腫瘤分期、分級及淋巴結轉移是評估胰腺癌患者預后的重要指標,所以本研究結果也間接提示胰腺癌患者血清中IL-38水平可以在一定程度反映患者的預后。
免疫應答反應一直以來是腫瘤學研究的中心問題,腫瘤微環境中免疫細胞的平衡與腫瘤的發生、發展密切相關,其中Th17細胞和Treg細胞一直以來是研究腫瘤免疫的熱點,Th17細胞能夠促進腫瘤免疫反應,而Treg細胞能夠抑制腫瘤免疫反應[15,16]。He等[15]研究發現,用抗體中和Th17細胞分泌的IL-17因子能夠抑制野生型小鼠的腫瘤生長,而過表達IL-17則促進了腫瘤的生長。在胰腺癌模型中,Zhang等[17]研究發現,敲低模型鼠中Treg細胞能夠導致腫瘤進展加速。本研究發現,胰腺癌患者外周血Th17細胞表達水平高于健康對照組,而Treg細胞在胰腺癌患者外周血中的表達水平低于健康對照組,差異均有統計學意義,這提示Th17細胞很可能通過發揮促癌作用,而Treg細胞發揮抑癌作用參與胰腺癌的發病。因此,積極尋找調節Th17/Treg細胞平衡的因素顯得極為重要。
近年來越來越多的研究證據表明,IL-38是Th17/Treg細胞平衡的關鍵調控者[18]。IL-38能夠抑制NF-κB和MAPKs炎癥通路,進而抑制Th17細胞產生和分化[19]。此外,IL-38還能夠限制巨噬細胞的功能,進而打破巨噬細胞維持Th17/Treg細胞免疫平衡的作用,參與腫瘤、炎性疾病的發生[20]。本研究中胰腺癌患者血清中IL-38表達水平與外周血Th17細胞表達水平呈負相關,與Treg細胞呈正相關,這間接提示IL-38很可能通過調節Treg/Th17細胞平衡參與胰腺癌的發生、發展。鑒于IL-38在胰腺癌中的重要地位,進一步繪制ROC曲線對胰腺癌的患病風險進行預測,發現胰腺癌患者血清中IL-38為最佳截點150.65pg/ml時,曲線下面積為0.807,在診斷方面,其敏感度為63.6%,特異性為87.1%,具有較好的敏感度和特異性。
然而,本研究還存在一定的不足,本研究沒有對癌組織中IL-38的mRNA水平進行研究,將在未來的研究中進行探討;此外本研究為前瞻性隊列研究,比較了胰腺癌患者外周血中IL-38水平,沒有進一步深入研究IL-38在胰腺癌發病中發揮何種作用以及發病機制。
綜上所述,IL-38在胰腺癌患者血清中表達水平降低,并且表達水平與患者腫瘤分期、分化程度及是否存在淋巴結轉移有關。另外,應用外周血IL-38表達水平建立的胰腺癌風險預測模型具有良好的應用價值,有望成為新的生物學指標。

