迷走神經C傳入纖維通路在胃食管反流性咳嗽中的作用
平明芳 楊霞 劉偉榮 顧偉忠 舒小莉 江米足
慢性咳嗽是影響人們生活質量的最常見的臨床問題之一,全世界約有10%的人受到慢性咳嗽的困擾[1-3]。胃食管反流性咳嗽(gastroesophageal reflux cough,GERC)是引起慢性咳嗽的三大病因之一[4]。胃食管反流的主要病理生理特征是酸反流,抑酸治療可使部分GERC患者咳嗽癥狀得到緩解,但也有很大一部分患者即使抗酸治療仍有持續的咳嗽癥狀[5-7]。目前抗酸治療無效的GERC是臨床上一個棘手的問題[8-9]。GERC主要與食管-支氣管神經反射及氣道高反應性有關,兩者均與迷走神經通路介導的神經反射引起氣道神經源性炎癥相關[10-11],但具體的通路及機制尚不清楚。本研究通過建立GERC大鼠模型,觀察迷走神經C傳入纖維通路在GERC中的作用。
1 材料和方法
1.1 實驗動物 普通級健康雄性Wistar新生大鼠45只,體質量5~6 g,購于浙江大學實驗動物中心,所有新生大鼠均喂養至8周。飼養于清潔級環境下,實驗過程中所有的操作都嚴格遵守《實驗動物管理條例》。
1.2 儀器與試劑 微量紫外分光光度計(Nano-Drop?ND-1000)、ABI 7500熒光定量PCR儀(美國賽默飛公司);辣椒素(上海廣銳生物科技有限公司);胃蛋白酶、瓊脂糖、烏拉坦、乙酰甲膽堿(methacholine,Mch)(日本Sigma公司);鹽酸(國藥集團化學試劑有限公司);鹽酸氯胺酮注射液(福建古田藥業集團);焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水(上海生物工程技術有限公司);6×電泳上樣緩沖液、SYBR Premix Ex TaqⅡ(Perfect Real Time)、引物、Trizol、反轉錄試劑盒、支氣管激發試驗相關試劑(日本Takara公司)。
1.3 造模方法和分組 采用隨機數字表法將45只大鼠分為4組,R1組大鼠10只,實驗過程中死亡1只;R2組大鼠10只,實驗過程中死亡3只;R3組大鼠15只,實驗過程中死亡6只;R4組大鼠10只,實驗過程中死亡2只。R1組:陽性對照組(鹽酸灌注組);R2組:暫時性食管迷走神經C傳入纖維變性型實驗組;R3組:持久性食管迷走神經C傳入纖維變性型實驗組;R4組:陰性對照組(0.9%氯化鈉溶液灌注組)。每次實驗操作前,各組大鼠灌注鹽酸之前均先腹腔注射500 mg/kg鹽酸氯胺酮注射液進行輕度麻醉,然后用5 F胃管經口插至食管中下段,并將微量注射泵與胃管外端相連。R1組:新生大鼠飼養到8周齡后將濃度0.1 mol/L鹽酸溶液置于注射泵中緩慢灌注,速率為18 ml/h,20 min/次,1次/d,連續2周。R2組:新生鼠飼養到8周齡后皮下注射50 mg/kg辣椒素,連續2 d,連續酸灌注2周(灌注方式同R1組)。R3組:新生鼠生后2 d皮下注射50 mg/kg辣椒素,連續2 d,8周齡后連續酸灌注2周(灌注方式同R1組)。R4組:新生大鼠飼養到8周齡后連續食管內0.9%氯化鈉溶液灌注2周(灌注方式同R1組)。
1.4 支氣管激發試驗 最后1次食管灌注24 h后,使用25%烏拉坦(按1.2 mg/kg劑量)腹腔注射麻醉大鼠,麻醉后完成氣管插管,并將大鼠移到體積描記器內。通過分析體積描記器相連接的生物信號記錄測定跨肺壓、基礎潮氣量及氣道流速,然后將0.9%氯化鈉溶液、Mch分別裝入霧化罐后連接氣管插管霧化刺激大鼠30 s,Mch 激發濃度分別為 0.031 25、0.062 5、0.125、0.25、0.5、1、2、4 mmol/L,觀察用不同濃度Mch行支氣管激發試驗后大鼠的跨肺壓、潮氣量及氣道流速的變化情況。計算公式:肺阻力(cmH2O·ml-1·s-1)=跨肺壓/氣道流速;動態肺順應性(ml/cmH2O)=潮氣量/跨肺壓;肺阻力增加百分比=(激發后肺阻力-基礎肺阻力)/基礎肺阻力×100%;動態肺順應性減少百分比=(基礎動態肺順應性-激發后動態肺順應性)/基礎動態肺順應性×100%。
1.5 標本收集與病理檢查 各組小鼠在完成激發試驗后,腹腔注射25%烏拉坦(按0.6 mg/kg劑量)補充麻醉,斷頭處死。取氣管組織、右側肺近肺門約0.5 cm處肺組織及食管下端近括約肌處0.5 cm食管組織,放在10%多聚甲醛中12 h,固定,用石蠟包埋、切片、制片,并用HE染色處理標本。
1.6 肺組織神經激肽受體1(neurokinin 1 receptor,NK1R)、神經激肽受體2(neurokinin 2 receptor,NK2R)、神經激肽受體3(neurokinin 3 receptor,NK3R)及食管組織5-羥色胺受體3(5-hydroxytyptamine receptor 3,5-HT3R)、瞬時感受器電位香草酸受體1(transient receptor potential vanilloid receptor 1,TRPV1)、酸敏感離子通道3(acid-sensing ion channel 3,ASIC3)mRNA表達水平檢測 采用RT-PCR法。采用Trizol法分別提取肺組織和食管組織總RNA,嚴格按照反轉錄試劑盒說明書操作。用微量紫外分光光度計(NanoDrop?ND-1000)檢測肺組織、食管組織總RNA純度和含量。6個目的基因的上下游引物序列及產物長度見表1。在ABI 7500型實時熒光定量PCR擴增儀上進行PCR反應,反應參數為:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 45 s,共40個循環;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。采用2-ΔΔCt法計算 NK1R、NK2R、NK3R、5-HT3R、TRPV1和 ASIC3 mRNA表達水平。

表1 6個基因的上下游引物序列及產物長度
1.7 統計學處理 采用SPSS 19.0統計軟件。計量資料以表示,兩組間比較采用兩獨立樣本t檢驗;多組間比較采用單因素方差分析,兩兩比較采用SNK-q檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 4組大鼠肺阻力及順應性的變化與比較 當Mch濃度升到0.25、0.5 mmol/L時,R1組大鼠肺阻力增加百分比明顯大于R2組、R3組、R4組,差異均有統計學意義(均P<0.05)。當Mch濃度升到0.5 mmol/L時,R1組大鼠動態肺順應性減少百分比大于R2組、R3組及R4組,差異均有統計學意義(均P<0.05),提示大鼠氣道反應性增高,見圖1。
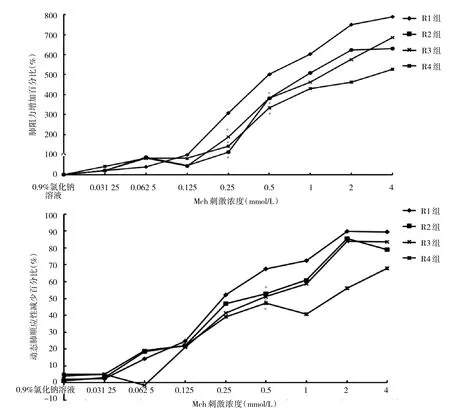
圖1 Mch刺激后4組大鼠肺阻力和肺順應性的變化與比較
2.2 4組大鼠氣管、肺和食管組織病理學改變的比較 病理檢查發現,與R2、R3和R4組比較,R1組大鼠氣管組織、肺組織及食管組織的炎癥性病變更為明顯,見圖2-4。
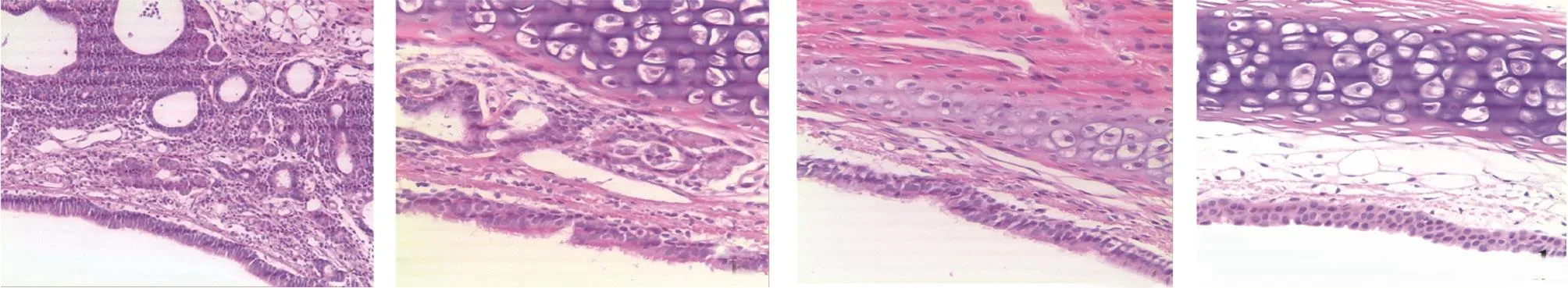
圖2 4組大鼠氣管組織病理變化的比較(a:R1組氣管組織纖毛柱狀上皮增生增厚明顯,排列紊亂,部分脫落,黏膜下層血管出血性充血明顯,炎癥細胞浸潤明顯;b-c:R2、R3組氣管纖毛柱狀上皮有少許脫落,有少許炎癥細胞浸潤;d:R4組氣管結構清晰,白細胞分類基本正常,未見明顯炎癥細胞浸潤和血管充血;HE染色,×100)
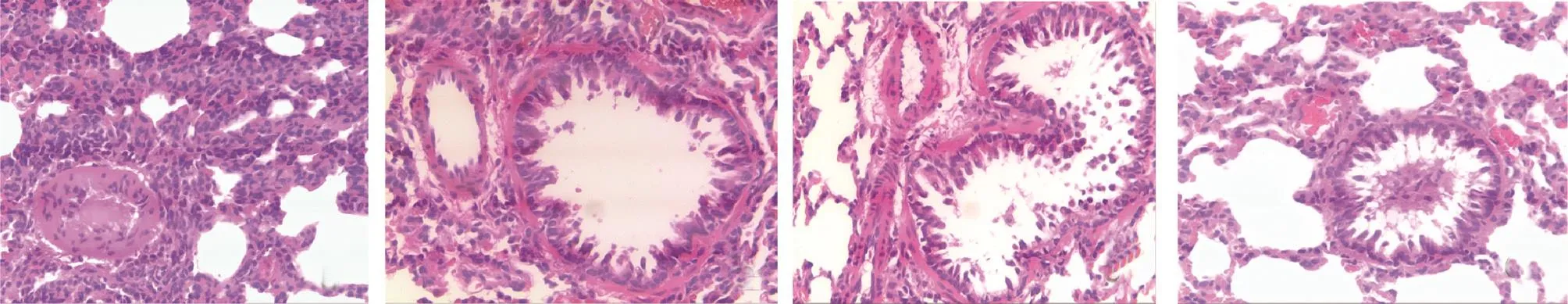
圖3 4組大鼠肺組織病理變化的比較(a:R1組肺組織的炎癥細胞浸潤明顯增多,小氣道管壁增厚,氣道狹窄,分泌物增多;b-c:R2、R3組肺組織中炎癥細胞輕度增多;d:R4組肺泡結構正常;HE染色,×100)
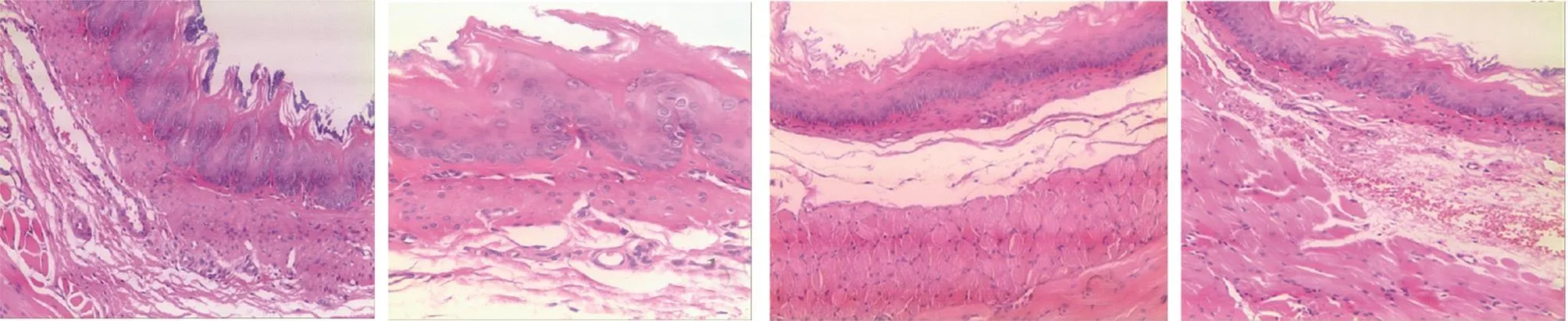
圖4 4組大鼠食管組織病理變化的比較(a:R1組食管鱗狀上皮增厚,上皮基底層乳頭延長,固有層炎癥細胞浸潤明顯;b-c:R2、R3組食管鱗狀上皮輕度增厚,上皮基底層呈波浪形,固有層見輕度炎癥細胞浸潤;d:R4組食管鱗狀上皮結構基本正常,炎癥細胞不明顯;HE染色,×100)
2.3 4組大鼠肺組織中NK1R、NK2R、NK3R mRNA表達水平比較 4組大鼠肺組織中NK1R、NK2R mRNA表達水平比較差異均無統計學意義(均P>0.05),R3組大鼠肺組織中NK3R mRNA表達水平高于R1組、R2組和R4組,差異均有統計學意義(均P<0.05),見圖5。
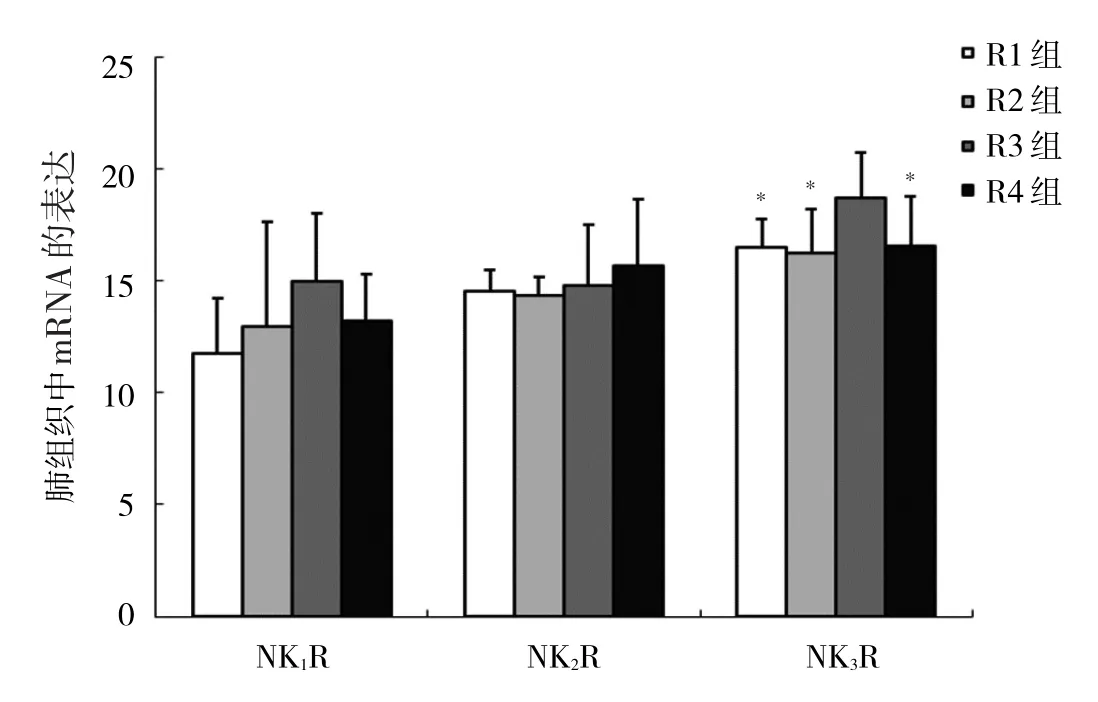
圖5 4組大鼠肺組織中NK1R、NK2R、NK3R mRNA表達水平比較
2.4 4組大鼠食管組織中5-HT3R、TRPV1和ASIC3 mRNA表達水平比較 4組大鼠食管組織中5-HT3R、TRPV1和ASIC3 mRNA表達水平比較差異均無統計學意義(均P>0.05),見圖6。
圖6 4組大鼠食管組織中5-HT3R、TRPV1和ASIC3 mRNA表達水平比較
3 討論
現有研究表明GERC發病的機制包括食管-支氣管神經反射及氣道高反應性[12],它們均與迷走神經C傳入纖維通路有關[13]。迷走神經支氣管肺C類神經纖維是一種廣泛分布在支氣管、肺部的傷害感受器,它對許多炎癥介質如緩激肽、5-羥色胺及TRPV1受體激活劑特別敏感[14]。觸發支氣管肺C纖維傷害感受器可引起神經肽如P物質(substance P,SP)、神經肽A(neurokinin A,NKA)、神經肽B(neurokinin B,NKB)的釋放,當神經肽物質大量釋放時可以誘發神經源性炎癥,主要臨床表現為咳嗽、黏液分泌增加、心動過緩甚至呼吸暫停。臨床研究表明GERC患者質子泵抑制劑及促胃動力劑治療4周后,如果咳嗽明顯緩解、血漿和痰SP水平明顯增高,需考慮與神經源性炎癥相關[15]。動物實驗發現給豚鼠及兔的食管灌注鹽酸,可以激發其氣道神經源性炎癥,當使用NK1R和NK3R阻斷劑后可以明顯抑制這種炎癥的產生[16-18]。既往研究認為迷走神經傳入通路中的感覺纖維也在調節咳嗽反射中起著重要作用[19]。Chen等[20]在豚鼠的食管下段內注射鹽酸溶液,發現行迷走神經切斷術組豚鼠血漿中SP濃度和氣道微血管滲漏均低于其他組,表明迷走神經可能介導了由食管-支氣管反射引起的GERC的氣道炎癥。本研究通過對大鼠進行鹽酸食管內持續灌注2周,結果發現在顯微鏡下R1組食管鱗狀上皮增厚,上皮基底層乳頭延長,固有層炎癥細胞浸潤明顯。通過支氣管激發試驗檢測大鼠肺阻力和順應性時發現,當Mch濃度升到0.25及0.5 mmol/L時,R1組大鼠肺阻力增加百分比明顯高于R2、R3和R4組,而當Mch濃度升到0.5 mmol/L時,R1組大鼠動態肺順應性減少百分比明顯高于R2、R3和R4組,上述表型提示鹽酸灌注后大鼠氣道反應性增高,對環境的刺激閾值降低,在受到外界有害的環境刺激物刺激時更易出現咳嗽及氣促、胸悶等癥狀,提示迷走神經通路在GERC中起著重要作用。進一步肺部研究發現,與其他3組相比,R3組NK3R mRNA表達水平明顯升高,考慮迷走神經持久變性后,鹽酸灌注后未能引起大鼠肺內NKB增多,而大鼠肺內NK3R表達明顯增多,使NKB更容易與NK3R結合,讓NKB更大地發揮其作用,提示迷走神經C傳入纖維在GERC中的重要作用,綜合迷走神經對有害刺激的反應,考慮迷走神經C傳入纖維是GERC的主要傳入纖維。
綜上所述,大鼠食管酸灌注模型可以引起食管組織的黏膜損傷、氣道高反應性以及氣道神經源性炎癥。食管酸灌注及持久迷走神經C纖維損傷可引起肺組織內NK3R增高,迷走神經C傳入纖維通路可能在GERC中起著重要作用。本實驗不足之處是未對肺組織內的神經肽SP、NKA、NKB含量進行直接測定,這將在后續的研究中進一步完善。

