基于網絡藥理學及分子對接研究消風散治療過敏性結膜炎的作用機制※
董照陽 陳 茜 魏 偉
(1.江蘇省南京市江寧中醫院眼科,江蘇 南京 210000;2.南京中醫藥大學第一臨床醫學院2019級博士研究生,江蘇 南京 210000;3.南京中醫藥大學第一臨床醫學院眼科教研室,江蘇 南京 210000)
近年來,隨著大氣污染的加重及眼部衛生因素等影響,過敏性結膜炎(allergic conjunctivitis,AC)的發病率逐年增長,患病率高達30%[1-2]。AC是結膜對變應原刺激產生超敏反應所引起的一類常見眼科疾病,主要與免疫球蛋白E(IgE)水平異常所致的Ⅰ型變態反應和部分T淋巴細胞介導的Ⅳ型變態反應有關。AC發病機制復雜,至今尚未闡明,其主要發病機制為變應原與眼部組織接觸,并與特異性抗原IgE結合,導致肥大細胞和嗜堿性粒細胞釋放前列腺素、組胺、白三烯等因子。AC常見癥狀為眼癢和異物感,并伴有結膜充血、水腫、濾泡等表現。輕度結膜炎會影響人們的生活和工作,重度結膜炎可造成不可逆轉的眼損傷,已引起眼科醫生的廣泛重視。目前,AC西醫治療以滴眼藥水為主,主要有抗組胺藥、肥大細胞穩定劑、糖皮質激素、免疫抑制劑、血管收縮劑、非甾體抗炎藥等。但其療程往往較長,治療后可減輕結膜組織的變態反應,但用藥一段時間后病情易反復,且存在較多副作用[3-4]。
中醫古籍《諸病源候論·目病諸候》《審視瑤函》和《太平圣惠方》等對AC均有記載,該病多由風熱時邪侵犯肺衛肌表,上壅胞瞼、白睛,阻滯脈絡,氣血不暢而發病。故在AC的診治過程中應從整體觀念出發,全面認識AC的發病因素。中醫藥治療AC療效確切且安全性高,為防治AC復發和加重積累了豐富診治經驗。相關研究表明,中藥可通過多通路和多靶點發揮治療AC作用,也可與糖皮質激素聯用,減少糖皮質激素的不良反應,在臨床應用上具有巨大優勢[5]。中藥治療以清熱利濕、通絡止痛、解毒涼血類為主。消風散出自明·陳實功《外科正宗》,由荊芥、防風、牛蒡子、蟬蛻、當歸、生地黃、石膏、知母、苦參、蒼術、胡麻仁、甘草、木通組成,具有疏風養血、清熱除濕之功效。該方在臨床上廣泛應用于蕁麻疹、濕疹、皮膚瘙癢等皮膚病領域[6-8]。我們在臨床上依據養血、疏風、清熱和祛濕四法,使用消風散治療AC,治療后結膜充血、眼癢和異物感等諸癥減輕。目前對消風散治療AC的臨床和實驗研究較少,給中藥的有效應用帶來了局限。
網絡藥理學(network pharmacology)通過融合系統生物學和藥理學揭示了中藥在人體調節網絡中的作用。網絡藥理學通過研究中藥、疾病、靶點與通路之間的復雜關系,進一步闡明中藥作用機制、藥效物質基礎,對新藥研發具有重要的意義。因此,本研究利用網絡藥理學相關數據庫聯合分子對接方法,構建“多成分-多靶點-多途徑” 之間的復雜網絡,系統地研究消風散治療AC的成分、作用靶點及調控通路的信息,為以后的臨床應用提供理論依據。
1 資料與方法
1.1 消風散化學成分和作用靶點篩選 通過中藥系統藥理學數據庫與分析平臺(TCMSP)(http://tcmspw.com)檢索消風散的化學成分,以口服生物利用度(OB)≥30%和類藥性(DL) ≥0.18為藥物篩選的關鍵參數,記錄最終得到符合條件的化學成分。并利用此平臺搜索有效成分的蛋白作用靶點,應用Uniprot數據庫(https://www.uniprot.org)檢索上述靶點名稱,確認人源靶點,得到靶標蛋白所對應的基因名。
1.2 AC相關靶點基因獲取 通過對人類基因數據庫(Geen Cards)(https://www.genecards.org)、疾病相關的基因與突變位點數據庫(Dis Ge NET) v 5.0(http://www.disgenet.org/web/DisGeNET/menu/home)和療效藥靶標數據庫(TTD)4.3.02(https://db.idrblab.org/ttd),以“allergic conjunctivitis”為關鍵詞進行檢索,得到AC的相關靶點基因。
1.3 化合物-疾病靶點網絡構建及可視化分析 將獲得的消風散相關靶點與AC靶點基因進行Venn 2.1(https://bioinfogp.cnb.csic.es/tools/venny/)作圖分析,獲得二者交集靶點。然后借助Cytoscape 3.7.2軟件(http://www.cytoscape.org/)進行“化合物-疾病靶點”網絡圖構建,根據化合物與靶點連接情況,篩選消風散的主要化合物。
1.4 交集靶點蛋白質-蛋白質相互作用(PPI)網絡構建及關鍵靶點篩選 利用STRING在線數據庫對交集靶點的PPI進行分析,將交集靶點信息導入STRING數據庫,選擇“multiple proteins”模式,物種選擇“Homo sapiens”,最低相互作用評分設置為0.9作為篩選條件,從而得到靶點的PPI信息。保存tsv格式文件,導入至Cytoscape 3.7.2軟件中,獲得PPI,將網絡結果可視化,根據中心度值(BC)、親中心度(CC)和等級值(DC)篩選關鍵作用靶點。
1.5 基因本體(GO)功能和京都基因與基因組百科全書(KEGG)通路富集分析 為了進一步了解上述靶標蛋白基因的功能以及在信號通路中的作用,將篩選得到的交集靶點導入DAVID 6.8(https://david.ncifcrf.gov),基因列表對應的物種為“Homo Sapiens”,進行GO功能和KEGG通路富集分析。以P<0.05進行靶基因篩選,進一步說明消風散的靶點蛋白在基因功能和信號通路中的作用,并應用Graph Pad Prism 7軟件和Omishare(http://www.omicshare.com/tools/index.php)制作柱狀圖和氣泡圖,對結果進行可視化分析。
1.6 分子對接驗證 首先,根據PPI篩選出關鍵靶點,利用蛋白質結構數據庫(PDB)(https://pubchem.ncbi.nlm.nih.gov)下載核心靶點的蛋白結構,然后使用Pymol去除水分子和結合的配體,保存為pdb格式。然后,利用Swiss Dock在線對接分析對接服務器獲得對接評分,以評價消風散關鍵活性成分與關鍵靶點之間的對接效果。
2 結果
2.1 消風散的活性成分及作用靶點篩選結果 本研究通過用TCMSP數據庫對消風散方中中藥進行活性成分檢索,OB和DL篩選并刪除重復項后,共得到183個活性化合物。同時,在TCMSP 數據庫Related Targets中得到化合物的相關靶點,由UniProt統一命名后,排除未找到的人的基因,共涉及231個基因Symbol。
2.2 AC相關靶點基因的篩選 通過Geen Cards數據庫得到AC相關靶點1639個,通過篩選設置relevance score>5,最終獲得363個相關靶點;Dis Ge NET數據庫得到與AC相關靶點20個;TTD數據庫得到與AC相關靶點4個。刪除重復靶點16個,獲得疾病相關靶點371個。
2.3 “化合物-疾病靶點”的網絡構建及可視化分析 利用Venn 2.1軟件將消風散的活性化合物對應的231個藥物靶點與AC對應的371個靶點基因取交集,獲得“活性化合物-AC”共同靶點基因49個,見圖1。將49個共同靶點通過Cytoscape 3.7.2軟件構建消風散“化合物-共同靶點-疾病”相互作用網絡圖,提取消風散“化合物-疾病靶點”的核心網絡,見圖2。從圖2可看出同一活性成分可作用于不同靶點基因,不同活性成分也可作用于同一靶點基因。其中,連接度較高的化合物有Quercetin、Luteolin、Wogonin、β-sitosterol、Stigmasterol、5-O-Methylvisamminol等(見表1),這些化合物可能是消風散治療AC的關鍵活性成分。
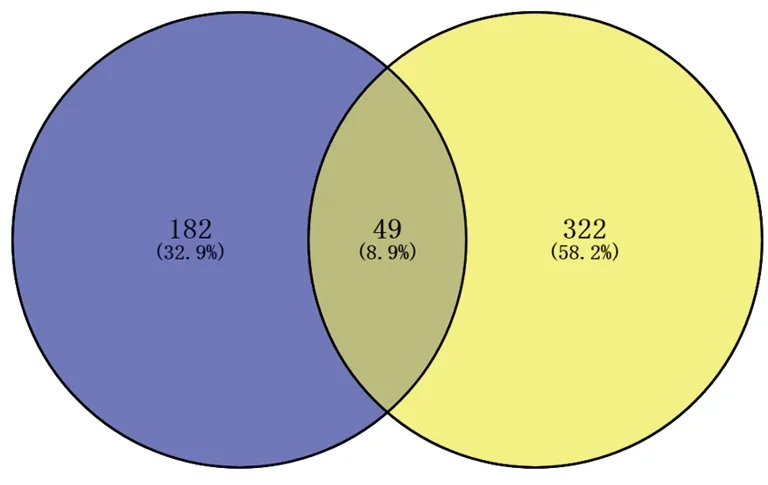
圖1 消風散活性化合物靶點與AC疾病靶點關系Venn圖

表1 消風散治療AC的關鍵活性成分

紫色橢圓形代表AC相關靶點基因,綠色長方形代表有效成分化合物,灰色線條代表相互作用關系
2.4 PPI網絡圖構建與分析 將49交集靶點導入STRING中,保存其tsv格式文件。將獲取tsv文件導入Cytoscape 3.7.2軟件進行網絡拓撲學分析后,得到消風散對AC作用PPI網絡圖。網絡中含有45個節點,159條相互作用關系。利用Cytoscape 3.7.2的CytoNCA插件對以上結果進行拓撲學參數分析和篩選。如圖3所示,經過2次篩選,BC、CC和DC均大于中位數的靶點分別為信號轉導和轉錄激活因子3(STAT3)、白細胞介素6(IL-6)、JUN、白細胞介素4(IL-4)、血管內皮生長因子A(VEGFA)和絲裂原活化蛋白激酶14(MAPK14)。
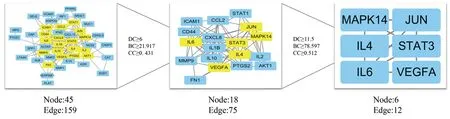
圖3 消風散治療AC相關靶點的PPI網絡及其關鍵靶點網絡
2.5 GO功能富集分析和KEGG通路富集分析 DAVID中GO功能富集分析以P<0.05為閾值得到79個條目。其中,生物過程(BP)條目62個,細胞組成(CC)條目7個,分子功能(MF)條目10個。取排名前10的條目,通過Graph Pad Prism 7軟件將這些條目做成可視化條形圖。消風散治療AC涉及細胞因子活性、血紅素結合、生長因子活性、過氧化物酶活性、趨化因子活性和前列腺素內過氧化物合酶活性等MF;與細胞對脂多糖的反應、RNA聚合酶Ⅱ啟動子轉錄的正調節、免疫反應、內皮細胞凋亡過程的負調控、炎性反應、調節血壓、T淋巴細胞增殖的正調控和凋亡過程的負調控等BP相關;與細胞外間隙、質膜外側、細胞外基質、胞外外泌體等CC相關。見圖4。

圖4 消風散治療AC的GO功能富集分析圖
對消風散作用于AC的主要靶點進行KEGG通路富集分析,以P<0.05為閾值篩選得到55條信號通路,主要涉及腫瘤壞死因子(TNF)信號通路、T淋巴細胞受體(T cell receptor)信號通路、缺氧誘導因子1(HIF-1)信號通路、類風濕關節炎和炎癥性腸病(IBD)信號通路等。通過Omicshare軟件對其進行可視化分析,氣泡圖見圖5。

注:圓點越大,富集基因數目越多;P值越小,圓點顏色越黑
2.5 關鍵靶點的分子對接 選擇關鍵靶點STAT3、IL-6、JUN、IL-4、VEGFA和MAPK14與對應的核心活性成分Quercetin進行分子對接,以直觀的方式展示Quercetin的最佳構型和關鍵靶點之間的相互作用。分子對接結果如圖6所示,Quercetin與關鍵靶點蛋白有較好的結合活性,并且分子構象結合穩定。如表2所示,蛋白質與小分子結合越緊密,Full Fitness值越低。進一步證明了消風散可能是通過調節以上相關靶點發揮治療AC的作用。

表2 Quercetin與關鍵靶點的分子對接結果
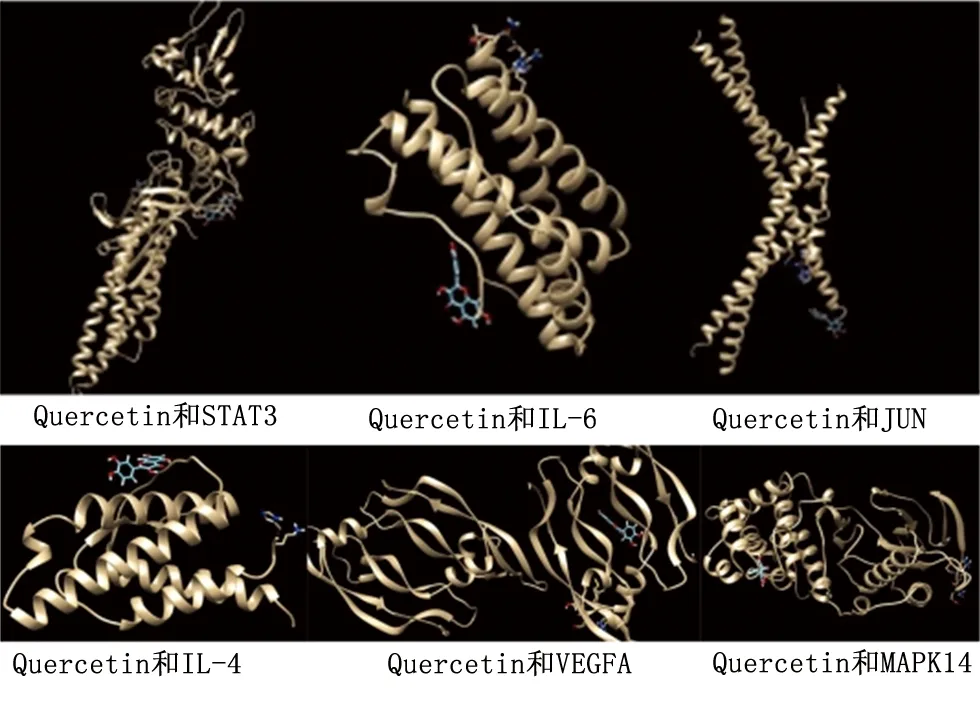
圖6 Quercetin與關鍵靶點分子對接圖
3 討論
AC是由于變應原引起了廣泛的抗原特異性輔助性T淋巴細胞(Th)反應使眼部結膜組織發生的變態反應。Th依據其生成的細胞因子分為Th1、Th2、Th17和調節性T淋巴細胞。Th1細胞產生IL-2、干擾素γ(IFN-γ)、TNF-α,Th2細胞產生IL-4、IL-5、IL-6、IL-10,抗原特異性Th2細胞產生IL-4、IL-5等細胞因子。細胞因子參與IgE的產生及嗜酸性粒細胞的激活,促進黏液的分泌,從而在AC的發病中起關鍵作用[9]。因此,抑制結膜對變應原反應的Th1-Th2反應轉化是治療AC的關鍵[10]。Th17細胞參與一系列炎性反應,其主要通過分泌的細胞因子IL-17來發揮作用[11]。Th17和調節性T淋巴細胞之間的平衡具有體外抗炎作用[12]。
中藥復方是中醫臨床用藥的主要手段,按照中藥配伍規律,以達到協同增效、扶正祛邪的目的。AC屬中醫學“目癢”“時復癥”“癢若蟲行癥”等范疇。《太平圣惠方·治目癢急諸方》曰: “夫目癢急者,是風氣客于瞼眥之間,與血氣津液相搏,使眥癢而淚出。”中醫學認為,AC因風邪侵襲,經絡受阻,或脾胃濕熱內蘊,外感風邪,風濕熱相搏,上壅于目所致[13]。常規治療以祛風除濕、健脾清肺或清利濕熱為主。消風散中荊芥、防風相須為用,以達腠理、發汗散邪之效,牛蒡子、蟬蛻疏風止癢,共為君藥;蒼術散風除濕,木通、苦參清熱燥濕,石膏、知母清熱瀉火,共為臣藥;佐以當歸、生地黃、黑芝麻養血活血;甘草清熱解毒,調和諸藥,為使藥。諸藥合用,共奏疏風養血、清熱除濕之功。
本研究結果顯示,消風散包含23個有效化合物,其中Degree值較高化合物主要包含黃酮類成分、色原酮類成分和植物甾醇類成分。Quercetin作為存在于荊芥和苦參中的黃酮醇類化合物,具有抗氧化、抗炎、抗病毒、抗癌、免疫調節等多種藥理學作用[14]。大量研究表明,Quercetin能增強視網膜色素上皮細胞中抗氧化酶的活性[15],減少炎癥相關因子IL-6、IL-8等的表達[16],抑制視網膜色素上皮細胞氧化應激損傷。相關研究表明,Quercetin可以調節炎性和免疫反應來減輕眼部的炎性反應,其作用機制可能是通過穩定肥大細胞、誘導Th1細胞增加IFN-γ表達、抑制Th2細胞分泌IL-4、阻斷IL-6分泌和傳導[17-18]。Wogonin是防風和蒼術中一種重要的黃酮類化合物,具有明顯的抗炎和抗氧化作用[19]。張海麗等[20]研究發現,Wogonin可能通過減少巨噬細胞活性氧的產生,降低核轉錄因子κB(NF-κB)調控炎癥相關因子(IL-1β、IL-18、IL-6和TNF-α)的基因轉錄,進一步抑制巨噬細胞的炎性反應。5-O-Methylvisamminol是防風中主要的色原酮類化合物,具有抗炎、退熱、鎮痛、鎮靜等作用[21]。Sun等[22]研究發現5-O-Methylvisamminol可通過NF-κB/IκB-α信號通路發揮抗炎作用,改善氧化應激,抑制脂多糖(LPS)刺激的BV-2小膠質細胞過度活化,改善LPS誘導的小鼠抑郁。β-sitosterol是防風、荊芥、當歸和牛蒡子中主要的植物甾醇類化合物,具有抗炎、抑制腫瘤、免疫調節、抗氧化、鎮痛、促進傷口愈合等廣泛的藥理活性[23]。Zhang F等[24]研究發現β-sitosterol可以促進核因子E2相關因子2(Nrf2)和血紅素氧合酶1(HO-1)的表達,抑制NF-κB、NF-κB受體活化因子配體(RANKL)和STAT3的表達,發揮抗關節炎作用。Luteolin是荊芥和苦參中的一種天然黃酮類化合物,具有抗氧化、抗炎、抗過敏、抗腫瘤、抗菌、抗病毒和神經保護等藥理作用[25]。張淑榮等[26]研究表明,Luteolin可通過抑制Toll樣受體4/髓樣分化因子88(TLR4/MyD88)信號通路相關蛋白及其下游炎癥因子(IL-1β、TNF-α、IL-12)表達,進而有效抑制角膜炎性反應,對煙曲霉菌性角膜炎大鼠具有治療作用。因此,消風散中主要活性成分Quercetin、Luteolin、Wogonin、β-sitostero、Stigmasterol和5-O-Methylvisamminol等在治療AC中發揮重要作用。
多種細胞因子都參與了AC的發病機制,如白細胞介素、IFN、趨化因子、TNF等[27]。本研究首先基于網絡藥理學數據庫初步篩選,消風散治療AC作用靶點49個,并依據PPI網絡分析篩選出6個關鍵靶點。PPI結果顯示抗AC的關鍵靶點為STAT3、IL-6、JUN、IL-4、VEGFA和MAPK14。結果顯示,消風散可能通過多靶點協同發揮治療AC的作用。STAT3信號通路是IL-6發揮促炎性反應和促腫瘤血管新生的主要通路[28]。Guo等[29]研究顯示,通過增強miR-19b可以抑制AC小鼠模型STAT3的表達,進而減輕眼表的炎性反應。IL-6是一種多效細胞因子,在調節免疫反應和炎性反應中發揮重要作用[30]。AC眼中IL-6表達升高,促進B細胞增殖分化和分泌抗體,正向調節IgE的生成與活性[31]。在疾病早期,肥大細胞分泌的IL-4和IL-13可激活結膜纖維母細胞,促使其分泌嗜酸性粒細胞趨化因子、胸腺和激活相關的趨化因子。c-Jun氨基末端激酶(JNK)在轉導細胞外信號和炎性反應等方面發揮重要的作用。MAPK14是MAPK家族中的重要成員之一,其表達異常可致免疫功能失調和炎性反應。活化的MAPK14激活p38MAPK通路,p38MAPKs在由促炎細胞因子或外界刺激所引發的細胞級聯反應中發揮重要作用[32]。
為了進一步說明靶蛋白在基因功能和信號通路中的作用,本研究進行了GO功能富集和KEGG通路富集分析。GO功能富集結果顯示,消風散治療AC涉及細胞因子活性、血紅素結合、生長因子活性、過氧化物酶活性、趨化因子活性和前列腺素內過氧化物合酶活性等多種物質;與細胞對脂多糖的反應、RNA聚合酶Ⅱ啟動子轉錄的正調節、免疫反應、內皮細胞凋亡過程的負調控、炎性反應、調節血壓、T淋巴細胞增殖的正調控和凋亡過程的負調控等生物過程相關;與細胞外間隙、質膜外側、細胞外基質和胞外外泌體等細胞組成相關。由KEGG通路富集分析可知,消風散治療AC主要通路有TNF信號通路、T淋巴細胞受體信號通路、HIF-1信號通路、類風濕關節炎和IBD通路等。活化的肥大細胞可以產生和分泌促炎癥介質TNF,在眼表免疫調節中起重要作用,加重了AC癥狀[33]。TNF-α可激活MAPK信號通路,MAPK信號通路在各種眼表疾病中起到介導炎癥和調控細胞凋亡的作用[33]。研究表明,T淋巴細胞所參與的免疫應答是機體整個免疫調節的核心,T淋巴細胞受體及其他相關的體液因子在T淋巴細胞活化與抗原識別中起重要作用[34]。HIF-1α的表達影響炎癥發生及消退,還影響免疫細胞的募集、遷移、吞噬和殺傷等功能[35]。炎癥部位的多種免疫細胞中HIF-1α表達升高,HIF-1α表達增高促進Th1和Th17的表達,最終誘導IFN-γ和IL-17的產生[36]。總之,消風散治療AC與上述通路密切相關,這表明消風散的有效成分可能通過作用于這些信號通路以達到治療AC目的。
分子對接結果表明,Quercetin與STAT3、IL-6、JUN、IL-4、VEGFA和MAPK14對接結合能分別為-2 924.87、-1 201.35、-3 094.74、-912.55、-2 432.12和-1 818.79 kcal/mol,這提示篩選得到的核心活性成分與靶點之間有較強的結合活性,同時也進一步證明網絡藥理學預測藥物成分與疾病靶點的可靠性,以此發揮治療AC的作用。
本研究采用網絡藥理學方法和分子對接相結合的方法,對消風散及AC的靶點進行預測,構建“化合物-靶點-信號通路”網絡及PPI分析,初步闡明了消風散治療AC的作用機制。總之,消風散治療AC的主要活性成分可能為Quercetin、Luteolin、Wogonin、β-sitosterol、Stigmasterol和5-O-Methylvisamminol等,這些活性成分通過作用于STAT3、IL-6、JUN、IL-4、VEGFA和MAPK14等靶點和TNF信號通路、T淋巴細胞受體信號通路、HIF-1信號通路等發揮對AC的干預作用。這也證實了消風散是通過多靶點、多方面發揮干預AC的作用,為后續分子生物學實驗和機制的進一步探討及臨床應用等提供了重要的理論依據。

