茵陳四苓顆粒聯合骨髓間充質干細胞移植對急性肝衰竭大鼠肝臟線粒體呼吸鏈復合物和ATP活性的影響研究*
胡玉潔,胡 喻,劉 鵬,將明玥,鄭 靖
(1.西南醫科大學中西醫結合學院,四川 瀘州 644300;2.西南醫科大學附屬中醫醫院,四川 瀘州 644300)
急性肝衰竭(acute Liver failure,ALF)是由各種原因引起的大量肝細胞迅速壞死、凋亡并伴有肝功能嚴重障礙危及生命的臨床綜合征,病死率高[1]。目前肝移植是ALF唯一根治的方法,但受到肝源稀缺、費用昂貴、術后排斥等諸多因素限制[2-3]。隨著現代生物技術的發展,骨髓間充質干細胞(BMSCs)移植成為治療急性肝衰竭的新興方式。研究表明[4-8],BMSCs可以抑制炎癥反應、減少肝細胞凋亡、改善線粒體呼吸功能、分化成為功能性肝細胞,同時還具備不違背社會倫理、制備簡便、容易獲取等優點,使其成為治療晚期肝病的研究熱點。
中醫尚無急性肝衰竭的準確病名,依據中醫藏象學說,肝臟可歸屬于中醫的脾藏[9],由于本病以黃疸為突出的癥狀,病重勢急,變化迅速,故又稱之為“瘟黃”、“疫黃”、“急黃”等,黃為脾之臟色,黃疸亦為脾之本病。本實驗以健脾利濕、清熱解毒作為指導思想,選用四川省名老中醫孫同郊教授經驗方茵陳四苓顆粒(原方名為肝毒清顆粒),為本院院內制劑,由茵陳、澤瀉、豬苓、白頭翁、大黃等多味中藥組成。根據本課題團隊前期研究表明[10-12],茵陳四苓顆粒能抑制全身炎癥反應、對抗內毒素血癥、保護線粒體、促進肝細胞再生。本實驗就茵陳四苓顆粒聯合BMSCs移植治療急性肝衰竭大鼠,探討是否能通過影響大鼠肝臟能量代謝及線粒體呼吸功能方面減輕急性肝衰竭,進一步研究中藥聯合干細胞移植治療急性肝衰竭大鼠的作用機制。以期為臨床提供更佳的治療手段。
1 材料
1.1 實驗動物 2~3周齡,體質量(120±20)g,10只健康SPF級SD雄性大鼠,用于干細胞制備。6~8周齡,體質量(200±20)g,60只健康SD雄性大鼠,用于動物實驗。由西南醫科大學實驗動物中心提供,動物生產許可證號:SCXK(川)2018-17,使用許可證號:SCXK(川)2018-065。
1.2 藥物與試劑
1.2.1 藥物 茵陳四苓顆粒(西南醫科大學附屬中醫醫院院內制劑,由醫院制劑室制備,川藥制劑Z20070525,許可證號:川2016039HZ。);復方甘草酸苷片(日本米諾發源制藥株式會社,國藥準字J20130077);硫代乙酰胺(Sigma 型號 163678-25G);戊巴比妥粉劑(上海榕柏)。試劑:總蛋白定量測定試劑盒(南京建成,型號 A045-4-2);ATP含量測定試劑盒(南京建成,型號A095-1-1);線粒體提取試劑盒(索萊寶,型號 SM0020);線粒體呼吸鏈復合體Ⅰ、Ⅱ活性檢測試劑盒(索萊寶,型號 BC0515、BC3230);線粒體呼吸鏈復合體Ⅰ活性檢測試劑盒(索萊寶,型號 BC3240)。L-DMEM培養基;胎牛血清(Hyclone公司);青鏈霉素溶液(碧云天);胰酶細胞消化液(碧云天);抗大鼠CD-25/45、99-PE單克隆抗體(Bioelend)。
1.2.2 儀器、耗材 超凈工作臺(蘇州凈化);電子恒溫水浴鍋(北京中興偉業儀器公司);37℃、5%CO2細胞培養箱(美國Thermo公司)、-80℃超低溫冰箱(美國Thermo公司);FLUKO超細勻漿器(弗魯克(上海)流體機械制造公司);酶標儀(美谷分子儀器公司);UV752N紫外可見分光光度計(上海佑科儀器儀表公司);透射電子顯微鏡(日本電子 JEOL生產)。
2 實驗方法
2.1 采用全骨髓貼壁法制備大鼠BMSCs 大鼠2%戊巴比妥(40 mg/kg)腹腔注射麻醉后予以脫頸處死;放入75%酒精浸泡5 min后轉移至超凈工作臺,用PBS緩沖液反復沖洗5 min后取出雙下肢,鈍性分離股骨、脛骨,剪去兩端骨骺,無菌條件下快速予以細胞培養基反復沖洗骨髓腔,輕柔吹打混勻,維持細胞濃度1.0×106個/mL接種至25 cm2培養瓶中,置于37℃、5%CO2細胞培養箱中培養,每隔48 h更換完全培養液,待細胞鋪滿瓶底達90%時,用0.25%胰酶細胞消化液消化細胞,分瓶傳代培養;傳至第三代時用流式細胞儀鑒定。
2.2 構建急性肝衰竭大鼠模型及評價造模成功的方法和指標
2.2.1 造模方法 隨機將60只SD健康雄性大鼠等分為6組,分別為正常組、聯合組、陽性對照組、模型組、中藥組、干細胞組。適應性喂養1周,保持充足飼料和飲水,室溫控制在22℃左右,記錄各組大鼠體重變化情況。于造模前12 h禁食不禁飲,除開正常組外各組均予以硫代乙酰胺(TAA)300 mg/kg腹腔注射造模,正常組予以等量生理鹽水腹腔注射干預,間隔24 h重復1次。造模期間提供葡萄糖氯化鈉補充熱量,觀察大鼠精神狀態、進食量、體重及大小便等情況。
2.2.2 評價造模成功的方法和指標
2.2.2.1 大鼠一般情況改變 模型組10只大鼠于造模后出現精神萎靡,活動量劇減,行為異常,進食量及飲水量顯著減少,體重下降,可見毛發粗糙晦暗,四肢皮膚青紫,皮下可見瘀癍、瘀點,大便稀溏,小便黃少,其中個別大鼠肛周出現異常出血,相繼出現死亡,最后僅存活4只。
2.2.2.2 正常組與模型組血清學結果比較 正常組大鼠肝功能指標是處于SD大鼠血液生化指標的正常參考范圍內,而模型組大鼠肝功能AST、ALT、TBIL在48 h內均明顯升高,符合急性肝功能衰竭的診斷標準。見表1。

表1 正常組與模型組造模48 h后肝功水平比較
2.2.2.3 正常組與模型組肝臟組織病理HE染色比較 對模型組肝組織進行HE染色,可見肝細胞分葉不明顯,肝索排列紊亂,中央靜脈內皮部分缺失,中央靜脈和門管區周圍肝細胞不同程度變性壞死,見壞死肝細胞崩解,結構模糊,壞死區伴有少量核圓形深染的淋巴細胞浸潤,膽管正常結構消失,符合肝衰竭肝損傷表現。見圖1。

A-正常組
2.3 給藥方法 造模成功后,參照《中藥藥理研究方法學》計算中藥組及聯合組予以茵陳四苓顆粒灌胃(1.5 g/kg,2次/d),陽性對照組予以復方甘草酸苷片溶液灌胃(7.5 mg/kg,2次/d),其余組灌胃等量生理鹽水;干細胞組及聯合組尾靜脈注射BMSCs懸液(1.0×106個/mL),其余各組尾靜脈注等體積細胞培養液。
2.4 標本取材和處理 干預72h后,大鼠腹腔注射2%戊巴比妥麻醉后開腹,經腹主動脈采血后脫頸處死,立即取出肝組織分別用3%戊二醛和4%多聚甲醛固定,部分肝組織-80℃低溫保存,用于測定線粒體呼吸鏈復合體I、II、III酶活性和ATP酶含量。
2.5 指標檢測
2.5.1 生化檢測 大鼠經腹主動脈采血后靜置離心收集血清,采用全自動生化分析儀測定肝功AST、ALT、TBIL。
2.5.2 Westerb-blot法測定大鼠肝臟中Bcl-2、Caspase-3蛋白表達水平 根據試劑盒說明書提取大鼠肝臟總蛋白,經上樣、電泳、轉膜、封閉后,加入一抗兔抗大鼠Bcl-2抗體、Caspase-3抗體(濃度:1∶2000),再將PVDF膜二抗孵育(稀釋濃度:1∶5000),將放有膜的曝光板放入化學發光凝膠成像儀的暗室中,根據信號的強弱適當調整曝光時間,用天能GIS機箱控制軟件V2.0對條帶進行曝光掃描,結果以目的蛋白相對表達量表示。
2.5.3 磷鉬酸比色法測定肝臟線粒體ATP含量 參考ATP含量測定試劑盒說明書及測定原理,對肝組織樣本處理后,制備底物液、顯色應用液,采用磷鉬酸比色法進行檢測,依據組織、細胞中ATP含量計算公式:ATP濃度(umol/gropt)=(測定OD值-對照OD值)/(標準OD值-空白OD值)×標準品濃度(1×103umol/L)×樣本測定前稀釋倍數/血紅蛋白濃度(gHb/L),計算ATP含量。
2.5.4 紫外分光光度計測定呼吸鏈復合體I、II、III活性 按照線粒體提取試劑盒說明書進行操作,將肝組織置于4℃冰上勻漿,勻漿液離心取上清液(即為包漿提取物),采取紫外分光光度計進行測定用于測定呼吸鏈復合體I、II、III酶活性。以微量石英比色皿計算復合體I酶活性,按樣本蛋白濃度計算復合體II、III活力。
2.5.5 肝臟組織病理檢測 將固定于10%中性甲醛固定液中的肝組織標本取出,進行脫水、修剪、包埋、切片、染色、封片等操作后于顯微鏡下觀察肝臟病理結構變化。
2.5.6 透射電鏡觀察肝細胞超微結構 肝組織于3%戊二醛固定后置于1%四氧化鋨再固定,使用丙酮逐級脫水,脫水完畢后進行滲透與包埋已備下一步超薄切片(約50 mm厚),用雙色染色法染色15~20 min后進行圖像采集,觀察肝細胞及肝線粒體等病理結構變化。
2.6 統計學方法 選擇GraphPad Prism8.0統計軟件分析實驗數據及作圖,多組間比較使用單因素ANOVA進行比較分析,差異顯著(P<0.05)具有統計學意義。
3 結果
3.1 BMSCs培養及鑒定結果 將大鼠BMSCs接種至培養瓶48 h后換液大部分細胞貼壁,顯微鏡觀察可見細胞呈圓形,呈“滿天星”分布,折光性強(見圖2-A原代細胞)。細胞快速增長,呈長梭形、紡錘狀、漩渦狀均勻排列,逐漸融合成片(見圖2-B第二代、圖2-C為第三代)。經流式細胞儀檢測BMSCs表面標志物CD29表達率為99.90%,CD90表達率為99.56%,呈強陽性,CD45表達率為0.51%,CD34表達率為0.20%,呈陰性,見圖3。

A-原代細胞

圖3 大鼠骨髓間充質干細胞流式細胞儀鑒定結果
3.2 各組大鼠血清AST、ALT、TBIL水平比較 與模型組相比,干預組大鼠肝功水平(AST、ALT、TBIL)均明顯下降,差異具有統計學意義(P<0.05);與正常組相比肝功水平仍高(P<0.05)。各干預組相比,聯合組肝功(AST、ALT、TBIL)水平最低,差異具有統計學意義(P<0.05)。見圖4。

圖4 各組大鼠血清AST、ALT及TBIL水平比較
3.3 各組大鼠肝臟組織病理觀察 正常組肝索排列較為整齊,肝小葉結構完整,未見肝細胞變性壞死、炎性細胞浸潤及纖維增生。與正常組相比,模型組肝索排列相對紊亂,可見中央靜脈或門管區周圍肝細胞明顯變性壞死、膽管壞死,同時壞死區伴有大量淋巴細胞浸潤,基本符合肝衰模型的病變特征;各干預組與模型組比較,各組肝索排列相對整齊,肝細胞壞死程度減輕,炎性細胞浸潤減少,見圖5。

正常組
3.4 透射電鏡觀察肝細胞超微結構結果 正常組肝細胞體積大,呈多角形或多面體,形態結構正常;細胞核完整,體形大而圓,位于中央,胞漿豐富且線粒體、內質網、核糖體等細胞器,各細胞器結構清晰,僅在胞漿內見少量的脂滴。模型組電鏡下可見肝細胞胞漿中較多數線粒體已發生腫脹,嵴斷裂、溶解甚至消失,細胞核皺縮,染色質聚集,胞漿電子密度增高,可見大量凋亡的肝細胞,疑似為凋亡現象。其余各組以聯合組肝細胞胞漿中線粒體病變程度最小、范圍較小,較少數肝細胞發生凋亡,見圖6。

正常組
3.5 各組大鼠肝臟ATP濃度結果 據表2、表3統計結果顯示,與模型組相比,正常組大鼠肝臟勻漿中和線粒體提取液中ATP濃度均明顯升高(P<0.01);聯合組大鼠肝臟勻漿中和線粒體提取液中ATP濃度均升高(P<0.05)。
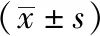
表2 各組大鼠肝臟勻漿中ATP濃度變化
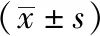
表3 各組大鼠線粒體提取液中ATP濃度的變化
與聯合組相比,陽性對照組大鼠肝臟線粒體提取液中ATP濃度降低(P<0.05)。余組間大鼠肝臟線粒體ATP濃度差異無統計學意義(P>0.05)。
3.6 各組大鼠線粒體提取液中復合體I、II、III活力變化 由表4可見,與模型組相比,正常組大鼠肝臟線粒體提取液中復合體Ⅰ、II、III活力明顯升高,差異極顯著(P<0.01);聯合組大鼠肝臟線粒體提取液中復合體Ⅰ、III活力升高,差異顯著(P<0.05);其余各干預組大鼠肝臟線粒體提取液中復合體Ⅰ、II、III活力差異無統計學意義(P>0.05)。

表4 各組大鼠線粒體提取液中復合體Ⅰ、Ⅱ、Ⅲ活力的變化
與聯合組相比,干細胞組大鼠肝臟線粒體提取液中復合體Ⅱ活力降低,差異顯著(P<0.05);陽性對照組大鼠肝臟線粒體提取液中復合體Ⅲ活力降低,差異顯著(P<0.05)。其余組間比較差異無統計學意義(P>0.05)。
3.7 肝組織Bcl-2、Caspase-3的蛋白表達 與正常組相比,模型組大鼠肝臟中Bcl-2、Caspase-3蛋白表達顯著升高,具有極其顯著的統計學意義(P<0.01);與模型組相比,各干預組Bcl-2蛋白表達顯著升高,具有極其顯著的統計學意義(P<0.01),聯合組Caspase-3蛋白表達顯著降低,具有極其顯著的統計學意義(P<0.01);與聯合組相比,各干預組大鼠肝臟中Bcl-2蛋白表達顯著降低,具有極其顯著的統計學意義(P<0.01)。分別見圖7、表5。

圖7 Western blot檢測蛋白表達
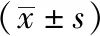
表5 各組大鼠肝臟中Bcl-2、Caspase-3的蛋白表達
4 討論
急性肝衰竭是由多種原因引起的致死性疾病,臨床上表現為肝臟大面積的變性和壞死,肝功能的急劇下降甚至完全喪失,以及由之引起的多器官功能的障礙。至今本病發病機制尚未研究明確,據研究表明[13-14]大量肝細胞凋亡為其主要發病機制之一,線粒體作為細胞能量代謝中心,在肝細胞凋亡過程中伴隨著線粒體大小、形態、數量、結構異常改變,線粒體在肝細胞凋亡中起到至關重要的作用[15-16],并在肝臟疾病中發揮著舉足輕重的影響。ALF的治療一直是臨床亟待解決的難題,因此肝衰竭治療可以從改善線粒體結構、提高能量代謝、保護線粒體電子呼吸鏈功能方面探索。近年來干細胞移植成為治療ALF研究熱點,其中骨髓間充質干細胞(BMSCs)是來源于骨髓的中胚層非造血多能干細胞,具有抑制炎癥反應、細胞凋亡、促進肝細胞再生、改善線粒體功能、提高生存率等作用[17]。鑒于以上諸多優點,吸引廣大研究者選擇骨髓間充質干細胞移植替代肝臟移植治療肝衰竭。
急性肝衰竭大致可歸屬于中醫領域中“急黃”、“瘟黃”等病范疇,此類患者臨床常不同程度伴有腹脹、厭油納差、乏力等脾氣虛、濕邪困脾的表現。故本實驗提出從“脾”論治急性肝衰竭。中醫脾與線粒體的功能特征有許多相同之處[18]。1991年首次提出“中醫脾-線粒體”假說,其氧化磷酸化產能過程與脾主運化功能相吻合,脾(線粒體)的強弱決定正氣的盛衰及機體是否發病。本實驗采用“健脾利濕”聯合“清熱解毒”法治療急性肝衰竭,選用由四川省名中醫孫同郊教授經驗方擬定——茵陳四苓顆粒(原肝毒清顆粒),是本院自主開發的院內制劑,主要由茵陳、白術、茯苓、豬苓、澤瀉、大黃、梔子等藥物組成。茵陳乃“退黃要藥”、白術為“補氣健脾第一藥”、茯苓“健脾祛濕第一藥”、豬苓“健脾利水”、澤瀉“健脾滲濕”,諸藥共奏清熱解毒、健脾利濕之功。據現代藥理學研究表明[19-22],茵陳具有保肝、抗炎、抑制線粒體凋亡的作用,白術、豬苓能減輕肝細胞損傷、促進肝細胞再生,大黃具備促進線粒體通透性轉換孔開放的功效,其中白術、大黃、澤瀉均能改善線粒體結構功能、增強線粒體能量代謝。因此茵陳四苓顆粒有藥理學基礎證明具有保肝、改善線粒體結構功能的功效。根據本課題組前期研究發現[23],茵陳四苓顆粒聯合骨髓間充質干細胞移植能減輕急性肝衰竭大鼠肝臟炎癥活動指數、抑制肝臟細胞凋亡、抑制線粒體凋亡。
研究表明[14],線粒體功能障礙與肝衰竭發病密切相關。線粒體作為機體“能量工廠”,是細胞能量合成、儲藏、交換以及細胞進行氧化呼吸的場所。線粒體將有機物氧化產生的能量轉化為三磷酸腺苷(Adenosine Triphosphate,ATP),這個過程稱之為氧化磷酸化。ATP廣泛存在于細胞中,能直接反映機體能量代謝狀態。電子傳遞鏈的作用代表線粒體最基本的功能,由于其功能與呼吸作用直接相關,亦稱之為呼吸鏈。呼吸鏈由4種復合物、細胞色素C和輔酶Q構成。4種復合物(Complex)按照電子傳遞先后順序,分為復合物I、II、III、IV,分別又名為NADH脫氫酶(NADH dehydrogenase)、琥珀酸脫氫酶(succinate dehydrogenase)、CoQH2-細胞色素C還原酶復合物、細胞色素C氧化酶(cytochrome c Oxidase)。呼吸鏈分為主呼吸鏈和次呼吸鏈,其中主呼吸鏈是由NADH開始的呼吸鏈,由復合體I、III、IV組成;次呼吸鏈是由FADH2開始,包含復合體II、III、IV,本條電子傳遞不經過復合體I。在正常生理電子傳遞過程中,復合物酶的活性變化能較為直觀地反映線粒體呼吸功能。本實驗采用腹腔注射硫代乙酰胺構造急性肝衰竭大鼠模型,模型組大鼠肝線粒體復合物I、II、III酶的活性與正常組相比均明顯下降,使呼吸鏈電子傳遞受阻,ATP生成減少。肝線粒體酶復合物活性下降導致線粒體能量代謝障礙,這可能是急性肝衰竭的發病機制之一。聯合組與干預組相比,復合體Ⅰ、III活力升高,復合物Ⅰ是機體內部能量物質轉化合成ATP 的橋梁[24]。線粒體ATP含量均顯著增多,說明茵陳四苓顆粒聯合骨髓間充質干細胞能通過改善線粒體呼吸功能、提高ATP含量、增強能量代謝,從而達到治療急性肝衰竭的作用。
總之,本實驗采用“健脾補脾”聯合“清熱解毒”的治法,將茵陳四苓顆粒聯合骨髓間充質干細胞治療急性肝衰竭大鼠,實驗結果證明聯合組能顯著提高大鼠肝臟線粒體呼吸鏈復合物活力、增強ATP活性、改善能量代謝,證實“從脾論治”對線粒體的功能恢復具有明顯的作用,最終達到改善急性肝衰竭大鼠病情的目的。但本實驗存在移植干細胞頻數較少、途徑單一、數量有限,進一步實驗可設置不同的移植頻數、劑量、途徑,從而進一步優化干細胞移植治療急性肝衰竭效果,以選取最佳劑量、把握最佳移植時機,為中藥聯合干細胞治療急性肝衰竭提供新的診治思路。

