水的pH值盲樣檢測方法及影響因素淺析
岳 曼,柳玉連,程 潤,甘鑫鈺
(中山公用水務投資有限公司,廣東 中山 528403)
pH值定義是水相溶液中氫離子活度的負對數值,pH值可以通過比色法、指示劑滴定法和電極法來測定,前者測量精度不高,滴定法較繁瑣,準確定量時一般用電極法測定。目前市場上購買的多為復合電極,進一步簡化實驗流程,減少實驗結果影響因素,水的顏色、濁度、膠體物質、氧化劑及還原劑均不干擾測定。pH作為水質評價的重要指標,其檢測的準確性是水質檢測化驗室考核的重要內容,但pH測定無法應用留樣復測、加標回收等質控手段,而對pH計準確度的依賴性強,整個檢測過程看似簡單,實則需注重的細節較多。例如pH計的校準方法、樣品的測定方式和時間等均會對檢測結果產生影響,本文根據復合電極pH值測定結果的影響因素來分別進行驗證。
1 實驗器材及試劑
PHS-3C pH計(無自動溫度補償功能),雷磁;E-201-C型電極(新、舊各一支,舊電極使用時間為6個月),雷磁;溫度計;Direct-Pure UP超純水機,樂楓;JB-2磁力攪拌器,雷磁。
實驗用水:市場購買屈臣氏純凈水;實驗室超純水機制超純水。
標準緩沖溶液Ⅰ:pH=4.00(25 ℃):取鄰苯二甲酸氫鉀(雷磁袋裝pH緩沖劑),將袋中試劑全部倒入燒杯中,并用實驗用水潤洗試劑袋2~3次并將液體一并倒入容量瓶定容至 250 mL;標準緩沖溶液Ⅱ:pH=6.86(25 ℃):取混合磷酸鹽(雷磁袋裝pH緩沖劑),按照標準緩沖溶液Ⅰ的配制方法完全溶于實驗用水并定容至250 mL;標準緩沖溶液Ⅲ:pH=9.18(25 ℃):取硼砂(雷磁袋裝pH緩沖劑),按照標準緩沖溶液Ⅰ的配制方法完全溶于實驗用水并定容至250 mL,在聚乙烯瓶中密封保存。
質控樣:生態環境部標準樣品研究所GSB 07-3159-2014,QC1:批次202191,稀釋10倍后濃度為4.11±0.06;QC2:批次202193,稀釋10倍后濃度為9.06±0.08。
盲樣:根據作業指導書用實驗用水稀釋10倍后得到S1,S2。
2 實驗步驟和結果
2.1 實驗用水的選擇
一般pH測定緩沖溶液需要用無CO2的純水,但超純水的生產及煮沸冷卻等過程均難以避免會有CO2溶于水中,從而改變水的pH值,有文章說明25 ℃時,電導率小于2 μs/cm的水即可用于實驗[1],本文用新制備的超純水煮沸10 min后加蓋冷卻,臨用現配,新制備的超純水,購買的屈臣氏純凈水作對比,探討不同的實驗室用水對實驗結果的影響,從而選擇一種或多種可以用于pH檢測的實驗用水。具體操作方法為:分別配制標準緩沖溶液Ⅰ和標準緩沖溶液Ⅱ,用配制的緩沖溶液校準pH計后,再分別測定用Ⅰ、Ⅱ和配制的緩沖溶液的值。三種純水的電導率結果見表1。

表1 三種純水電導率
校準流程為將幾種校準溶液至于同一個環境下,使溫度均接近室溫后,用溫度計測量并記錄溶液的溫度,將酸度計的溫度補償旋鈕調至該溫度上,將電極上端的硅膠軟塞拔出,使電極內外的氣壓平衡[2],待內部氣泡消失后,將電極前端玻璃球完全浸入標準緩沖溶液Ⅱ,緩慢水平攪拌,防止產生氣泡引入二氧化碳,讀數穩定后調節pH顯示值與標準緩沖溶液一致;蒸餾水沖洗電極并用濾紙邊緣吸去電極表面水分,用吸管吸取待測溶液潤洗玻璃電極,再用相同方法校準儀器pH顯示值至標準緩沖溶液的濃度Ⅰ;再分別測定標準緩沖溶液Ⅰ和Ⅱ的值,儀器示值與標準緩沖溶液的差值應≤0.05個pH單位[3],否則需要重復校準,直至合格。堿性校準和上述方法一致,對應的校準溶液為標準緩沖溶液Ⅱ和Ⅲ。校準后回測各緩沖溶液的結果見表2。
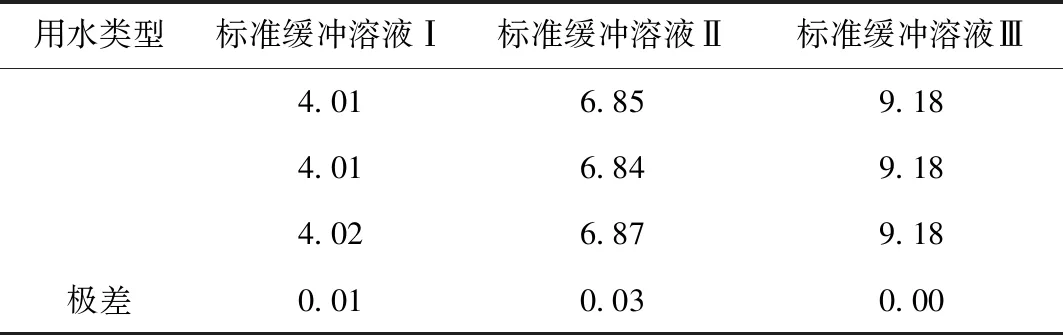
表2 不同實驗室用水對pH值的影響
從表2的結果中可以看出,三種水配制的緩沖溶液測定值與實際值相差均小于0.05,說明本實驗室超純水機現制超純水和屈臣氏純凈水均可以直接用來測定pH值用。
2.2 pH計的校準
2.2.1 校準點的影響
(1)HJ 1147-2020《水質 pH值的測定 電極法》規定兩種標準緩沖溶液pH值相差約3個pH單位,樣品pH值盡量在兩種標準緩沖溶液pH值范圍之間,且越接近被測pH值越好;若超出范圍,樣品pH值至少與其中一個標準緩沖溶液pH值之差不超過2個pH單位。但PHS-3C說明書中規定的二點標定法選取的標準緩沖溶液示例為:4.00pH和9.18pH[4],無中性點,且兩個pH值相差遠大于3,為驗證校準點的選擇對檢測結果的影響,本實驗用標準緩沖溶液Ⅰ和標準緩沖溶液Ⅲ反復校準pH計,然后回測標準緩沖溶液Ⅱ,以及QC1和QC2,測定結果見表3。

表3 兩點校準檢測結果
從表3結果可看出,用標準緩沖溶液Ⅰ和標準緩沖溶液Ⅲ校準pH計,與三點校準結果類似,滿足測定標準緩沖溶液范圍內的樣品的要求。
(2)舊電極對校準的影響:為還原日常實際檢測情況,本實驗換回使用半年的舊電極重復2.3.1(1)中的實驗[5],結果見表4。

表4 舊電極兩點校準檢測結果
從表4結果可看出用標準緩沖溶液Ⅰ和Ⅲ校準儀器后,測定標準緩沖溶液Ⅱ,結果超出誤差允許范圍,但QC1和QC2的測定值均在不確定度允許范圍內,本實驗認為QC1和QC2分別在標準緩沖溶液Ⅰ和Ⅲ的值附近,此次校準可看做是單點校正,而在4.00 pH、6.86 pH、9.18 pH范圍內的線性并非一條直線,對于舊電極來說,若只校準4.00 pH和9.18 pH,最終會影響實驗結果的準確性,因此說明書中只用標準緩沖溶液Ⅰ和Ⅲ校準pH計的方法不可行,各實驗室需根據自身儀器的實際情況進行選擇。
2.2.2 校準頻次的影響
電極在測量前必須用已知pH值的標準緩沖溶液進行校準,關于校準頻率說法不一,每天要校準一次或48小時校準一次,或每三個月校準一次[6],驗證實驗如下:用同一臺pH計,分別用新、舊電極校準,校準pH計后關機,24 h后開機分別測定三個標準緩沖溶液,結果見表5。
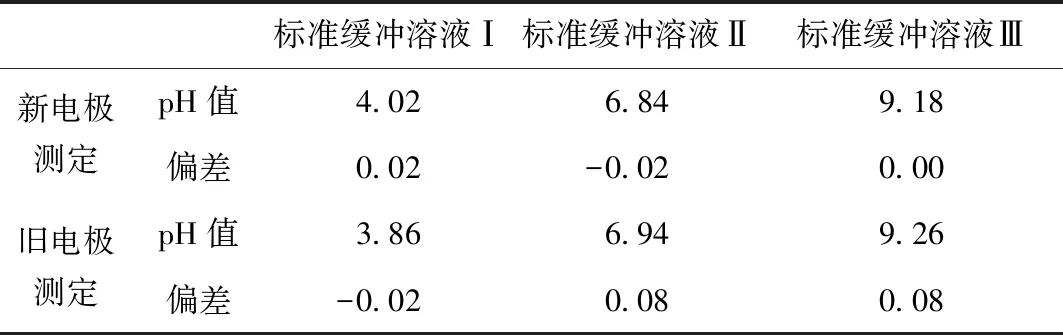
表5 新、舊電極校準24 h后測定標準緩沖溶液的結果
由表5結果可看出,新電極校準24小時后開機測定幾個標準緩沖溶液的值都在誤差允許范圍內,舊電極的測定值則全部超出誤差允許范圍,由此可見pH計的校準周期與電極狀態有關,實驗室需根據自身情況選擇。
2.2.3 溫度的影響
校準溶液溫度為22 ℃[1,7],模仿日常檢測可能樣品溫度與校正溶液不一致的情況,將幾個不同的樣品放于冰箱冷藏后,在其恢復至室溫的過程中進行測定,結果見表6,可看出當樣品低于標準緩沖溶液溫度≤4 ℃時,檢測結果均在誤差允許范圍內,但不同pH值的樣品受溫度影響不同,對于實驗室檢測時仍然建議待測樣品和標準緩沖溶液溫度接近時再檢測。
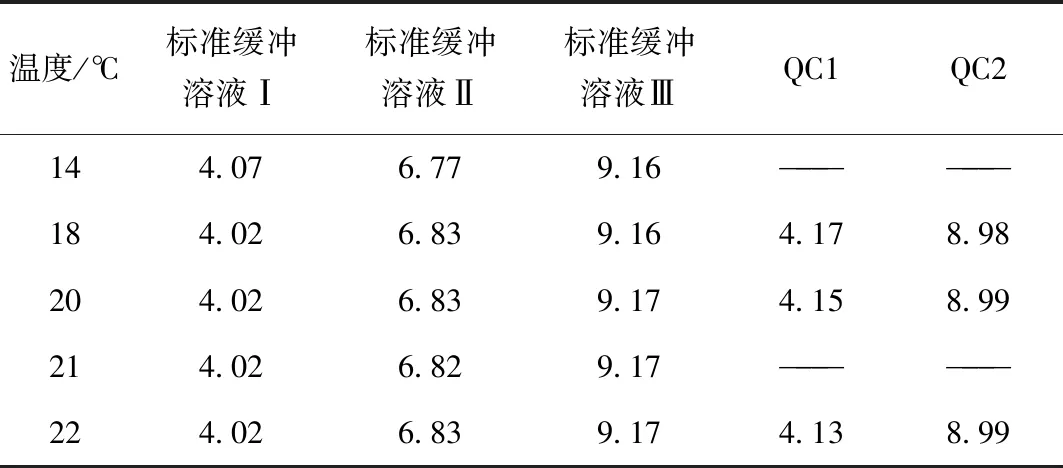
表6 溫度對檢測結果的影響
2.2.4 攪拌方式的影響
實驗過程中若引入氣泡可能會使空氣中的CO2溶于樣品中使pH測定值偏小,本實驗分別用手動輕輕攪拌和攪拌子攪拌的方式測定2.1中的三種緩沖溶液pH值的方法來驗證操作方式對實驗結果的影響,攪拌子轉速調為中間速度,檢測結果見表7。
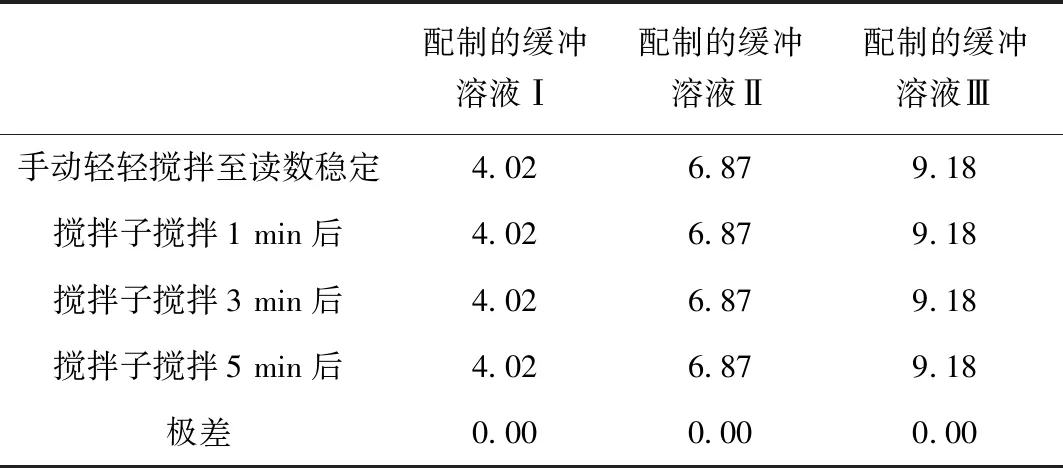
表7 不同攪拌方式對實驗結果的影響
由表7結果可看出,正常測定時間內攪拌子攪拌時長和手動攪拌對檢測結果的影響無異。
2.3 實際盲樣考核驗證
用pH試紙粗測S1和S2的pH范圍,分別在4~5和7~8之間,因此本實驗選用標準緩沖溶液Ⅱ和Ⅰ校準后測樣品S1,標準緩沖溶液Ⅱ和Ⅲ校準后測樣品S2。
2.3.1 S1的測定
用標準緩沖溶液Ⅰ和Ⅱ校準pH計后,將電極浸入稀釋后的QC1中,緩慢水平攪拌,待讀數穩定在1分鐘變化小于0.05個pH單位即讀數,結果在不確定度范圍內,即認為pH計在此值附近的測量較準確;用純水清洗電極并用濾紙擦干后用S1潤洗并測定,穩定后讀數;
2.3.2 S2的測定
用標準緩沖溶液Ⅱ和Ⅲ校準pH計,用2.4.1(1)同樣的方法測定QC2和S2,讀數見表8。
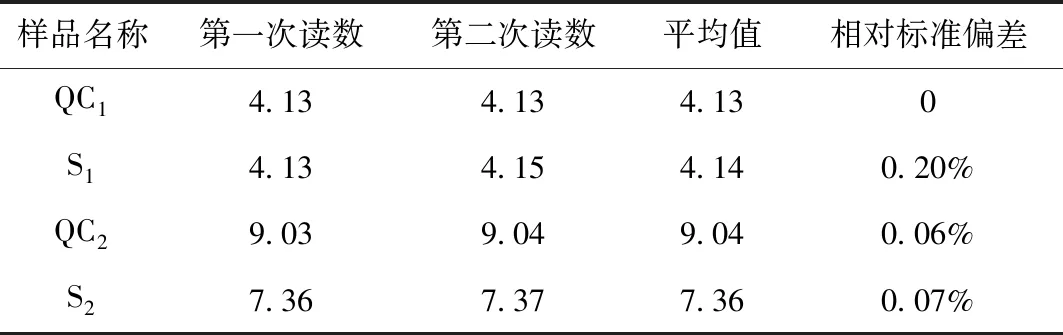
表8 pH校準后測定樣品的結果
由表8結果可看出,兩個質控樣的結果均在不確定度范圍內,且各樣品的相對偏差均<1%,說明儀器的精度和準確度均滿足實驗要求,最終盲樣考核得到滿意的結果。
3 結 論
(1)與超純水煮沸10 min后加蓋冷卻,且現用現配對比,本實驗室自制超純水和市場購買屈臣氏純凈水也可用來直接測定pH值用;
(2)隨著電極使用時間的增長,電極的響應時間等的變化,pH計的校準周期也需隨之縮短,實驗室要根據自身實驗情況確定儀器的校準周期;
(3)標準方法和儀器說明書中關于校準點的選擇規定有不同,新電極可以選擇用標準緩沖溶液Ⅰ和Ⅲ來校準儀器,舊電極則需要縮短各緩沖溶液之間的pH差值,且越接近待測樣品最好;
(4)溫度對pH值的測定結果有影響,最好將樣品放于室溫與標準緩沖溶液校準溫度一致時檢測;
(5)檢測過程中選擇用磁力攪拌器攪拌樣品不會因引入CO2對實驗結果造成影響。

