基于學習進階理論的高三化學復習課研究*
——以鎂與氯化銨溶液反應為例
倪文峰 戈益超
(1.黃山第一中學 安徽黃山 245700)(2.中國科學技術大學附屬中學 安徽合肥 230051)
一、問題提出
目前高三化學復習課多以重復講解知識點、做習題、講解習題為主,課堂教學中的演示實驗、學生實驗、探究實驗幾乎停止。筆者認為高三復習課不應該是高一、高二化學知識內容的重復講解,更不應該以機械的重復訓練為主,而是應該以高一、高二化學知識為基礎,以提升學生發現問題、提出問題、分析問題、解決問題為主,而將數字化實驗引進課堂,可以更好地提高學生的學習興趣和實驗能力。鎂與氯化銨溶液反應一直是大家探究的熱點,筆者將此實驗引入課堂,課前在實驗室完成探究過程,為探究過程中可能出現的問題做好預案,避免探究結果不理想,影響課堂教學效果。
二、實驗探究
(一)鎂與氯化銨溶液反應的再現
1.取10.0 mL0.1 mol/L NHCl于大試管內;
2.將pH傳感器放入大試管中,再將pH傳感器與數據采集器相連,數據采集器再與計算機相連,打開Logger Pro 3(軟件);
3.取10 cm長的鎂條,打磨除去其表面的氧化鎂,并分成4段;先點擊軟件中的“采集”,再將這4段鎂條同時放入大試管,計算機自動記錄數據。
(二)實驗數據及處理
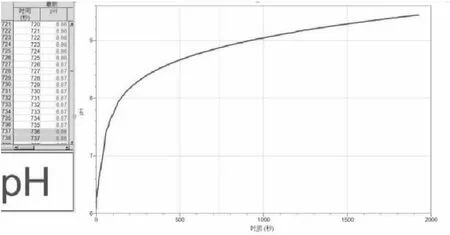
圖1 鎂與氯化銨溶液反應過程中pH變化圖
(三)實驗現象及解釋
1.將鎂條放入0.1 mol/L NHCl溶液中,在反應結束前一直有大量氣泡產生。
2.將濕潤的石蕊試紙放在試管口,試紙變藍。
3.從圖像中可以看出pH的值一直在增大,溶液從酸性變為堿性,在pH為9.4左右保持相對穩定。

問題1 在堿性條件下鎂條能否與水反應生成氫氣?
鎂條在pH為 9.4左右的氯化銨與銨水的緩沖溶液中反應速率沒有減弱,此條件下鎂條能否被氫離子氧化,帶著疑問筆者做了下面兩個實驗。
實驗1 將打磨后的鎂條放入pH為 9.4的碳酸鈉與碳酸氫鈉的緩沖溶液中有明顯的氣泡產生,向該緩沖溶液中加入氯化鈉,有大量氣泡產生。
實驗2 將打磨后的鎂條放入冷水中,剛開始無明顯現象,一段時間后有極少量氣泡,但放入氯化鈉的溶液中有明顯大量氣泡。
結論:鎂條與pH為 9.4的碳酸鈉與碳酸氫鈉的緩沖溶液反應,說明在堿性條件下,氫離子也可以氧化鎂生成氫氣,加入氯化鈉氣泡加速且在冷水中加入氯化鈉也能產生大量氣泡,說明氯離子能加速該反應,堿性環境下氫離子也能氧化鎂。
問題2 鎂條能否直接與銨根離子反應生成氫氣?
多數老師利用醋酸銨溶液與鎂條反應,有大量氣泡來說明鎂可以與銨根離子反應,但筆者認為鎂與醋酸銨溶液反應并不能說明銨根離子直接與鎂反應,還存在一種可能是鎂與水反應生成氫氧化鎂和氫氣,生成的氫氧化鎂附著在鎂條的表面從而阻止了反應的進行,但加入醋酸銨后,氫氧化鎂與銨根離子反應(氫氧化鎂是中強堿,而銨水是弱堿)溶解了氫氧化鎂,所以鎂與醋酸銨溶液的反應不能說明銨根離子直接與鎂反應。筆者利用如下實驗來驗證銨根可以直接與鎂反應。
實驗3 先將氯化銨溶解在乙醇中,再將打磨后的鎂條分別放在乙醇、含氯化銨的乙醇溶液、含氯化鈉的乙醇溶液中做對比實驗,鎂在乙醇、含氯化鈉的乙醇溶液中均無明顯現象,但鎂在含氯化銨的乙醇溶液中有明顯的氣泡產生。
三、將實驗探究轉化為教學過程
(一)基于課程標準設定教學目標
1.通過探究鎂與氯化銨溶液反應,提升綜合運用鹽的水解、弱電解質電離、鎂的性質等知識解決實際問題的能力。
2.讓學生真實經歷探究未知知識的過程,經歷科學家研究問題的過程,從而提高學生發現問題、提出問題、分析問題、解決問題的能力。
3.提高學生設計實驗和實驗探究能力,建構宏觀—微觀—符號—曲線四重表征。
(二) 教學過程呈現
1.定性分析
教師:氯化銨溶液是酸性、堿性還是中性?為什么?
學生:氯化銨溶液呈酸性,因為氯離子不水解,而銨根離子水解(銨根離子結合水電離出來的氫氧根離子生成NH·HO,從而使氫離子濃度大于氫氧根離子濃度,使溶液呈酸性)。
教師:鎂常溫下很難與冷水反應,氯化銨溶液呈酸性,鎂與氯化銨溶液反應嗎?
學生:若溶液很稀則不反應,若溶液濃度大,酸性較強則反應生成氫氣。
教師:我們以0.1 mol/L的氯化銨溶液為例,用pH傳感器測溶液的pH=6.12,溶液呈弱酸性,它能與鎂條反應嗎?為什么?
學生:不可以,因為酸性太弱。
學生:可以,因為溶液是酸性pH=6.12,熱水的pH值也接近6,所以可以反應,但反應速率不會太快。
教師:回答可以的同學,不僅說出原因,而且與熱水的pH做對比來證明自己的觀點,說明思路開闊,值得表揚和學習。能不能反應,我們來實驗一下。
演示實驗:先將大約10 cm長、用砂紙打磨好的鎂條分成四段同時放入試管中,再取大約10.0 mL 0.1 mol/L的氯化銨溶液于試管中,請學生觀察現象。
學生:有大量氣泡產生,說明可以反應,且反應速率較快。
教師:對這個實驗結果滿意嗎?對此大家還有什么疑問嗎?
學生:反應可以理解,畢竟溶液呈酸性。我想知道反應后溶液的pH是多少。
教師:請同學們再來預測一下反應后溶液的酸堿性。
學生:溶液pH逐漸增大,接近7,反應變慢。
教師:為什么?
學生:因為鎂與pH=7的水不反應,所以當溶液的pH接近7時反應變慢。
教師:鎂與0.1 mol/L的氯化銨溶液反應過程中pH值的變化是怎樣的,我們用pH傳感器來測一下實驗中pH的變化。
2.曲線圖分析
實驗:將pH傳感器與數據采集器相連,數據采集器再與計算機相連,打開Logger Pro 3(軟件)。將用砂紙打磨好的鎂條(15 cm)分成四段同時放入小燒杯中,再取25 mL 0.1 mol/L的氯化銨溶液倒入小燒杯中, 采集數據如圖1所示。
教師:同學們對此實驗現象及其結果有疑問嗎?
學生1:為什么剛開始pH變化較大,后來變化較慢?
學生2:鎂條與pH=7的水都難反應,為什么溶液pH大于7,反應還沒有停止?難道鎂條在堿性條件下也能與水反應?
學生3:pH在9到10之間時,仍有大量氣泡冒出,這是為什么?
學生4:溶液呈堿性,溶液中有銨根離子,是否有氨氣逸出?
學生5:生成的氣體是不是氫氣?
……
教師:我們先來解決第4及第5個問題,用實驗方法就可以,怎么做呢?
學生:把濕潤的石蕊試紙放在燒杯口,觀察其是否變藍;收集一試管氣體,點燃,看是否有爆鳴聲。
實驗:用濕潤的石蕊試紙放在燒杯口,試紙變藍,說明有氨氣生成逸出;收集一試管氣體,點燃,有爆鳴聲,說明是氫氣。
教師:請同學們思考第一個問題,為什么剛開始pH變化較大,后來變化較慢?
學生:銨根離子水解呈酸性,剛開始溶液氫離子濃度大,加入鎂,消耗氫離子,使平衡右移,但根據“勒夏特列原理”,只能減弱不能抵消,所以溶液pH增大;后來溶液pH變化較慢,那是因為到pH大約是9時,此時應該是氯化銨與氨水的緩沖溶液,再者生成的氨水有一部分揮發了,使溶液pH變化變小,還有可能是溶液已經是堿性,pH變化就像是酸堿中和滴定一樣,在中間這一段pH=7附近變化較快,后來即使是堿性增強其pH變化也小。
教師:你分析得很有道理,我也同意你的觀點,那對于問題2、問題3,同學們有什么想法,請和大家一起分享一下。
學生:在堿性條件下,仍能有大量氫氣生成,說明鎂條與溶液反應與酸堿性無關,但與pH=7的水不反應,說明與銨根離子或與氯離子有關。
教師追問:你的推理很好,那該如何設計實驗證明此觀點呢?
學生:對于氯離子,我們可以在氯化鈉溶液中加入鎂條,觀察現象,若有大量氣泡產生,則說明氯離子對此反應有促進作用,若無明顯現象,則說明無作用。
教師:那銨根離子起到的作用是什么,目前有三種觀點,觀點1:氫氧化鎂為中強堿,而氨水是弱堿性,鎂與水反應生成氫氧化鎂與氫氣,但氫氧化鎂難溶于水,附著在鎂條的表面,阻止了反應的進行,加入氯化銨溶液,鎂與水生成的氫氧化鎂與銨根離子反應生成氨水,從而使平衡右移;觀點2:氨根離子與鎂條反應生成氫氣與氨氣;觀點3:二者都有。請同學們課下思考,怎么設計實驗方案來證明是哪種觀點。
學生:將氯化銨直接溶解在乙醇中,得到氯化銨的乙醇溶液,再加入金屬鎂,觀察是否反應。
教師:這個方案很有創意,可以進行實驗來證明銨根離子是否可以直接與鎂條反應。
(三)教學反思
本節課用pH傳感器實時檢測鎂與氯化銨溶液反應后pH的變化,用曲線表征打破學生固有認知,引導學生向化學變化的本質方向思考,引導學生尊重客觀事實,帶領學生發現問題、提出問題、設計實驗方案、解決問題,體驗真實探究過程,使學生樂于參與,充分調動了學生的積極性,給相對死板的高三復習課帶來一絲激情。學生積極思考探究曲線變化的原因,使其知識得到綜合運用,發展學生的宏觀辨識與微觀探析的素養,更是打破傳統的宏觀—微觀—符號三重表征,上升到宏觀—微觀—符號—曲線表征。課下學生提供的方案,更能反映出本節課激發了學生的學習興趣,學生樂于學習思考,從被動學習轉化為主動學習。
筆者將探究實驗引入高三課堂復習教學中是一種大膽嘗試,特別是在新課標、新課程、新高考的“三新”的教學理念下進行有意義的課堂教學改革,有益于化學學科核心素養的落實,如宏觀辨識與微觀探析、科學探究與模型認知、科學態度與社會責任在本節課都得到很好的落實,課后學生的興奮及對實驗的追問,都體現了這是一次比較成功的高三課堂教學轉型。

