毒素-抗毒素系統對微生物活的非可培養狀態形成的影響研究進展
張鐵華,孟玲玲,趙 鳳
(吉林大學食品科學與工程學院,吉林 長春 130062)
微生物的生存面臨著來自宿主以及自然環境的壓力,尤其是受到不斷變化的自然環境(如低溫、高溫、重金屬、高滲透壓、消毒劑、抗生素等)的挑戰。為了適應惡劣環境,一些微生物會選擇形成一種低代謝活性但高抗性的生命形式,如芽孢、活的非可培養(viable but non-culturable,VBNC)狀態、持留菌等。芽孢是產芽孢細菌(主要是芽孢桿菌屬和梭菌屬)在環境營養條件缺乏時,在菌體內形成的一種休眠體。芽孢含水量極低、抗逆性強,食品工業也以對芽孢的殺滅效果來衡量產品的滅菌效果。VBNC狀態和持留狀態是非芽孢形成菌在面對不良環境時形成的一種休眠狀態。處于持留狀態的細菌對多種藥物具有耐受性,從而導致治療失敗。處于VBNC狀態的致病菌和腐敗菌仍然有造成食品腐敗變質及致病的風險,并且當條件適宜時,其可能會恢復為可培養狀態,這給食品產業和人類健康造成了嚴重的威脅。已有證據表明VBNC狀態致病菌可能參與食源性疾病暴發,1998年日本發生了由VBNC狀態腸出血性大腸桿菌O157:H7(enterohemorrhagic)污染的腌漬鮭魚籽所引起的嚴重食物中毒事件。無獨有偶,日本由干制魷魚引發的食物中毒事件同樣是由VBNC狀態的腸炎沙門氏菌()所引起。為了減少由VBNC狀態微生物引起的食品安全隱患,需要抑制微生物VBNC狀態的形成;為了靶向控制VBNC狀態的形成,需要對微生物VBNC狀態的形成機制有正確認知。目前關于微生物VBNC狀態的研究多集中在誘導條件、復蘇條件及檢測方法的探索上,對其形成機制的研究還不全面。而關于VBNC狀態形成的機制主要有兩種假設:一種認為極端的條件會造成細菌氧化損傷,進而抑制其生長,最終導致VBNC狀態的形成;另一種認為VBNC狀態的形成與芽孢的形成類似,是基因調控的結果。
毒素-抗毒素(toxin-antitoxin,TA)系統由兩個共表達的基因組成,其中一個編碼毒素,另一個編碼抗毒素。毒素可以抑制細菌生長,而抗毒素可以中和毒素抑制其發揮毒性作用。在環境惡劣時,TA系統被激活并且參與調控細菌生長。研究表明TA系統參與了微生物持留狀態與VBNC狀態的形成。不過,不良環境對TA系統的激活方式及TA系統與VBNC形成關系的研究還不全面。本文將重點綜述TA系統與微生物VBNC狀態形成的關系。
1 微生物的VBNC狀態與持留狀態
1982年,Xu Huaishu等研究霍亂弧菌()和大腸桿菌()在海洋與河口環境的存活規律時首次發現了VBNC狀態,處于該狀態的微生物仍具有代謝活性及完整的細胞結構,但在常規固體培養基中無法繁殖形成菌落。VBNC狀態是非芽孢形成菌處于不良環境時形成的一種休眠狀態,是微生物所采取的一種生存策略(圖1)。目前發現已有100多種微生物能夠形成VBNC狀態,包括多種食源性致病菌及腐敗菌。傳統的細菌培養法被認為是檢測食源性致病菌的金標準,但VBNC狀態細菌的不可培養性使得這種基于可培養性的檢測方法檢測不到VBNC狀態的細菌,這會導致食品中的細菌含量被大大低估,從而帶來微生物風險。目前對于VBNC細胞數的確定都是基于間接方法,即通過測定微生物的活細胞數以及可培養細胞數來間接獲得,二者的差值即為VBNC細胞數。
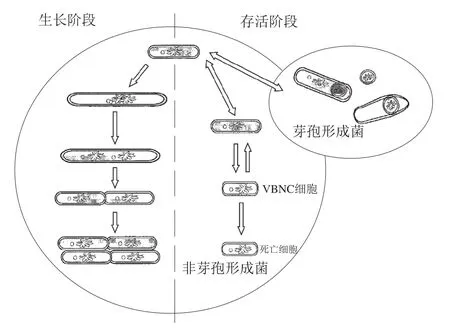
圖1 細菌的生命周期[10]Fig. 1 Life cycle of bacteria[10]
目前已知的可以誘導微生物進入VBNC狀態的因素包括溫度、營養、pH值、滲透壓、氧氣濃度、重金屬、抗生素、消毒劑、洗滌劑、防腐劑等;除此之外,干燥、巴氏殺菌、紫外照射、高壓二氧化碳、脈沖電場、超聲波、熱超聲等食品加工過程也會誘導微生物進入VBNC狀態。VBNC狀態微生物較常見的特征包括細胞形態改變、代謝活性降低、對外界刺激的抗性提高、基因表達發生變化等。當條件適宜時,比如逆轉誘導壓力、添加化學物質、與宿主細胞共培養或添加復蘇促進因子Rpf,有些VBNC狀態微生物能夠復蘇,重新獲得在培養基上生長繁殖的能力。比如創傷弧菌()在5 ℃低溫條件下進入VBNC狀態,將其移至室溫后,VBNC狀態的創傷弧菌成功實現復蘇;通過添加吐溫-80的方法可以使VBNC狀態的金黃色葡萄球菌()復蘇;VBNC狀態的銅綠膿假單胞菌()在與其宿主變形蟲共培養2 h后成功復蘇。值得注意的是,部分處于VBNC狀態的致病菌仍保留一定毒性,而且致病性會伴隨復蘇恢復。本實驗室在食品常用的貯藏條件下——冷藏(4 ℃)和冷凍(-20 ℃),研究了食品添加劑檸檬酸對金黃色葡萄球菌VBNC狀態形成的影響。研究發現,冷藏和冷凍條件均使檸檬酸體系中的金黃色葡萄球菌進入VBNC狀態,而且形成的VBNC細胞對胃腸液的抗性明顯增強;另外,胰蛋白胨大豆肉湯培養基、熱激處理、添加丙酮酸鈉、添加吐溫-80的方法均使VBNC細胞實現了復蘇;實時熒光定量聚合酶鏈式反應分析發現VBNC細胞中與黏附和生物被膜形成相關的一些基因表達發生了變化,并且發現生物被膜形成能力有隨著復蘇而恢復的潛力。鑒于VBNC狀態微生物的潛在危害,其已引起了研究者的廣泛關注。
抗生素持留菌是指在抗生素處理過程中產生的一部分對抗生素有耐受性的細胞。與攜帶可遺傳耐藥因子的耐藥細胞不同,抗生素持留菌通常在抗生素處理過程中呈現低的代謝活性,這使得它們不需要經歷基因突變而能夠耐受抗生素。2015年,Ayrapetyan等提出了休眠連續體假說(圖2),認為微生物的持留狀態與VBNC狀態有著密切關系。該假說指出某些環境脅迫(如抗生素處理)會誘導細胞中抗毒素的降解,導致其同源毒素(圖2中的紅色三角形)被釋放,釋放的毒素會通過影響細胞新陳代謝來影響細胞的生長。在環境脅迫處理前期,產生耐受性的非生長細胞——持留菌,該狀態菌可以在環境脅迫消除后快速恢復生長。然而,如果細胞長期暴露在環境脅迫下,積累的游離毒素量會增加,使細胞的代謝活性進一步降低,導致休眠程度增加,使細胞進入VBNC狀態。當環境脅迫去除后,處于VBNC狀態的細胞與持留菌相比需要更長的時間實現復蘇。2018年,Ayrapetyan等首先從VBNC細胞和持留菌的形成條件及二者對抗生素的耐受性等表型特征方面闡述了VBNC細胞和抗生素持留菌之間的關聯性;其次闡述了細菌在氨基酸饑餓下的應激反應、蛋白質水解、TA系統、ATP消耗等參與調控抗生素持留菌的分子機制也參與了VBNC狀態的調控,這說明VBNC細胞和抗生素持留菌在調控機制上有很多相似之處;雖然二者有諸多相似之處,但作者從VBNC細胞和抗生素持留菌的復蘇動力學角度論述了它們是兩種不同的休眠狀態,其中VBNC細胞處于較深的休眠狀態,而抗生素持留菌則處于較短暫的早期休眠狀態。
本實驗室在對金黃色葡萄球菌VBNC狀態形成機制的研究過程中,從VBNC細胞誘導液中分離出了一種蛋白,通過序列比對發現該蛋白屬于一種毒素蛋白,并通過實驗證明該蛋白會顯著影響VBNC細胞的形成。目前,已有大量研究證明TA系統參與持留菌的形成,但有關TA系統與VBNC狀態形成關系的報道仍較少。本文將從TA觸發系統及TA系統本身在VBNC狀態微生物中的表達情況及對VBNC狀態形成的作用綜述TA系統對微生物VBNC狀態形成的影響。

圖2 微生物休眠連續體假說[32]Fig. 2 Schematic representation of the microbial dormancy continuum hypothesis[32]
2 TA系統概述
典型的TA系統由穩定的毒素和不穩定的抗毒素組成,二者的編碼基因位于細菌質粒或染色體中。毒素和抗毒素協同表達,構成一個發揮多種功能的調控系統,在細菌耐受外界壓力、發揮毒力作用、抵御噬菌體侵染、調控生物膜形成、維持基因組穩定性等多個方面發揮作用。除了典型的TA系統外,研究者還發現了非典型的三組分TA系統,由毒素蛋白、抗毒素、轉錄調控因子或者分子伴侶組成,其中分子伴侶可以促進抗毒素折疊以及保護抗毒素免于降解。
根據毒素與抗毒素的化學組成及二者相互作用的方式,可將TA系統分為8 種類型,其中包括6 種被廣泛報道的TA系統及2 種新提出的TA系統,被命名為I~VIII型TA系統。其中,I、III型及VIII型TA系統的抗毒素是RNA,其余5 種TA系統中的抗毒素都是蛋白質;另外,除了最新發現的VIII型TA系統的毒素是RNA,其余TA系統的毒素都是蛋白質。在這8 種TA系統中,抗毒素抑制毒素發揮作用的方式多樣,可概括為抑制毒素蛋白的翻譯、直接與毒素結合而影響其功能的發揮、干擾毒素與靶標的結合、作為適配器促進毒素蛋白的降解、對毒素進行修飾等。現對每種TA系統中抗毒素與毒素的作用方式進行介紹。在I型TA系統中,抗毒素是RNA,其序列與編碼毒素蛋白的mRNA序列是互補的,因此抗毒素可與編碼毒素蛋白的mRNA結合,抑制毒素翻譯,從而起到調控毒素表達的作用。在II型TA系統中,毒素與抗毒素都是蛋白質,抗毒素蛋白通過與毒素蛋白的親和結合而抑制毒素的毒性。在III型TA系統中,抗毒素是RNA,能直接作用于毒素蛋白,從而抑制毒素活性。在IV型TA系統中,抗毒素是蛋白質,但是不能直接與毒素蛋白結合,而是通過與毒素蛋白的靶標相互作用,從而間接抑制毒素蛋白發揮功能。在V型TA系統中,抗毒素是一種核糖核酸酶(ribonuclease,RNase),可特異性切割編碼毒素蛋白的mRNA,阻止其翻譯。在VI型TA系統中,抗毒素SocA作為適配器促進酪蛋白裂解酶(caseinolytic protease,Clp)XP對毒素蛋白SocB的降解。不同于以上6 種類型,在Hha/TomB、TglT/TakA以及HepT/MntA這3 種TA系統中,抗毒素(TomB、TakA、MntA)通過對其同源毒素(Hha、TglT、HepT)修飾而發揮對毒素蛋白的拮抗作用,研究者建議將這種類型的TA系統命名為“VII型TA系統”。在大腸桿菌的Hha/TomB TA系統中,抗毒素TomB可氧化毒素蛋白Hha保守的半胱氨酸殘基,從而使毒素蛋白失活;在結核分枝桿菌()的TglT/TakA TA系統中,抗毒素TakA是一種新型的非典型絲氨酸蛋白激酶,通過磷酸化毒素蛋白TglT的S78位點而抑制毒素蛋白的活性;在廣泛存在于細菌和古生菌中的HepT/MntA TA系統中,MntA抗毒素具有核酸轉移酶活性,可將3 個AMP轉移到毒素蛋白HepT活性位點附近的酪氨酸殘基上,抑制毒素發揮作用。在VIII型TA系統中,毒素SdsR(也稱RyeB)和抗毒素RyeA是由相同位點的DNA正負鏈分別編碼的sRNA,因此抗毒素可以與毒素互補形成堿基對以中和毒素的作用。但TA系統的成員并不只有這8 種。Li Ming等近期在上發文報道了一類全新的TA系統,該系統由兩個sRNA組成,包括毒素和抗毒素,該TA系統可有效守護常間回文重復序列叢集/常間回文重復序列叢集關聯蛋白系統(clustered regularly interspaced palindromic repeats/CRISPR-associated proteins system,CRISPR-Cas)的結構和功能。CRISPR-Cas系統是在微生物中廣泛存在的抗病毒免疫系統,Li Ming等發現當這種新的TA系統與CRISPR-Cas偶聯存在時,Cas效應蛋白可以和抗毒素共同抑制毒素的表達,而一旦Cas效應蛋白被破壞(如病毒侵入),毒素就會表達并殺死微生物細胞,從而保護群體中其他細胞不被侵染,這是一種利他主義的群體防御策略。
通過TA系統成員的不斷增加,可以發現TA系統在微生物中存在普遍性,由此可見TA系統對微生物的生存發揮重要作用。
3 TA系統對VBNC狀態形成的影響
在外界環境惡劣時,微生物TA系統會被激活,其中的抗毒素含量下降,毒素游離出來,發揮毒性作用,進而抑制微生物生長。關于TA系統在不良環境中如何被激活存在爭議,目前研究者提出了激活TA系統的兩種模式,分別是被動模式和主動模式。被動模式認為,微生物為了應對逆境降低了編碼抗毒素的mRNA的翻譯速率,導致抗毒素含量降低,毒素活性得以發揮。在被動模式中,TA系統中抗毒素的產生速率易變,但其降解速率相對恒定。主動模式認為,不良環境會刺激微生物產生信號分子,信號分子進一步觸發蛋白酶降解抗毒素,使毒素活性得以發揮,進而影響細菌生長。在主動模式中,TA系統中抗毒素的產生速率恒定,但其降解速率易變。關于TA系統激活模式存在不同看法,可能是菌種的差異性及TA系統的復雜性導致的。TA觸發系統對TA系統的激活屬于主動模式,而且已有研究表明TA觸發系統與VBNC狀態形成存在一定關系。
3.1 TA觸發系統對VBNC狀態形成的影響
TA觸發系統包括、、、、、、和這8 種基因。已有研究表明TA觸發系統中的、、、、與微生物VBNC狀態的形成存在一定關系。基因編碼信號分子鳥苷四磷酸(guanosine tetraphosphate,ppGpp)的合成酶蛋白RelA,ppGpp可以感知環境脅迫、調控DNA復制及轉錄,是一種可誘導微生物進入持留狀態和VBNC狀態的應激因子;基因編碼的SpoT蛋白具有ppGpp水解酶活性和微弱的合成酶活性;編碼的Lon蛋白酶是ATP依賴蛋白酶,可以降解II型抗毒素;編碼外切聚磷酸酶(exopolyphosphatase,PPX),經典的PPX是單功能的,可維持多聚磷酸鹽(polyphosphate,PolyP)的穩態,另一類是雙功能的PPX/鳥苷五磷酸水解酶(PPX/guanosine pentaphosphate phosphohydrolase,PPX/GPPA),PPX/GPPA酶同時具有PPX和GPPA活性,負責產生ppGpp;編碼多聚磷酸鹽激酶(polyphosphate kinase,PPK),可介導PolyP的合成,而PolyP可激活Lon蛋白酶降解抗毒素。Zhang Jingfeng等用氨芐西林誘導阪崎腸桿菌()進入VBNC狀態,并比較了阪崎腸桿菌、、、、、這6 種基因在對數生長期和VBNC狀態下的轉錄水平,結果發現、、、、基因在VBNC細胞中的表達顯著上調,而基因在VBNC細胞中的表達沒有顯著性變化,因此提出了阪崎腸桿菌VBNC狀態形成的可能機制,即RelA和PPX/GPPA作用生成ppGpp,ppGpp通過激活PPK來積累PolyP,積累的PolyP可進一步激活Lon蛋白酶使抗毒素降解,由此釋放的游離毒素誘導阪崎腸桿菌進入VBNC狀態。
除了從TA觸發系統整體出發揭示其與VBNC狀態形成的關系,還有研究從TA觸發系統中某個組分入手探討它對VBNC狀態形成的影響,下文對TA觸發系統中單個組分的作用進行介紹。
3.1.1對VBNC狀態形成的影響
在VBNC狀態微生物中的差異表達已在多項研究中得到證實。Mishra等在4 ℃淡水體系中誘導霍亂弧菌的VBNC狀態,并分別比較了誘導第0、3、7、16、23天后(已進入VBNC狀態)菌體中的表達水平,發現在VBNC菌體中的表達量上調了60.8 倍。Zhang Jingfeng等用氨芐西林處理阪崎腸桿菌,結果發現在VBNC細胞中的表達量上調了3.7 倍。上述研究均發現TA觸發系統中的基因在VBNC狀態微生物中超量表達,因此推測RelA可能參與VBNC狀態的形成,這種推測被Jayakumar等的研究證實。Jayakumar等比較了4 ℃和30 ℃下人工海水中誘導霍亂弧菌野生型與缺失株進入VBNC狀態的時間,結果顯示在30 ℃下二者進入VBNC狀態的時間沒有顯著性差異,但在4 ℃下野生型比缺失株更快進入VBNC狀態,這表明可以促進霍亂弧菌VBNC狀態的形成。但值得注意的是,在VBNC狀態微生物中的表達情況與菌株類型有關。在5 ℃條件下,Nowakowska等用人工海水誘導霍亂弧菌臨床分離株(C-基因型)和環境分離株(E-基因型)進入VBNC狀態,研究發現C-基因型的VBNC細胞與指數期細胞的表達水平沒有顯著性差異,而對于E-基因型的VBNC細胞,的表達較指數期細胞顯著提高。通過上述研究,認為在某些微生物的VBNC狀態形成中起到一定作用,這種作用的發揮應與ppGpp有關。
3.1.2 Lon蛋白酶對VBNC狀態形成的影響
Lon蛋白酶通過降解II型抗毒素而導致菌體內的毒素抗毒素比例失調,引起游離毒素的釋放,一些毒素會抑制微生物的復制、翻譯過程,進而調控微生物進入休眠狀態。Zhang Jingfeng等用氨芐西林誘導阪崎腸桿菌,結果發現VBNC細胞中基因的表達量顯著上調了63.0 倍。目前關于Lon蛋白酶在VBNC狀態形成中的作用研究還比較少。然而,另一種與Lon蛋白酶有相似底物識別域的壓力應激蛋白酶已經被證明在VBNC狀態形成中發揮重要作用。當研究金黃色葡萄球菌中各種蛋白酶對菌體內3 種抗毒素MazE、Axe1和Axe2的半衰期影響時,發現只有或缺失株的抗毒素很穩定,因此認為ClpPC是降解金黃色葡萄球菌中抗毒素的主要蛋白酶。Kusumoto等對鼠傷寒沙門氏菌()的野生型菌株及Δ和突變株進行VBNC狀態誘導,發現Δ和突變株中的RpoS蛋白表達水平比野生型菌株中更高,而且突變株進入VBNC狀態的時間也出現延遲,這說明ClpX中的323~355位殘基在ClpX功能發揮上至關重要,并且ClpX可以通過降解RpoS來促進VBNC狀態的形成。基于上述研究,推測與Clp蛋白酶類似,TA觸發系統中的Lon蛋白酶同樣通過降解抗毒素來促進微生物VBNC狀態的形成。
3.2 TA系統中毒素和抗毒素對VBNC狀態形成的影響
Ayrapetyan等于2015年提出了微生物的休眠連續體假說,認為微生物的VBNC狀態是比持留狀態更深層的休眠狀態,二者之間存在許多相似的表型特征,并且有一些共有的分子機制調控二者的形成。研究發現TA系統可通過多種機制調控細胞生長和持留性,近年也有研究證明TA系統亦參與VBNC狀態的形成。
Pedersen等研究發現誘導毒素基因和的轉錄會使大腸桿菌進入VBNC狀態,隨后誘導抗毒素基因和的轉錄會完全逆轉這種狀態;同時該研究者發現的轉錄會嚴重抑制該菌的翻譯能力,而的轉錄會同時抑制DNA的復制與蛋白質翻譯。Christensen等也發現毒素ChpAK和ChpBK會抑制大腸桿菌的菌落形成及蛋白質翻譯能力。Korch等研究發現毒素基因在大腸桿菌中的過表達會抑制大分子合成并誘導VBNC狀態的形成。Christensen-Dalsgaard等研究發現霍亂弧菌中的毒素基因在大腸桿菌中過表達可以激活切割mRNA,抑制翻譯,從而促使該菌進入VBNC狀態。Demidenok等首次證實了TA系統參與分枝桿菌()休眠狀態的形成,研究發現該菌在向VBNC狀態轉變過程中伴隨著毒素基因的上調表達,進一步通過實驗發現過表達毒素基因可以促使恥垢分枝桿菌()進入VBNC狀態,而過表達抗毒素基因則使細胞不能形成VBNC狀態。Hino等將副溶血性弧菌()中II型TA系統的毒素基因在大腸桿菌中表達使大腸桿菌的細胞形態從桿狀變為絲狀,同時細胞進入VBNC狀態;而與抗毒素基因共表達后對大腸桿菌的生長沒有影響,并且可以抑制由單獨表達引起的菌體細胞形態變化。因為細菌形態變化通常與細胞不完全分裂有關,因此VP1843毒素蛋白可能通過抑制細胞分裂而使微生物形成VBNC狀態。Ayrapetyan等研究了II型TA系統和中毒素基因和在VBNC狀態創傷弧菌中的表達情況,發現在VBNC菌體中和的表達分別上調了16.8 倍和7.0 倍,但的表達沒有顯著性變化,另外、以及的表達分別顯著上調了20、23 倍和111 倍,這些毒素基因在VBNC細胞中的過量表達表明這些TA系統可能在VBNC狀態形成中發揮促進作用。Gupta等對結核分枝桿菌中的一種TA系統MparDE2進行研究,發現毒素基因在大腸桿菌中的異位表達可以促使大腸桿菌進入VBNC狀態;進一步通過實驗發現MParE2毒素蛋白可以抑制DNA旋轉酶活性;當將一定比例的MParD2抗毒素與MParE2毒素蛋白混合孵育30 min后再加入DNA旋轉酶反應混合物中,DNA旋轉酶可以正常發揮功能;然而,當DNA旋轉酶與MParE2先孵育一段時間,再加入MParD2則不能逆轉這種抑制作用。因此可以得出MParE2毒素蛋白是通過抑制微生物體內DNA旋轉酶的功能而誘導VBNC狀態的形成。總之,以上研究都表明TA系統中的毒素蛋白對微生物VBNC狀態的形成起促進作用。Aakre等研究了新月柄桿菌()的一種非典型TA系統SocAB中的毒素SocB與抗毒素SocA的互作機制,發現在有表達的細胞中誘導表達之后,細胞活性和形態沒有顯著變化;然而,在沒有表達的細胞中誘導表達5 h后,細胞活性顯著下降,菌落形成受到抑制,并且導致了細胞絲狀化;并發現毒素SocB通過與滑動鉗直接相互作用而抑制DNA復制延伸,由此也可推測TA系統參與了對微生物VBNC狀態形成的調控。
通過上述研究成果,本文總結了TA系統對微生物VBNC狀態形成的可能影響機制(圖3):在不良環境下,TA觸發系統中的基因發生差異表達,引起抗毒素的降解,導致毒素-抗毒素的比例失調,使游離毒素含量增加,這些游離毒素通過抑制DNA復制及蛋白質翻譯、促進mRNA斷裂、抑制細胞分裂等促進微生物VBNC狀態的形成。
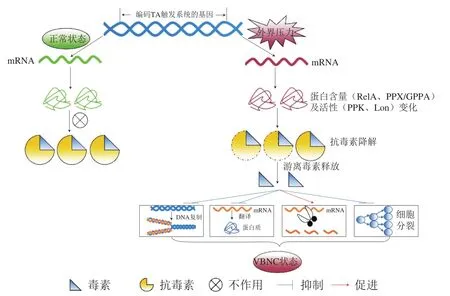
圖3 TA系統對微生物VBNC狀態形成的可能影響機制Fig. 3 Possible mechanisms for the influence of TA systems on the formation of microbial VBNC
4 結 語
微生物進入VBNC狀態后代謝活性降低,且不能在常規培養基上生長繁殖,因此VBNC狀態微生物不能被常規平板計數檢測,也不能進行某些生理活性檢測,引起假陰性的檢測結果,從而給人類健康帶來潛在威脅。已有證據表明VBNC狀態致病菌參與食源性疾病暴發。本文從微生物普遍存在的TA系統出發,根據已有的研究成果,提出了TA系統對微生物VBNC狀態形成的可能影響機制。但是,為了有效控制VBNC狀態的形成,目前的研究還遠遠不夠,除了要明確TA系統中毒素和抗毒素在VBNC菌體中的表達量及在VBNC狀態形成中的作用方式之外,還應研究抗毒素對毒素解除制約的確切機制以及毒素在VBNC狀態形成中發揮作用的活性位點,從而為尋找抑制VBNC狀態形成的方法提供明確方向。此外,新的TA系統的發現也為揭示微生物的VBNC狀態形成機制提供研究方向。

