大麻二酚通過調節腦內AMPA受體表達改善癡呆模型大鼠認知損害
周珊珊, 劉曉朦, Elona Khasanova, 武繼婷, 李子欣, 周 悅, 張黎明
老年癡呆是衛生領域重大疾病,給社會和家庭帶來沉重負擔。從1990年到2016年,全球老年癡呆癥患者數量增長了一倍多,主要原因是人口增長和老齡化[1]。阿爾茨海默病(Alzheimer’s disease,AD)是最常見的老年癡呆類型。隨著人口的老齡化的加劇,AD患病率迅速攀升,預計到2050年,中國AD患病人口將超過2000萬,是世界上AD患病人口最多、增長速度最快的地區[2]。目前AD的治療手段有限,僅有的幾種口服藥物,常難以達到滿意的效果。2021年美國加速批準上市針對β淀粉樣蛋白(amyloid protein β,Aβ)的AD治療藥物——阿杜那(Aduhelm)單抗因昂貴的價格和嚴重的副作用備受爭議[3]。
大麻二酚(cannabidiol,CBD)是從大麻植物中提取的一種化學物質,但它與大麻的另一種化學成分四氫大麻酚(tetrahydrocannabinol,THC)不同,CBD沒有致幻作用。既往研究表明,CBD在癲癇、抑郁癥、多發性硬化和帕金森病中通過抗氧化、抗炎等多種方式發揮神經保護作用[4]。近幾年,CBD在AD中的作用成為研究熱點,進一步探討CBD改善AD認知障礙的作用機制,為CBD的臨床應用提供理論依據勢在必行[5]。本研究探討了CBD對鏈脲菌素(streptozotocin,STZ)誘導的認知損害模型大鼠認知功能和腦內α-氨基-3-羥基-5-甲基-4-異惡唑丙酸受體(α-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid receptor,AMPAR)表達的變化。旨在探討CBD改善認知障礙的潛在機制,為CBD防治AD提供理論依據。
1 材料和方法
1.1 實驗材料及主要試劑 CBD(上海麥克林生化科技有限公司,C875838),STZ(美國Sigma公司,V900890),兔抗大鼠多克隆GluR1和GluR2抗體(一抗,美國Affinity生物科技公司,AF6306,AF6307),內參抗體 β-actin(一抗,沈陽萬類生物科技有限公司,WL01845),全蛋白提取試劑盒(沈陽萬類生物科技有限公司,WLA019),BCA蛋白濃度測定試劑盒(沈陽萬類生物科技有限公司,WLA004),辣根過氧化物酶標記羊抗兔IgG(二抗,沈陽萬類生物科技有限公司,WLA023)。
1.2 實驗動物及給藥方法 所有動物實驗均在哈爾濱醫科大學附屬第一醫院實驗動物倫理委員會批準和監督下實施(倫理學審批編號:2020-075)。成年雄性SD大鼠40只,購于哈爾濱醫科大學附屬第二醫院實驗動物中心,動物合格證號:SCXK(黑)2019-001。體重300~350 g。按每組10只隨機分為4組:假手術組(S),CBD+假手術組(CBD+S),模型組(STZ),CBD+模型組(CBD+STZ)。CBD和吐溫80按1∶1溶解后加入生理鹽水稀釋至濃度為1%的CBD溶液。CBD+S和CBD+STZ組大鼠按10 mg/kg給與CBD溶液每日一次腹腔注射,共28 d。其余兩組每日給與等量溶劑腹腔注射。
1.3 雙側腦室內注射STZ誘導的認知損害模型的建立 依照文獻[6]的方法制模:10%水合氯醛3 ml/kg 腹腔注射麻醉,將大鼠頭部固定于立體定位儀上,沿頭部正中線做矢狀切口,分離皮下組織暴露顱骨。取前囟后0.8 mm,左右旁開1.6 mm顱骨打孔,垂直深度4.0 mm微量加樣器緩慢 雙側腦室內注射STZ 3 mg/kg。注入的STZ生理鹽水溶液體積控制在10 μl左右,假 手術組腦室內注射相應體積的生理鹽水。注射完畢用骨蠟封填顱骨缺損,縫合頭皮。48 h后重復上述手術注藥過程。
1.4 Morris水迷宮試驗 造模28 d后進行Morris水迷宮測試大鼠學習和記憶能力[7]。水迷宮是一個直徑150 cm,高60 cm充滿水的圓形不銹鋼水池,水池壁為黑色,水池分為4個象限。逃逸平臺是一個透明的直徑為10 cm的可移動圓柱形平臺,其表面距水面2 cm。在測試中將平臺放置在任一象限,選擇某個象限將大鼠面朝池壁放入水中。大鼠到達平臺后令其在平臺停留30 s,然后繼續下一次訓練。每次尋找平臺時間不超過60 s,記錄大鼠每次到達平臺所用的時間(逃逸潛伏期),60 s內未找到平臺逃逸潛伏期按60 s記錄。每天訓練4次,共訓練5 d。
1.5 跳臺試驗 水迷宮試驗后進行跳臺試驗評價各組大鼠的學習記憶能力。跳臺試驗箱大小為25 cm ×25 cm ×75 cm,箱底鋪滿金屬方格網,在箱底一角放置一個高5cm,直徑8cm的安全平臺。首日將大鼠放在安全平臺上,當大鼠跳下平臺,四肢會受到電擊(3 Hz,0.4 mA),經過反復的跳上跳下,大鼠最終會停留在平臺上,實驗時間為300 s。次日重復相同的實驗并記錄大鼠第一次跳下平臺的時 間(潛伏期)和300 s內大鼠從平臺跳下的次數(錯誤次數)。
1.6 Western-blot檢測AMPAR表達 按試劑說明書抽提總蛋白質。制備標準曲線,制備蛋白質待測液,BCA反應,以標準蛋白濃度及對應吸光值繪制標準曲線,并通過回歸方程計算樣本蛋白濃度,并乘以稀釋倍數,即為樣本的蛋白濃度。根據目的蛋白分子量大小選用對應濃度的聚丙烯酰胺凝膠,電泳分離蛋白質(40 μg)轉移至PVDF膜。用TBST緩沖液配制的5%(M/V)脫脂奶粉封閉后,孵育GluR1(1∶1000)和GluR2(1∶1000)一抗,4℃過夜。孵育二抗(1∶5000),37 ℃,45 min,以超敏ECL試劑顯影拍照。將膠片進行掃描,用凝膠圖象處理系統(Gel-Pro-Analyzer軟件)分析目標條帶的光密度值。
1.7 統計學方法 應用SPSS 24.0軟件對數據進行統計學分析,正態分布的計量資料以均值±標準差表示。多組間比較應用單因素方差分析(ANOVA),方差齊性時,用LSD檢驗進行兩兩比較,方差不齊時,組間比較用Dunnett’s T3。以P<0.05為差異有統計學意義。
2 結 果
2.1 Morris水迷宮 Morris水迷宮試驗中,各組大鼠1 d至5 d平均逃逸潛伏期(s)呈逐漸縮短趨勢。5 d逃逸潛伏期(s)結果為:S組(13.00±5.40),CBD+S組(14.00±3.77),STZ組(41.3±5.29),CBD+STZ組(21.4±5.52)。STZ組與S組比較,逃逸潛伏期顯著延長(P<0.01);CBD+STZ組與STZ組比較,逃逸潛伏期顯著縮短(P<0.01);S組與CBD+S組比較差異無統計學意義(P>0.05)(見圖1)。
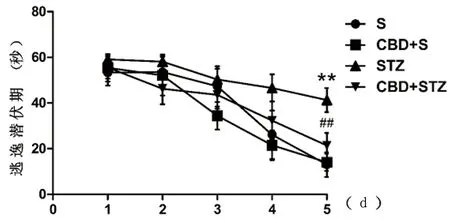
與S組比較**P<0.01;與STZ組比較##P<0.01
2.2 跳臺試驗 跳臺試驗中,各組大鼠潛伏期(s)結果為:S組(275.90±30.74),CBD+S組(265.50±34.60),STZ組(207.70±37.08),CBD+STZ組(244.60±41.59)。STZ組與S組比較,潛伏期顯著縮短(P<0.01);CBD+STZ組與STZ組比較,潛伏期顯著延長(P<0.05);S組與CBD+S組比較差異無統計學意義(P>0.05)。(見圖2A)。各組大鼠錯誤次數(次)結果為:S組(2.10±2.47),CBD+S組(2.80±2.53),STZ組(5.40±1.71),CBD+STZ組(3.20±2.35)。STZ組與S組比較,錯誤次數顯著增加(P<0.01);CBD+STZ組與STZ組比較,錯誤次數顯著減少(P<0.05);S組與CBD+S組比較差異無統計學意義(P>0.05)(見圖2B)。
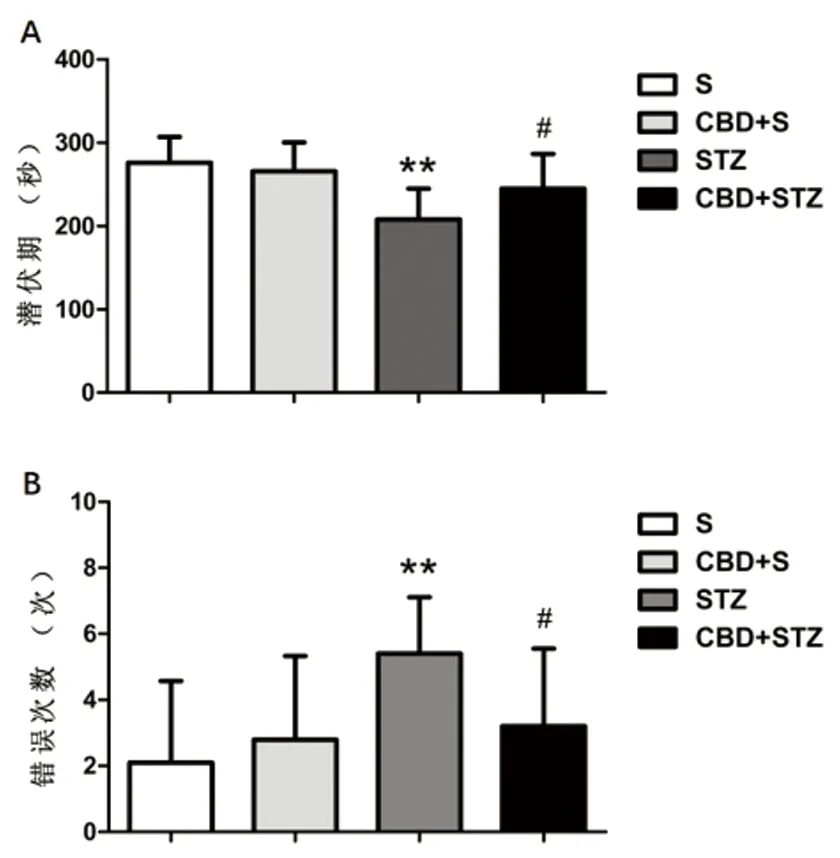
與S組比較**P<0.01;與STZ組比較#P<0.05
2.3 Western-blot檢測AMPAR表達 各組大鼠皮質和海馬GluR1相對表達量分別為:S組(0.52±0.06)、(0.54±0.05),CBD+S組(0.44±0.06)、(0.43±0.12),STZ組(1.03±0.18)、(1.36±0.24),CBD+STZ組(0.82±0.06)、(0.99±0.09)。STZ組與S組比較,皮質和海馬的GluR1表達均顯著增加(P<0.01)、(P<0.01);CBD+STZ組與STZ組比較,皮質和海馬的GluR1表達均顯著減少(P<0.01)、(P<0.05)。S組與CBD+S組比較差異無統計學意義(P>0.05)(見圖3)。各組大鼠皮質和海馬GluR2相對表達量分別為:S組(0.55±0.07)、(0.52±0.16),CBD+S組(0.39±0.12)、(0.44±0.06),STZ組(1.36±0.07)、(1.05±0.15),CBD+STZ組(0.86±0.19)、(0.82±0.08)。STZ組與S組比較,皮質和海馬的GluR2表達均顯著增加(P<0.01)、(P<0.01);CBD+STZ組與STZ組比較,皮質和海馬的GluR2表達均顯著減少(P<0.01)、(P<0.01)。S組與CBD+S組比較差異無統計學意義(P>0.05)(見圖3)。
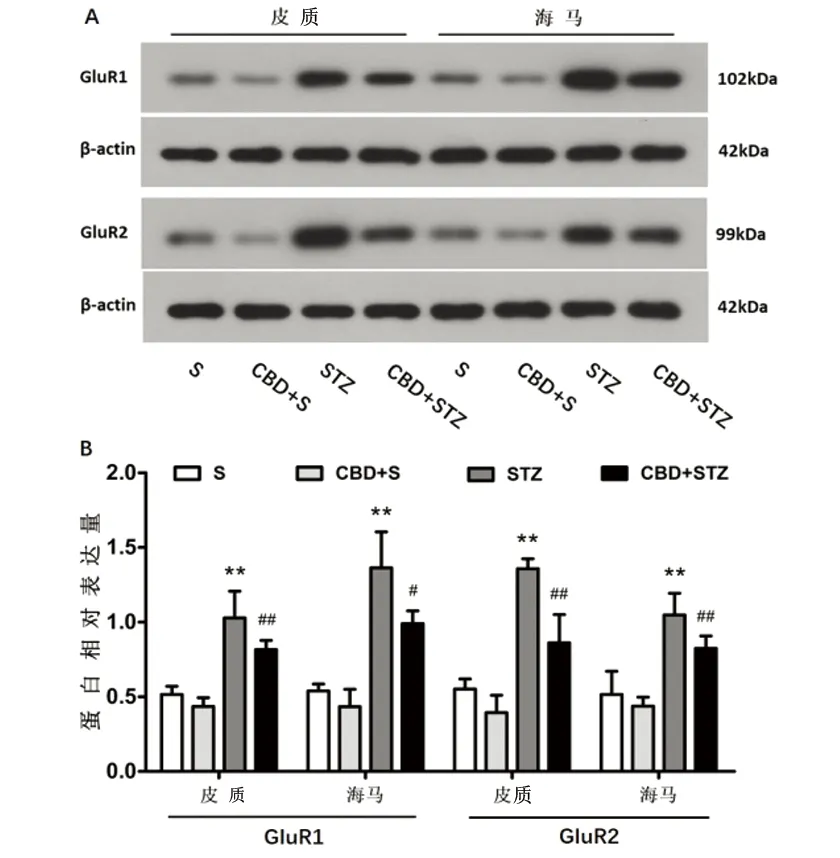
與S組比較**P<0.01;與STZ組比較#P<0.05;與STZ組比較##P<0.01
3 討 論
AD發病機制不清,可能的機制包括β淀粉樣蛋白級聯假說,過度磷酸化tau蛋白引起的神經原纖維纏結,炎性機制,線粒體功能障礙,興奮性毒性和突觸功能障礙等。目前,常用于AD治療的藥物包括膽堿酯酶抑制劑和N-甲基-D-天冬氨酸受體拮抗劑,AD 的新藥研發進展緩慢。曾被人們寄予厚望的Aβ抗體以及tau蛋白聚集抑制劑的相關臨床試驗都以失敗告終[8,9]。隨著癡呆患者數量不斷增加以及患者和家屬對認知功能改善的迫切需求,開發廉價有效的治療方法已成為當務之急。
CBD是一種在大麻中發現的植物大麻素,其脂溶性較高,容易通過血腦屏障。與四氫大麻酚(Tetrahydrocannabinol,THC)不同,CBD沒有致幻作用和成癮性[10]。已有研究表明CBD具有抗氧化應激,抗炎,促進神經發生等藥理作用[4]。2018年6月,首個CBD藥物Epidiolex?被批準用于治療難治性癲癇[11]。除癲癇外,CBD在焦慮抑郁,多發性硬化和帕金森病等多種神經系統疾病中通過多種方式發揮神經保護作用[4]。針對AD多種復雜的發病機制,單一作用于疾病某一環節很難有好的治療效果,而CBD這種可以作用于多個靶點的藥物可能在AD的防治中更具有潛力。
體外研究發現,CBD具有抗炎、抗氧化和神經保護作用,可防止海馬和皮質神經退行性變,減少tau蛋白過度磷酸化,并調節小膠質細胞遷移[5]。此外,CBD被證明可以預防Aβ介導的神經毒性和小膠質細胞激活的神經毒性,通過誘導APP泛素化減少Aβ的生成,并且CBD可能通過與PPARγ的相互作用逆轉Aβ誘導的長時程增強減弱[12]。然而,CBD在AD中的體內研究還相對較少,尤其是CBD對認知障礙動物模型腦內谷氨酸傳遞的作用鮮有報道。本研究觀察了STZ誘導的認知障礙模型大鼠腦內AMPAR的表達變化以及CBD的作用,旨在探討CBD改善認知作用的新靶點。
STZ是一種氨基葡萄糖化合物代謝后產生的細胞毒性產物,它能夠誘導胰腺β細胞損傷。在大鼠雙側腦室內注射亞致糖尿病劑量的STZ被認為是一種散發AD動物模型,可導致認知功能障礙,腦內葡萄糖和能量代謝受損,氧化應激增加,谷氨酸興奮性毒性增加和tau蛋白過度磷酸化等類似AD的病理變化[13,14]。本研究應用雙側腦室內注射STZ建立大鼠認知障礙模型,給與CBD治療,通過Morris水迷宮和跳臺實驗測試發現CBD干預后大鼠學習記憶能力明顯改善。
神經遞質失衡,興奮性毒性和突觸喪失被認為是認知功能障礙長期存在的原因。對APPswe/PS1dE9轉基因小鼠的皮質神經元的研究發現,在病理進展的早期和晚期階段神經興奮性是不同的:幼齡期表現為低興奮性,老齡期表現為高興奮性;超興奮性的原因可能是興奮性谷氨酸受體上調和網絡抑制減少的結果[15]。除此之外,Nakajima等研究發現AMPAR阻滯劑(吡侖帕奈)可改善動物卒中后認知障礙[16]。最近的研究顯示STZ誘導的認知障礙大鼠腦內谷氨酸含量增加[14],本研究發現雙側腦室注射STZ四周后大鼠腦內AMPAR顯著增加,提示興奮性谷氨酸受體的上調在STZ誘導的認知障礙中起作用。
研究發現CBD對AD轉基因小鼠認知障礙的改善作用與Aβ負荷減少無關,此外,CBD治療不會改變皮質脂質氧化水平[5]。多項研究表明CBD 在體內發揮作用與內源性大麻素系統密切相關。內源性大麻素系統包含兩種大麻素受體(CB1R和CB2R),CBD對CB1R具有負向別構調節作用,對CB2R具有部分激動作用[17]。然而,選擇性CB2激動劑并不能預防認知障礙,這表明CBD通過其他機制發揮改善認知的作用。Poulia等研究發現大麻二酚通過激活ERK1/2逆轉氯胺酮引起的大鼠腦內AMPAR增加[18]。本研究觀察了CBD對STZ誘導的認知障礙模型大鼠腦內AMPAR表達的影響,結果顯示CBD顯著降低了STZ誘導的AMPAR表達上調。提示CBD通過減少AMPAR在病理狀態下的異常過表達,降低谷氨酸興奮性毒性,從而改善認知功能。最近的一項研究首次表明CBD可作為AMPAR的負變構調節劑(當AMPAR特異由GluA1/GluA2亞基構成時),CBD顯著降低了AMPAR介導的誘發性興奮性突觸后電流(eEPSCs)和微小興奮性突觸后電流(mEPSCs)的振幅和頻率,并且顯著加速GluA1和GluA2亞基的失活[19]。CBD對AMPAR的上述抑制作用依賴于其與GluA1/GluA2 N-末端結構域的相互作用。
綜上,病理狀態下AMPAR表達的上調可能是機體促進神經突觸傳遞和突觸可塑性正常化的代償機制。然而,上調的AMPAR增加了腦內谷氨酸興奮性毒性,出現細胞內鈣累積,導致細胞穩態的破壞和腦組織的結構損傷。CBD通過調控AMPAR表達改善認知障礙的作用提示AMPAR可能是CBD的重要作用靶點,其改善認知作用的具體機制值得深入研究。

