顆粒蛋白前體、E-鈣黏附蛋白在良惡性胃潰瘍組織中的表達及臨床意義
王嘉菲, 田 洲, 王 蕾, 陳 娟
(北京市大興區(qū)人民醫(yī)院 消化內(nèi)科, 北京, 102699)
胃潰瘍是世界范圍內(nèi)常見的一種消化系統(tǒng)疾病,主要由感染幽門螺桿菌(Hp)、分泌大量胃酸、服用大量非甾體消炎藥造成,此外不良生活習慣也會導致胃潰瘍的發(fā)生,嚴重時良性胃潰瘍還會向惡性胃潰瘍轉變[1]。部分胃潰瘍會發(fā)生癌變,而盡早治療可減少癌變的發(fā)生,對保障患者的生命健康極為重要[2]。顆粒蛋白前體(PGRN)是分泌型生長因子的上皮蛋白家族成員之一,在腫瘤發(fā)生、胚胎發(fā)育、炎癥調(diào)節(jié)、傷口愈合中起重要作用[3]。研究[4]表明, PGRN高表達與癌癥擴散的發(fā)生相關。E-鈣黏附蛋白(E-cadherin)是一種跨膜糖蛋白,屬于鈣黏蛋白家族成員之一,鈣黏蛋白間的相互作用可確保細胞間緊密接觸,已有研究[5-6]發(fā)現(xiàn)胃癌的發(fā)生一定程度上與上皮鈣黏蛋白的表達異常有關。既往關于PGRN、E-Cadherin的研究多集中于子宮頸鱗癌、卵巢癌、結直腸癌等方面,目前關于良惡性胃潰瘍中PGRN、E-Cadherin的研究較少。本研究探討了PGRN、E-Cadherin在良惡性胃潰瘍組織中的表達及臨床意義,以期為探究PGRN、E-Cadherin在胃潰瘍中的作用機制提供一定的理論依據(jù)。
1 資料與方法
1.1 一般資料
選取2015年4月—2017年7月北京市大興區(qū)人民醫(yī)院收治的190例胃潰瘍患者作為研究對象。將85例良性胃潰瘍患者納入良性胃潰瘍組,男40例,女45例,平均年齡(50.32±15.31)歲,取其胃鏡活檢組織作為樣本; 將105例惡性胃潰瘍(潰瘍型胃癌)患者納入潰瘍型胃癌組,男54例,女51例,平均年齡(52.33±16.85)歲,取其手術切除潰瘍型胃癌組織作為樣本。納入標準: ① 經(jīng)鏡檢、活檢確診,臨床資料完整者; ② 首次患病,無Hp根除治療史者; ③ 未接受其他方法治療者; ④ 潰瘍型胃癌患者均接受手術切除治療。排除標準: 患有自身免疫系統(tǒng)疾病者。本研究經(jīng)北京市大興區(qū)人民醫(yī)院醫(yī)學倫理委員會審核批準,所有患者和家屬知情并簽署同意書。
1.2 主要材料
兔抗人PGRN多克隆抗體(貨號251319, 深圳市豪地華拓生物); E-cadherin多克隆抗體(貨號ABP57182, 艾美捷科技); 即用型SP免疫組織化學試劑盒(貨號CDJ-1593C-SJH, 武漢純度生物); 實時熒光定量聚合酶鏈反應(qRT-PCR)試劑盒[貨號HEPENGBIO-TG646,赫澎(上海)生物]。
1.3 方法
1.3.1 樣本采集: 良性胃潰瘍組取患者胃鏡活檢組織作為樣本,潰瘍型胃癌組取患者手術切除胃癌組織作為樣本。用生理鹽水清理組織樣本,一部分樣本于甲醛固定、石蠟包埋后進行5 μm切片,一部分樣本于-80 ℃保存。
1.3.2 免疫組織化學法檢測PGRN、E-Cadherin蛋白表達: 將上述石蠟切片進行二甲苯脫蠟、水化,并用磷酸鹽緩沖液(PBS)沖洗5 min。先根據(jù)試劑盒說明書進行SP法染色,再用蘇木精復染、重新水化后封片進行觀察。結果判定: ① 染色強度,未染色記0分,弱陽性染色記1分,中等陽性染色記2分,強陽性染色記3分; ② 陽性細胞占比,≤25%為0分, >25%~50%為1分, >50%~75%為2分, >75%為3分。染色強度評分和陽性細胞占比評分的乘積即染色指數(shù)(SI), SI≤1判為陰性, SI>1~3判為弱陽性, SI>3~<6判為中等陽性, SI≥6判為強陽性[7]。
1.3.3 qRT-PCR檢測組織中PGRN、E-CadherinmRNA表達: 將組織置于液氮預冷的研缽中研磨后,加入TRIzol試劑提取總RNA, 經(jīng)反轉錄為cDNA后行qRT-PCR擴增,以β-actin為內(nèi)參,用2-△△CT法分析PGRN、E-CadherinmRNA表達水平,引物見表1。

表1 qRT-PCR引物
1.4 隨訪方法
通過電話隨訪或入院復查方式進行為期3年的跟蹤隨訪,記錄患者預后生存情況,截止時間為患者死亡時間或2020年7月。
1.5 統(tǒng)計學分析
2 結 果
2.1 一般資料比較
2組患者年齡、體質(zhì)量指數(shù)、性別比較,差異無統(tǒng)計學意義(P>0.05); 潰瘍型胃癌組患者病程短于良性胃潰瘍組, Hp感染率高于良性胃潰瘍組,差異有統(tǒng)計學意義(P<0.05)。見表2。
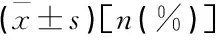
表2 2組患者一般資料比較
2.2 組織樣本中PGRN、E-Cadherin蛋白陽性表達情況
免疫組織化學檢測結果顯示,潰瘍型胃癌組PGRN蛋白陽性表達率高于良性胃潰瘍組, E-Cadherin蛋白陽性表達率低于良性胃潰瘍組,差異有統(tǒng)計學意義(χ2=30.721、14.463,P<0.001), 見圖1、表3。
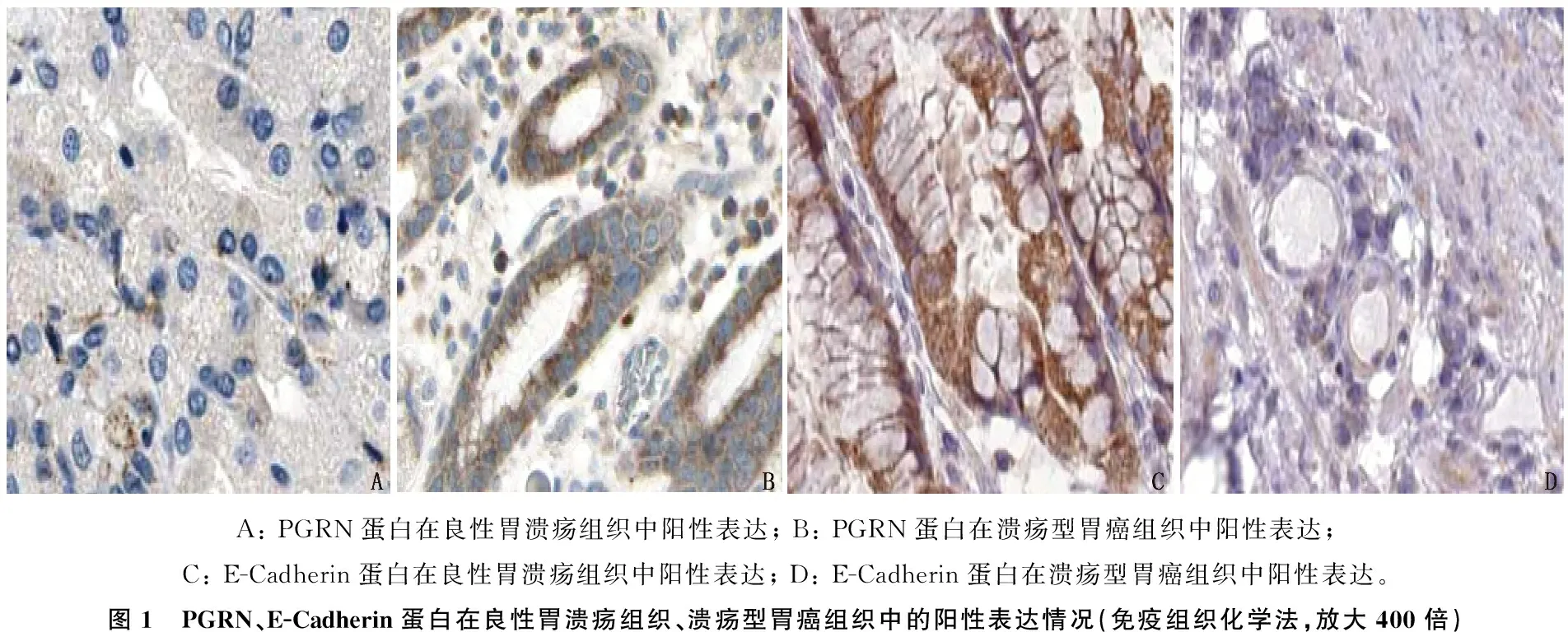
A: PGRN蛋白在良性胃潰瘍組織中陽性表達; B: PGRN蛋白在潰瘍型胃癌組織中陽性表達; C: E-Cadherin蛋白在良性胃潰瘍組織中陽性表達; D: E-Cadherin蛋白在潰瘍型胃癌組織中陽性表達。圖1 PGRN、E-Cadherin蛋白在良性胃潰瘍組織、潰瘍型胃癌組織中的陽性表達情況(免疫組織化學法,放大400倍)

表3 2組組織樣本中PGRN、E-Cadherin蛋白表達情況比較[n(%)]
2.3 組織樣本中PGRN、E-Cadherin mRNA表達水平
qRT-PCR檢測結果顯示,潰瘍型胃癌組PGRNmRNA表達水平高于良性胃潰瘍組,E-CadherinmRNA表達水平低于良性胃潰瘍組,差異有統(tǒng)計學意義(t=9.674、10.802,P<0.001), 見表4。

表4 2組組織樣本中PGRN、E-Cadherin mRNA表達水平比較
2.4 良性胃潰瘍和潰瘍型胃癌組織中PGRN、E-Cadherin蛋白陽性表達的相關性分析
Spearman相關分析法結果顯示,良性胃潰瘍組織中, PGRN、E-Cadherin蛋白陽性表達呈負相關(r=-0.529,P<0.001), 見表5; 潰瘍型胃癌組織中, PGRN、E-Cadherin蛋白陽性表達呈負相關(r=-0.426,P<0.001), 見表6。

表5 良性胃潰瘍組織中PGRN、E-Cadherin蛋白表達的相關性分析

表6 潰瘍型胃癌組織中PGRN、E-Cadherin蛋白表達的相關性分析
2.5 良性胃潰瘍和潰瘍型胃癌組織中PGRN、E-Cadherin mRNA表達水平的相關性分析
Pearson相關分析法結果顯示,良性胃潰瘍組織、潰瘍型胃癌組織中,PGRN、E-CadherinmRNA表達水平均呈負相關(r=-0.441、-0.306,P<0.001), 見圖2、圖3。

圖2 良性胃潰瘍組織中PGRN、E-Cadherin mRNA表達水平的相關性
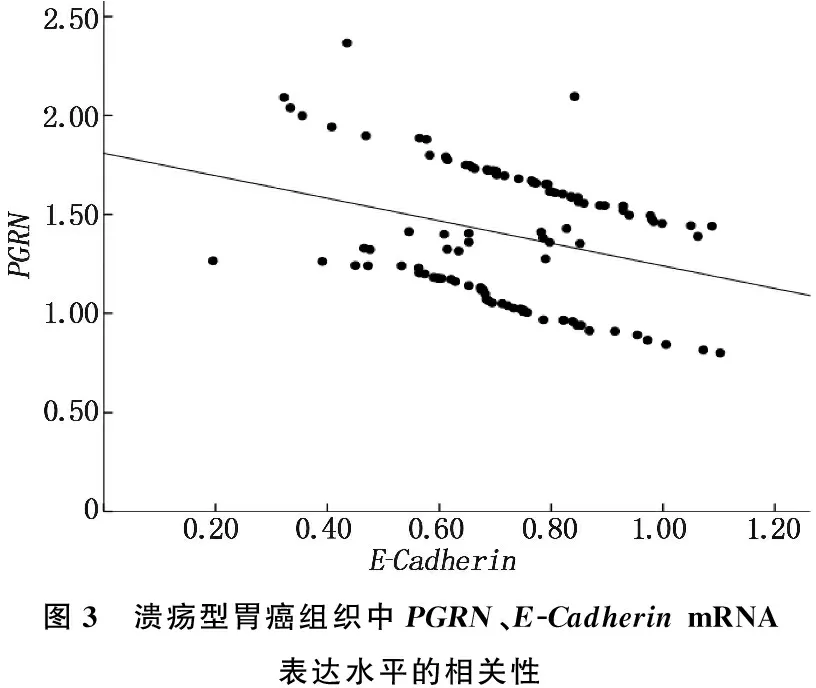
圖3 潰瘍型胃癌組織中PGRN、E-Cadherin mRNA表達水平的相關性
2.6 PGRN、E-Cadherin蛋白陽性表達率與潰瘍型胃癌患者臨床病理參數(shù)的關系
不同性別、年齡、腫瘤直徑、潰瘍部位患者的潰瘍型胃癌組織PGRN、E-Cadherin蛋白陽性表達率比較,差異無統(tǒng)計學意義(P>0.05); 有淋巴結轉移、浸潤程度T3~T4期、低分化和TNM分期Ⅲ~Ⅳ期患者的PGRN蛋白陽性表達率分別高于無淋巴結轉移、浸潤程度T1~T2期、高分化和TNM分期Ⅰ~Ⅱ期患者, E-Cadherin蛋白陽性表達率分別低于無淋巴結轉移、浸潤程度T1~T2期、高分化和TNM分期Ⅰ~Ⅱ期患者,差異有統(tǒng)計學意義(P<0.05)。見表7。
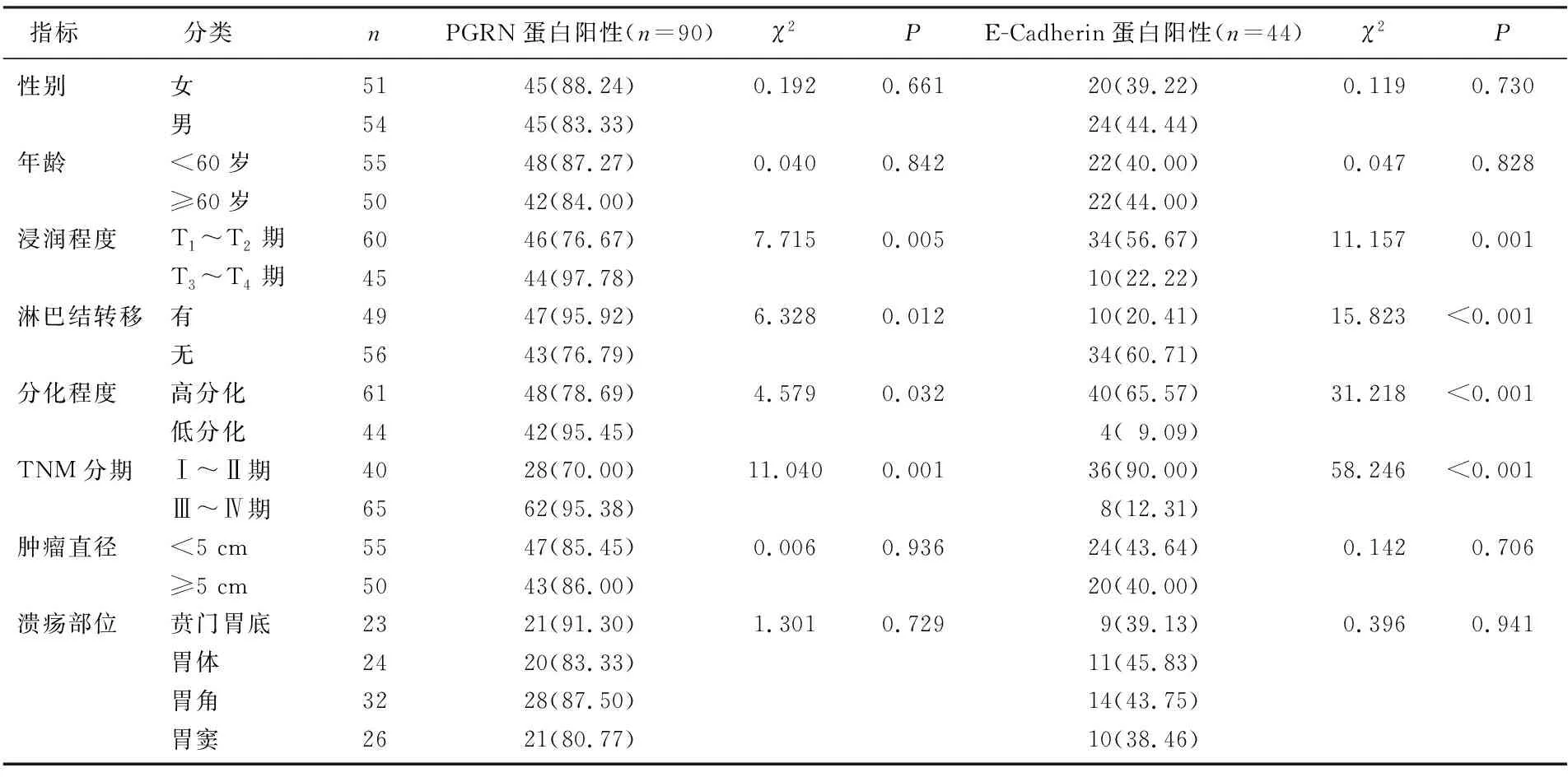
表7 不同臨床病理特征潰瘍型胃癌患者PGRN、E-Cadherin蛋白陽性表達情況比較[n(%)]
2.7 PGRN、E-Cadherin mRNA單獨和聯(lián)合應用對潰瘍型胃癌的診斷價值
ROC曲線顯示,PGRNmRNA診斷潰瘍型胃癌的曲線下面積(AUC)為0.855(95%CI: 0.803~0.907), 敏感度為75.29%, 特異度為87.06%, 截斷值為1.229;E-CadherinmRNA診斷潰瘍型胃癌的AUC為0.908(95%CI: 0.868~0.949), 敏感度為75.24%, 特異度為94.12%, 截斷值為0.892;PGRN、E-CadherinmRNA聯(lián)合診斷潰瘍型胃癌的AUC為0.959(95%CI: 0.935~0.984), 敏感度為80.91%, 特異度為82.33%;PGRNmRNA聯(lián)合E-CadherinmRNA診斷潰瘍型胃癌的AUC顯著大于PGRN、E-CadherinmRNA單獨診斷的AUC(Z=3.471,P<0.001;Z=0.039,P=0.019)。見圖4。

圖4 PGRN、E-Cadherin mRNA單獨和聯(lián)合診斷潰瘍型胃癌的ROC曲線
2.8 潰瘍型胃癌影響因素的Logistic回歸分析
Logistic回歸分析發(fā)現(xiàn), TNM分期、淋巴結轉移、分化程度、浸潤程度、PGRN蛋白表達和E-Cadherin蛋白表達均為潰瘍型胃癌的獨立影響因素(P<0.05), 見表8。

表8 潰瘍型胃癌影響因素的多元Logistic回歸分析
2.9 PGRN、E-Cadherin蛋白表達與潰瘍型胃癌患者生存預后的關系
3年隨訪結果顯示, 105例潰瘍型胃癌患者中, 31例死亡, 74例生存,生存率為70.48%。PGRN蛋白陽性表達患者生存率為66.67%, PGRN蛋白陰性表達患者生存率為93.33%, 差異有統(tǒng)計學意義(Log-rankχ2=3.884,P=0.049), 見圖5; E-Cadherin蛋白陽性表達患者生存率為90.91%, E-Cadherin蛋白陰性表達患者生存率為55.74%, 差異有統(tǒng)計學意義(Log-rankχ2=15.422,P<0.001), 見圖6。由此表明,潰瘍型胃癌組織中PGRN蛋白陽性表達、E-Cadherin蛋白陰性表達均與患者3年生存預后不良相關(P<0.05)。

圖5 潰瘍型胃癌組織中PGRN蛋白表達情況與患者生存預后的關系
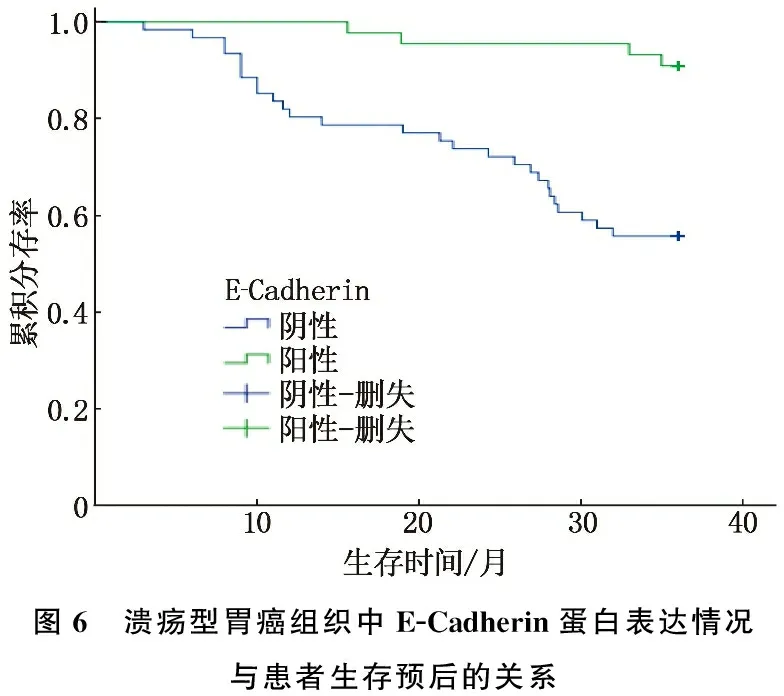
圖6 潰瘍型胃癌組織中E-Cadherin蛋白表達情況與患者生存預后的關系
3 討 論
胃潰瘍是臨床常見的胃部疾病,其中良性胃潰瘍是Hp感染、膽汁反流等多種因素使得胃液中H+與胃黏膜接觸造成的黏膜屏障損壞,病程長,而惡性胃潰瘍是由惡性腫瘤向漿膜方向生長供血不足而局部脫落壞死所形成的凹陷,病程短[8]。潰瘍型胃癌是由胃黏膜病變引發(fā)的癌變,因此監(jiān)測病情發(fā)展可預防癌變的發(fā)生,而分析良惡性胃潰瘍的臨床特征對患者病情診斷和治療方案制訂具有重要作用[9]。
PGRN表達于多種細胞內(nèi),在腫瘤發(fā)生、癌癥擴散、胚胎發(fā)育、炎癥調(diào)節(jié)、傷口愈合中起著重要作用,已被用作腫瘤標志物[10-11]。相關報道[12-13]稱,PGRN基因敲除可阻斷小鼠核因子κB(NF-κB)通路,抑制JAK激酶(JAK)/信號傳導與轉錄激活因子3(STAT3)信號通路的激活,從而抑制乳腺癌細胞的遷移和侵襲。李媛媛等[14]研究表明, PGRN在胃腸道間質(zhì)瘤患者瘤組織中的陽性表達率顯著增高,與患者預后不良相關。PGRN在胃癌組織中的免疫反應性顯著增強,且與腫瘤病理學分期密切相關。本研究發(fā)現(xiàn),與良性胃潰瘍組相比,潰瘍型胃癌組PGRN蛋白陽性表達率顯著增高,與相關研究[14]結論一致,提示PGRN表達增加可能與胃癌的發(fā)生相關。
E-cadherin在細胞膜上可通過相互作用確保細胞間的緊密接觸,研究[6]發(fā)現(xiàn)胃癌的發(fā)生與上皮鈣黏蛋白的表達異常有一定關系。抑制E-cadherin表達可促進上皮-間充質(zhì)轉化(EMT), 并減少細胞間相互作用[6]。E-cadherin參與多種信號通路,其表達降低可導致β-連環(huán)蛋白過度積累激活Wnt靶基因表達,從而促進細胞增殖和腫瘤發(fā)生[15]。在胃癌組織中, E-cadherin表達顯著降低,且與淋巴結轉移、浸潤程度、TNM分期關系密切[16]。相關研究[17]表明, E-cadherin表達下調(diào)能促進胃癌細胞SGC7901的增殖和轉移,這可能與其抑制細胞凋亡有一定關聯(lián)。本研究發(fā)現(xiàn),與良性胃潰瘍組相比,潰瘍型胃癌組E-Cadherin蛋白陽性表達率顯著降低,與相關研究[16]結果一致,提示E-Cadherin表達降低可能參與胃潰瘍患者的癌變過程。
研究[5]表明,微小RNA-29b-3p(miR-29b-3p)可通過靶向PGRN來改變下游Wnt信號傳導,刺激EMT發(fā)生[18], 然而抑制E-cadherin表達亦可促進EMT的發(fā)生。本研究發(fā)現(xiàn), PGRN表達與E-cadherin表達呈負相關,表明兩者可能相互作用并共同影響胃潰瘍的疾病進展。本研究還發(fā)現(xiàn),PGRN、E-CadherinmRNA聯(lián)合診斷潰瘍型胃癌的AUC相較兩者單獨診斷時顯著增加,潰瘍型胃癌組織中PGRN、E-Cadherin蛋白表達與淋巴結轉移、浸潤程度、分化程度和TNM分期有關,且PGRN蛋白陽性表達和E-Cadherin蛋白陰性表達均為潰瘍型胃癌的獨立危險因素,與相關研究[14, 16]結果一致。由此表明, PGRN、E-cadherin對潰瘍型胃癌具有較好的診斷價值,可作為早期診斷及臨床監(jiān)測指標應用于良惡性胃潰瘍患者中,從而改善治療效果。本研究結果還顯示,潰瘍型胃癌組織中PGRN蛋白陽性表達、E-Cadherin蛋白陰性表達均與患者3年生存預后不良相關,表明PGRN、E-cadherin可用于潰瘍型胃癌患者的生存預后分析,監(jiān)測PGRN、E-cadherin水平并盡早治療,可能對延長患者生存期具有一定作用。
綜上所述,與良性胃潰瘍組織中相比,潰瘍型胃癌組織中PGRN表達顯著增加, E-Cadherin表達顯著降低; PGRN、E-cadherin對潰瘍型胃癌具有較高的診斷價值,且兩者與潰瘍型胃癌患者的臨床病理特征和生存預后有關。本研究初步探討了PGRN、E-Cadherin在良惡性胃潰瘍中的表達及臨床意義,對患者的臨床特征分析和預后評估具有一定參考價值,未來有待進一步探究兩者在良惡性胃潰瘍中的具體作用機制。

