皮膚致敏性替代試驗方法的研究進展
黃靜怡, 李培寧, 劉香梅, 劉忠華, 黃宇鋒
(1. 華南農(nóng)業(yè)大學(xué)獸醫(yī)學(xué)院,廣州 510630; 2. 廣州質(zhì)量監(jiān)督檢測研究院,廣州 511447)
過敏性接觸性皮炎(allergic contact dermatitis,ACD) 是由低分子量化合物(low molecular weight,LMW)與存在于皮膚中的內(nèi)源蛋白結(jié)合形成的Ⅳ型超敏反應(yīng)。ACD 的臨床癥狀通常表現(xiàn)為皮膚瘙癢、紅斑及丘疹等。LMW普遍存在于化學(xué)品、藥品以及個人護理用品中,LMW與皮膚的頻繁接觸會導(dǎo)致ACD發(fā)病率增加。研究表明,在歐洲特定人群中,ACD 的患病率高達18.6%,占西方世界工作人口中所有職業(yè)性皮膚病的85%~90%[1]。因此,ACD 已經(jīng)成為一種職業(yè)性皮膚病,在一定程度上影響了人類的正常生活和工作。
傳統(tǒng)的皮膚致敏性測試通常采用的是動物實驗,譬如豚鼠最大值試驗(guinea pig maximization test,GPMT)、Buehler 封 閉 斑 貼 試 驗(Buehler test,BT)等。然而,隨著近年來毒理檢測技術(shù)的進步、研究方法的更新、動物倫理被越來越多的國家重視和關(guān)注,皮膚致敏性測試替代方法的開發(fā)就顯得尤為重要。因此,本文結(jié)合國內(nèi)外研究進展,就體內(nèi)替代致敏方法、基于有害結(jié)局通路(adverse outcome pathway,AOP)機制的體外替代方法以及基因組過敏原快速檢測法(genomic allergen rapid detection,GARD)等目前幾類皮膚致敏性測試替代方法進行綜述。
1 體內(nèi)替代方法
皮膚致敏體內(nèi)替代方法是指使用小鼠替代豚鼠作為實驗動物主體,建立小鼠局部淋巴結(jié)測試法(local lymph note assay,LLNA)。根據(jù)LLNA 法的優(yōu)點和局限性,研究人員開發(fā)了基于LLNA 法的改良方法,即5-溴 脫 氧 尿 嘧 啶 核 苷 (5-bromo-2-deoxyuridine,BrdU)-酶聯(lián)免疫吸附測定(enzyme linked immunosorbent assay,ELISA)-LLNA 法和LLNA-內(nèi)源性三磷酸腺苷(adenosine triphosphate,ATP)檢測法。
1.1 基礎(chǔ)的LLNA法
LLNA是鑒別化學(xué)物質(zhì)是否具有致敏潛力的替代測試方法之一,已被歐盟67/548/EEC 指令認可。LLNA是以致敏物能誘導(dǎo)皮膚接觸部位引流淋巴結(jié)中的T 細胞活化增殖為基礎(chǔ),將被放射性物質(zhì)標記的核酸(如3H-甲基胸腺嘧啶脫氧核苷、125I-碘脫氧尿嘧啶核苷等)由尾靜脈注入小鼠體內(nèi)[2],5 h后取誘導(dǎo)部位淋巴結(jié)制備單細胞懸液,測定T細胞增殖情況。
該方法的檢測指標有兩個。一是刺激指數(shù)(stimulation index,SI),即受試組與對照組增殖T細胞的比值,該指標用于判斷受試物是否為致敏劑。當SI≥3 時,受試物被判定為致敏劑[3]。另一個檢測指標是SI=3時的有效化學(xué)品濃度(effective chemical 3,EC3),該值可以通過劑量-反應(yīng)數(shù)據(jù)的線性差值得出[4],用于受試物的致敏能力分級。根據(jù)歐洲化學(xué)品生態(tài)毒理學(xué)和毒理學(xué)中心公布的數(shù)據(jù),當EC3<0.1%時,受試物判定為極強致敏劑;當EC3在0.1%~1%時,受試物為強致敏劑;EC3在1%~10%時,受試物為中度致敏劑;EC≥10%,則為弱致敏劑[5]。
LLNA法具有周期短、實驗動物使用量少、判定方法更為客觀準確等優(yōu)點,同時不需用弗氏佐劑來刺激受 試 動 物, 符 合 3R (reduction、 repIacement、refinement)原則。LLNA 法已于2010 年被世界經(jīng)濟合作與發(fā)展組織(Organization for Economic Co-operation and Development,OECD)納入皮膚致敏檢測方法指南[6]。值得一提的是,LLNA 法易被受試物的溶解性所限制。因水溶性大分子物質(zhì)很難在小鼠的皮膚上涂抹均勻并被吸收[7],因此該方法只適用于脂溶性的小分子物質(zhì)。
1.2 已通過驗證的LLNA改良法
1.2.1 BrdU-ELISA-LLNA法
2003 年,Takeyoshi 等[8]利用示蹤劑代替放射性標志物建立了LLNA 的改良方法,即BrdU-ELISALLNA(又稱LLNA:BrdU-ELISA)。其在原理和檢測指標方面,與LLNA 法基本一致,但在核酸標志物方面改用與胸腺嘧啶結(jié)構(gòu)相似的BrdU。即在末次染毒24 h 后腹腔注射BrdU,處死小鼠取淋巴結(jié),稱重后制備細胞懸液,然后采用ELISA 法檢測增殖細胞中BrdU的標記數(shù)。
該方法綜合了LLNA 試驗周期短、動物用量少、判定方法客觀的優(yōu)點,還解決了LLNA 法使用放射性標記物的安全性問題。在OECD 指南中,該方法推薦使用CBA 小鼠,但這種品系的小鼠在我國供應(yīng)數(shù)量較少,且價格偏貴。因此,有學(xué)者通過對比分析BALB/c和CBA 兩種品系小鼠用該方法試驗的結(jié)果,證實可以使用BALB/c 小鼠替代CBA 小鼠進行LLNA:BrdUELISA法檢測[9]。除此之外,該法腹腔注射BrdU時會使小鼠痛苦,不符合動物福利。基于此,有研究團隊改進了LLNA:BrdU-ELISA 法,先給小鼠耳部染毒后處死,取耳后引流淋巴結(jié),在含有BrdU的培養(yǎng)基中體外培養(yǎng)淋巴細胞24 h后,再對淋巴細胞中的BrdU含量進行測定[10]。
1.2.2 LLNA-ATP檢測法
LLNA-ATP 檢測法(又稱LLNA:DA) 是基于ATP水平與活細胞數(shù)呈正相關(guān),并且可與熒光素-熒光素酶復(fù)合物作用產(chǎn)生可測定光這一原理,因此可以通過生物熒光法檢測細胞中ATP 的含量來確定受試物的致敏性[11]。該法選用的測試指標包括ATP發(fā)光值、淋巴結(jié)質(zhì)量、增殖的淋巴細胞數(shù),以及SI和EC值[12]。
該方法具有LLNA:BrdU-ELISA 法的全部優(yōu)點,但因?qū)TP 數(shù)量作為測試指標,有著明顯的局限性。(1)時間限制:動物死后體內(nèi)ATP 數(shù)量會逐漸下降,若長時間不進行測定,測試結(jié)果會出現(xiàn)偏差。因此,OECD 指南明確規(guī)定待測樣本從取材到檢測的時間應(yīng)在20 min以內(nèi)[13]。(2)假陽性:為解決這個問題,有研究人員提出,可以同時開展耳重、耳厚差等活組織檢測以及紅斑評級,以排除受試物的刺激性對結(jié)果的影響[14]。(3)該法不適用于影響ATP生成和穩(wěn)定性的受試物,例如ATP抑制劑等[14]。
2 基于AOP的體外替代方法
2007 年,由美國國家科學(xué)研究委員會首次提出AOP,用以描述皮膚敏化從分子起始事件到系統(tǒng)敏化效應(yīng)產(chǎn)生過程中的一系列反應(yīng)事件。2012 年,OECD提出將皮膚變態(tài)反應(yīng)的體外研究方法整合,建立基于AOP原理的皮膚致敏預(yù)測方法[15-16],包括直接反應(yīng)肽試驗(direct peptide reactivity assay,DPRA)、氨基酸衍生物反應(yīng)性測定(amino acid derivative reactivity assay,ADRA)、KeratinoSensTM/LuSens試驗和人細胞系活化試驗(human cell line activation test,h-CLAT)。
皮膚致敏AOP 機制由4 個要素組成:(1)起始事件(molecular initiating event,MIE)是抗原和皮膚蛋白結(jié)合形成免疫復(fù)合物半抗原;(2)角質(zhì)細胞反應(yīng)是半抗原被角質(zhì)細胞攝取,發(fā)生炎性反應(yīng),產(chǎn)生的炎性因子激活樹突狀細胞(dendritic cells,DCs);(3)DCs反應(yīng)是DCs 被激活后攝取呈遞抗原,表面特異性標志物表達上升,釋放的細胞因子激活T 細胞;(4)組織/器官層次事件是DCs 提呈相容性復(fù)合物(major histocompatibility complex,MHC)后遷移至淋巴結(jié),T細胞識別MHC 形成特異性T 細胞,當機體再次接觸同種抗原時發(fā)生ACD。與毒性反應(yīng)不同,AOP 最關(guān)鍵的特征是以可檢測到的4 種分子事件的定向關(guān)系為研究要點[17]。
2.1 DPRA化學(xué)法
Gerberick 團隊于2004 年開發(fā)了DPRA 法,該方法模擬致敏物質(zhì)與皮膚蛋白共價結(jié)合形成半抗原(即AOP 通路中起始事件)的過程。采用化學(xué)方法將致敏原與谷胱甘肽以及半胱氨酸和賴氨酸多肽的肽模板反應(yīng)結(jié)合,再使用高效液相色譜-紫外線檢測(high performance liquid chromatography-ultraviolet,HPLC-UV)測定兩種結(jié)合抗原的消耗情況,以此來判定受試物致敏能力[18]。其檢測結(jié)果與LLNA法的一致性可達到89%。該方法已于2015年被OECD收錄至TG 442C指南[19]。
目前該法主要用于單一化學(xué)品或化妝品原料的致敏測定,未能應(yīng)用到化妝品成品檢測。2009 年,Gerberick等[20]對DPRA法進行了改良,在反應(yīng)體系中加入了辣根過氧化物酶-過氧化氫,使該方法擁有檢測抗原前體物的能力,擴大了檢測范圍,為拓展DPRA法的應(yīng)用范圍打下了強有力的基礎(chǔ)。
為了提高檢測通量、靈敏度及準確性,Wei等[21]開發(fā)了一種基于384 孔板的快速固相萃取(solid phase extraction,SPE)-串聯(lián)質(zhì)譜(tandem mass spectrometry,MS)-DPRA自動化快速檢測法。與HPLC-UV法相比,SPE-MS通量從每份樣品的16 min縮短到10 s,底物使用量也從100 mmol/L 減少到5 μmol/L,大大提高了檢測效率。
2.2 ADRA法
化學(xué)方法代替動物實驗進行皮膚致敏測試的局限性在于,HPLC-UV分析中待測化學(xué)品與親核試劑的共同洗脫,導(dǎo)致無法準確量化未反應(yīng)的親核試劑以及預(yù)測待測物的致敏能力[22]。為解決這個問題,F(xiàn)ujita等[23]開發(fā)并驗證了一種新型的皮膚致敏替代方法,即ADRA法。
該方法的原理與DPRA 法類似,同樣模擬AOP 通路中的起始事件,只是在使用HPLC-UV 定量時改為281 nm 進行,提高了基線穩(wěn)定性。該方法中使用的親核試劑是由Fujita團隊制定合成的兩種氨基酸衍生物乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)和乙酰賴氨酸(N-α-acetyl-L-lysine,NAL)[24]。ADRA 法測試終點為NAC/NAL 的反應(yīng)性,即根據(jù)待測物中未反應(yīng)的NAC/NAL 濃度相對于對照組平均濃度下降值而計算出的消耗百分比。
2019年,F(xiàn)ujita團隊通過改用熒光檢測開發(fā)了新的ADRA-熒光檢測法(ADRA-fluorescence detection,ADRA-FL)[25]。相對于傳統(tǒng)ADRA 法使用HPLC-UV和高效液相色譜-熒光法(high performance liquid chromatography-fluorescence, HPLC-FL), ADRA-FL
測量NAC和NAL時擁有更高的靈敏度和信噪比(指電子設(shè)備或者電子系統(tǒng)中信號與噪聲的比例)。研究人員對化妝品常用植物提取物溶液(蘆薈、甘草、綠茶)分析的結(jié)果顯示,該方法存在預(yù)測多成分物質(zhì)致敏風(fēng)險的可能性,但因受試物中含有免疫抑制劑,故無法評估免疫抑制效應(yīng)。
2.3 KeratinoSensTM/LuSens試驗
半抗原由抗原和皮膚蛋白結(jié)合生成,當其接觸表皮角質(zhì)形成細胞后,可引起氧化應(yīng)激反應(yīng)(即關(guān)鍵事件2)。在機體發(fā)生氧化應(yīng)激時,抗氧化應(yīng)激感受器的主要調(diào)控因子Kelch 樣ECH 相關(guān)蛋白1(Kelch-like ECH-associated protein 1,Keap1)與核轉(zhuǎn)錄因子E2 相關(guān) 因 子2 (nuclear factor erythroid 2 related factor 2,Nrf2)相互作用,對改善氧化應(yīng)激至關(guān)重要[26]。
基于上述原理,研究人員開發(fā)了兩種來源于角質(zhì)細胞水平的測試方法KeratinoSensTM和LuSens試驗。這兩種檢測方法的區(qū)別在于抗氧化反應(yīng)元件(antioxidant response element,ARE)不同:KeratinoSensTM試驗的ARE 來源于人的AKR1C2(Aldo-keto reductase family 1 member C2)基因,而后者來自大鼠的NQO1(NAD(P)H quinone dehydrogenase 1)基因[27]。兩種基因均含熒光素酶,因此都以熒光素酶的誘導(dǎo)倍數(shù)(fold of induction,F(xiàn)I)作為評價指標[27],當FI>1.5時可判斷受試物為致敏物。
有研究表明,與人類皮膚致敏數(shù)據(jù)以及LLNA 測試結(jié)果相比,KeratinoSensTM試驗的準確率分別為94%和93%,而LuSens 試驗稍低,分別為83%和74%[28]。目前,KeratinoSensTM試驗已被納入OECD 指南442D中[28],而LuSens試驗還處于驗證階段。
2.4 h-CLAT法
h-CLAT 法的開發(fā)基于AOP 通路的關(guān)鍵事件3 和4(即DCs事件和組織/器官層次事件)。將急性單核細胞白血病THP-1細胞暴露于無細胞毒性的受試物中24 h,終止暴露后收集細胞,利用流式細胞儀測定細胞表面表達物CD86和CD54的相對熒光強度變化[29],以此為依據(jù)判定待測物是否具有致敏性。
該測試方法需要重復(fù)3次試驗,且保證2次試驗結(jié)果均為有效,才能進行下一步判定。將結(jié)果與陰性對照組進行比對,如CD86>150%且CD54>200%,則表明THP-1 細胞被活化,判定受試物為致敏劑。研究表明,h-CLAT 法與LLNA 法的試驗結(jié)果一致性為84%[30]。2018 年,該方法被OECD 納入毒理學(xué)測試指南[31]。
治療前兩組患者的SAS、SDS評分對比差異并不顯著,P>0.05;治療前后比較兩組差異顯著,P<0.05;組間比較差異具有統(tǒng)計學(xué)意義(P<0.05)。見表2:
袁園等[32]通過對h-CLAT 法驗證的10 種物質(zhì)分別采用CCK-8細胞增殖/毒性檢測法和流式細胞儀法進行檢測,結(jié)果顯示兩種方法的組內(nèi)相關(guān)系數(shù)為0.993,一致性很高。此外,研究人員還發(fā)現(xiàn)將IL-8 與CD86結(jié)合作為檢測終點也能夠?qū)χ旅粑镞M行判定[33]。同時,該方法也可以用于篩選致敏生物標志物。Karkhanis 團隊于2021 年利用強致敏劑1-氯-2,4-二硝基苯(1-chloro-2,4-dinitrobenzene,DNCB)、中等強度致敏劑二氯化鎳(NiCl2)以及陰性對照二甲基亞砜(dimethyl sulfoxide,DMSO)處理TPH-1 細胞,通過RNA 測序確定了5 種新型的h-CLAT 標志物:CD109、CD181、CD183、CLEC5A和CD354[34]。
3 基于基因組學(xué)的過敏原快速檢測法
隨著基因組學(xué)技術(shù)的發(fā)展以及對皮膚變態(tài)反應(yīng)發(fā)生機制的研究不斷深入,研究人員將目光投向了基因組學(xué)方面。2011 年,Johansson 等[35]發(fā)現(xiàn)了一種細胞系——人類急性髓細胞白血病細胞系MUTZ-3,其在轉(zhuǎn)錄和誘導(dǎo)特異性T細胞產(chǎn)生應(yīng)答等方面與DCs相似。MUTZ-3 分化后其免疫相關(guān)表型類似于未成熟的DCs,表達CD1d、MHCⅠ和MHCⅡ呈遞抗原,并誘導(dǎo)特異性T細胞增殖。
變態(tài)反應(yīng)產(chǎn)生的生物標志物能夠?qū)χ旅粑锖头侵旅粑镞M行識別,并出現(xiàn)不同轉(zhuǎn)錄結(jié)果。因此,這些不同致敏劑的有效預(yù)測指標統(tǒng)稱為GARD 預(yù)測信號(GARD predictive signals,GPS)。GPS包括與先天免疫反應(yīng)信號、DCs 成熟、應(yīng)激反應(yīng)和外來物質(zhì)識別相關(guān)的基因,有著完整的能夠識別和監(jiān)測皮膚致敏中各種關(guān)鍵事件的能力。基于這一原理,研究人員建立了一種基于MUTZ-3 細胞的GARD 法。該方法的判斷終點是根據(jù)GPS 的轉(zhuǎn)錄水平,使用支持向量機(support vector machine,SVM) 賦予待測樣本一個決定值(decision value,DC)。DC>0,為致敏劑;DC≤0,則為非致敏劑[36]。
GARD 是一種基于基因組讀數(shù)、新型且靈活的體外致敏評估法,該方法可測試200 個與致敏相關(guān)的基因轉(zhuǎn)錄組的變化。這些基因的生物標志物特征包括參與氧化應(yīng)激、DCs 成熟以及細胞因子反應(yīng)的轉(zhuǎn)錄本[37]。體內(nèi)完整基因組所帶來的巨大的多功能性,為進一步發(fā)展和拓寬皮膚致敏分析方法提供了條件,也為進一步了解體內(nèi)致敏的過程提供了參考。其次,整體基因組讀數(shù)提供的大量信息,還可用于特定信號或代謝途徑機制的研究[38]。此外,GARD法還可用于判定呼吸致敏劑,如Masinja 等[39]發(fā)現(xiàn)了一種能夠區(qū)分呼吸致敏劑和非致敏劑的生物標志物,并整理在尚未公開的數(shù)據(jù)庫中。
4 皮膚致敏替代方法的比較分析
隨著毒理學(xué)技術(shù)不斷發(fā)展以及人類對動物實驗越來越重視,研究人員逐步將目光投向皮膚致敏試驗替代方法的開發(fā)驗證。因而,越來越多的替代方法如LLNA、LLNA:BrdU-ELISA、DPRA、GARD等相繼出現(xiàn),并通過驗證。
如表1 所示,各種替代方法均有不同的優(yōu)缺點。這些方法的優(yōu)勢大多集中于實驗動物的使用量減少,甚至是使用細胞替代了實驗動物,靈敏度和準確度較高,以及測試時間縮短等方面。但各個方法的局限性也很突出,尤其是結(jié)果假陽性以及對待測物的性質(zhì)和溶解度要求較高等問題。皮膚致敏AOP 是一個完整的生物過程,而現(xiàn)有的替代方法無法完全覆蓋整個通路,因此有必要通過組合方法來改善。
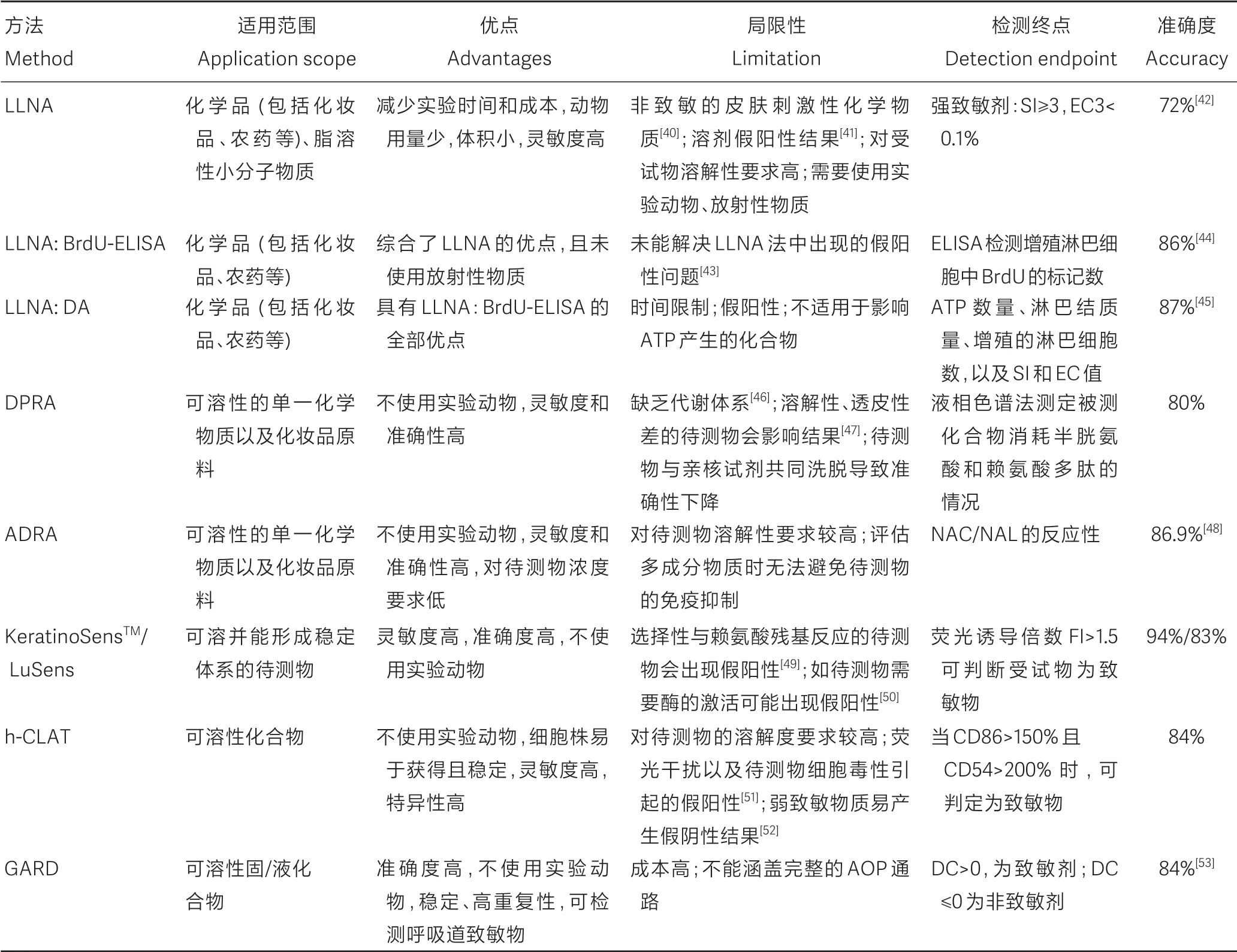
表1 皮膚致敏替代方法的比較Table 1 Comparison of alternative methods of skin sensitization
5 整合策略與評估方法
皮膚變態(tài)反應(yīng)是一個極為復(fù)雜的過程,憑借單獨的體外測試方法無法完整獲取皮膚致敏信息,若對皮膚致敏反應(yīng)進行更進一步的探索,則需結(jié)合各種替代方法的靈敏度、優(yōu)缺點等方面建立方法組合策略。因此,OECD 于2016 年發(fā)布了整合策略與評估方法來評價未知化合物的致敏性及其致敏效力。整合策略與評估方法是一種基于科學(xué)、實用的化學(xué)危害特征描述方法,即依據(jù)現(xiàn)有的化學(xué)結(jié)構(gòu)特征信息、毒理學(xué)信息、計算機模型、體外實驗結(jié)果進行的綜合分析及整合測試策略,以評價受試物的致敏性和風(fēng)險類別[54]。
定量構(gòu)效關(guān)系(quantitative structure activity relationship,QSAR)是通過分析現(xiàn)有的某一系列具有相同生物活性且結(jié)構(gòu)相似的化合物,以其理化或結(jié)構(gòu)參數(shù)為自變量,生物活性為因變量,利用數(shù)理統(tǒng)計方法,建立化合物結(jié)構(gòu)與其生物活性之間的定量關(guān)系[58]。QSAR 系統(tǒng)能夠?qū)Χ鄠€毒理學(xué)終點進行預(yù)測。近年來,研究人員嘗試將其應(yīng)用到化妝品皮膚致敏性評價中,開發(fā)了類似的皮膚滲透性QSAR 模型,并闡明了化合物的皮膚滲透性與致敏性之間的關(guān)系[59]。同時,采用計算機模擬QSAR 軟件進行化妝品毒理學(xué)評價,也得到了越來越多的重視,例如化合物毒性預(yù)測工具樹(toxic hazard estimation,Toxtree)、OECD 開發(fā)的QSAR 工具箱(OECD QSAR Toolbox)、組織新陳代謝 模 擬 器(tissue metabolism simulator,TIMES-SS)等[60]。但這類軟件是作為單一致敏評估方法來開發(fā)和驗證的,因此一些國外大型日化企業(yè)將基于AOP 通路的皮膚致敏替代方法與這些QSAR 軟件結(jié)合后自主開發(fā)出皮膚致敏測試整合策略。
目前,OECD 在整合策略與評估方法指導(dǎo)文件中納入的整合策略大都由國外大型日化企業(yè)開發(fā),例如德國巴斯夫(BASF) 公司開發(fā)的“3 選2”原則(BASF‘2 out of 3’)、美國寶潔(P&G)公司開發(fā)的貝葉斯網(wǎng)絡(luò)整合測試策略(Bayesian network integrated testing strategy)、法國歐萊雅(L’ORéAL)公司開發(fā)的堆疊元模型(Stacking Meta-mode),以及日本資生堂(Shiseido) 公司開發(fā)的人工神經(jīng)網(wǎng)絡(luò)分析法(artificial neural network)等[61]。
5.1 “3選2”原則
該方法由德國巴斯夫公司開發(fā),綜合了DPRA、KeratinoSensTM/LuSens 和h-CLAT 這3 種單一替代試驗方法[62],該方法覆蓋了AOP中至少兩個關(guān)鍵事件。其判定方式為:若3種試驗中有2種結(jié)果呈陽性,則判定受試物為致敏劑,反之則為非致敏劑。與單一試驗相比,該整合策略預(yù)測結(jié)果的準確率為81%~88%。
5.2 貝葉斯網(wǎng)絡(luò)整合測試策略
該方法由美國寶潔公司開發(fā),在涵蓋了DPRA、KeratinoSensTM和h-CLAT 這3 種單一替代方法的基礎(chǔ)上,增加了TIMES-SS基于受試物結(jié)構(gòu)的預(yù)測以及生物利用度等數(shù)據(jù)信息[63-64]。該方法主要應(yīng)用于致敏性及致敏效力的判斷。與LLNA 結(jié)果相比,致敏性判定的準確率為100%,致敏效力分級的準確率為89%。
5.3 堆疊元模型
該方法由法國歐萊雅公司開發(fā),在結(jié)合了覆蓋AOP的3個關(guān)鍵事件的DPRA法、KeratinoSensTM法和骨髓U937細胞皮膚致敏試驗(bone marrow U937 cell skin sensitization test,U-SENSTM)這3種單一替代方法的基礎(chǔ)上,又增加了兩種分析工具TIME-SS、Toxtree 以及受試物的理化性質(zhì),進而結(jié)合5 種不同的統(tǒng)計方法組合而成[65]。該模型的判定方式為:對5種不同統(tǒng)計方法給出的數(shù)據(jù)進行分析后,根據(jù)定義閾值判定受試物是否具有致敏性[66]。與單一試驗方法相比,該方法的準確性為93%。
5.4 人工神經(jīng)網(wǎng)絡(luò)分析法
該方法由日本資生堂公司開發(fā),覆蓋了AOP 關(guān)鍵事件1~3,同時綜合了受試物的理化性質(zhì)和計算機模擬參數(shù),構(gòu)成一個非線性統(tǒng)計模型[67]。該方法將DPRA 法、KeratinoSensTM法、ARE、h-CLAT 法和硫醇基蛋白反應(yīng)性測試作為單一元素,利用模型對單一元素的不同組合進行回歸分析,判定受試物的致敏性及致敏效力[68]。與LLNA 法相比,該模型的準確性為91%。
6 小結(jié)
隨著對皮膚致敏機制的深入研究,從LLNA 法到基于AOP 通路建立的替代試驗,以及基于體內(nèi)皮膚致敏過程所建立的整合策略已經(jīng)逐步建立,但目前我們所掌握的AOP 通路還只是很小的一部分,任何體內(nèi)外替代方法都無法完整模擬致敏后體內(nèi)的真實反應(yīng)。因此,建立皮膚致敏替代試驗仍然面臨著巨大的挑戰(zhàn),尋找能夠模擬出皮膚變態(tài)反應(yīng)整個過程或是關(guān)鍵步驟的替代方法將會是未來皮膚致敏替代方法研究的發(fā)展趨勢。另一方面,伴隨著基因組學(xué)皮膚致敏測試方法的開發(fā),相信不久的將來,皮膚致敏測試方法必將陸續(xù)迭代,檢測結(jié)果會更加靈敏、準確和快速。
[作者貢獻Author Contribution]
黃靜怡參與討論并確定主體框架,查找及篩選相關(guān)文獻,撰寫初稿并修改;李培寧參與討論并確定主體框架,查找及篩選相關(guān)文獻,參與文稿的修訂;劉香梅共同討論并確定文章主體框架,參與文稿修訂;劉忠華共同討論并確定文章主體框架,并對整體框架給予修改意見;黃宇鋒共同討論并確定文章主體框架,審核初稿并給予修改意見。
[利益聲明Declaration of Interest]
所有作者均聲明本文不存在利益沖突。

