四步法突破晶體密度的計算
周長旺
(山東省濟南市章丘區第五中學)
晶體密度的計算是高考“物質結構與性質”選考題的最后一問,題目難度較大.本文采用拆解模式,通過合理的分拆,設計成幾個較簡單的問題,以達到輕松解題的目的.
1 均攤法確定晶體的化學式
這類試題中,一般都給出晶體結構模型,可根據晶體結構模型確定晶體的分子式,確定的原則是:如果是平行六面體,位于頂點的原子有屬于該晶胞,位于棱上的原子有屬于該晶胞,位于面心上的原子有屬于該晶胞,位于體心的原子全部屬于該晶胞.
例1已知下列晶胞的模型,寫出晶胞的化學式.
(1)鐵的晶胞結構如圖1所示,鐵碳形成合金時,碳原子插入晶胞中每條棱的中點和晶胞的體心,該物質的化學式為_________.

圖1
(2)鎢碳形成耐高溫、耐磨材料碳化鎢,其晶胞結構如圖2所示,則碳化鎢的化學式為_________.

圖2
分析(1)鐵晶胞中,Fe原子位于晶胞的8個頂點和6個面心,晶胞中鐵原子個數為4,碳原子插入晶胞中每條棱的中點和晶胞的體心,則晶胞中碳原子個數為,該物質的化學式為FeC.(2)碳化鎢晶胞中,鎢原子個數為,6個碳原子全部屬于該晶胞,碳化鎢的化學式為WC.
點評該類試題解題的關鍵是,先準確判斷晶胞中各類原子分別有幾個,分別位于晶胞的什么位置,該晶胞占有多少個,然后再計算晶胞的化學式.題中第(2)小題是易錯點,圖2中有4種鎢原子,位于中心1 個,位于面心2 個,位于上下兩層頂點有12個,位于棱上有6個.頂點上有屬于該晶胞,棱上有屬于該晶胞,面心上有屬于該晶胞.
2 計算每個晶胞的質量
例2如圖3是Na2S形成的晶胞,則晶胞的質量為________(阿伏加德羅常數用NA表示).

圖3
分析由圖可知,有8 個Na+位于晶胞內,有8個S2-位于晶胞的頂點,有6個S2-位于面心,因此1個晶胞內S2-的個數為,故1個晶胞中含有8個Na+和4個S2-,晶胞質量

3 計算每個晶胞的體積
根據晶胞參數,可以計算晶胞的體積:V=S底×h高.有時還要注意單位換算:

例3氮化鎵為六方晶胞(如圖4),晶胞參數a=b≠c(單位:pm),a、b間夾角為120°,則晶胞的體積為________.

圖4
分析與數學上計算體積相同,體積

4 計算晶體的密度
例4氮化鉬應用前景廣泛.它屬于填隙式氮化物,N 原子部分填充在Mo原子立方晶格的八面體空隙中,晶胞結構如圖5所示,其中氮化鉬晶胞參數為anm,下列說法正確的是( ).

圖5
B.氮化鉬的化學式為MoN2
C.每個鉬原子周圍與其距離最近的鉬原子有12個
分析由晶胞圖示可知,位于棱心和體心上的N原子距離最近,為面對角線長度的選項A 錯誤.由晶胞結構示意圖可知,每個晶胞中含有Mo的個數為,含N 的個數為4×,故氮化鉬的化學式為Mo2N,選項B 錯誤.由晶胞結構示意圖可知,鉬原子位于8個頂點和6個面心上,故每個鉬原子周圍與其距離最近的鉬原子有12個,選項C正確.由選項B分析可知,該晶胞中含有4個Mo,2個N,則1個晶胞的質量為,1個晶胞的體積為(a×10-7cm)3,故晶體的密度ρ=,選項D 錯誤.答案為C.
例5一種四方結構的超導化合物的晶胞如圖6-甲所示,晶胞中Sm 和As原子的投影位置如圖6-乙所示.圖中F-和O2-共同占據晶胞的上下面位置,若兩者的比例依次用x和1-x代表,則該化合物的化學式為______,通過測定密度ρ和晶胞參數,可計算該物質x的值,完成它們的表達式:ρ=________g·cm-3.
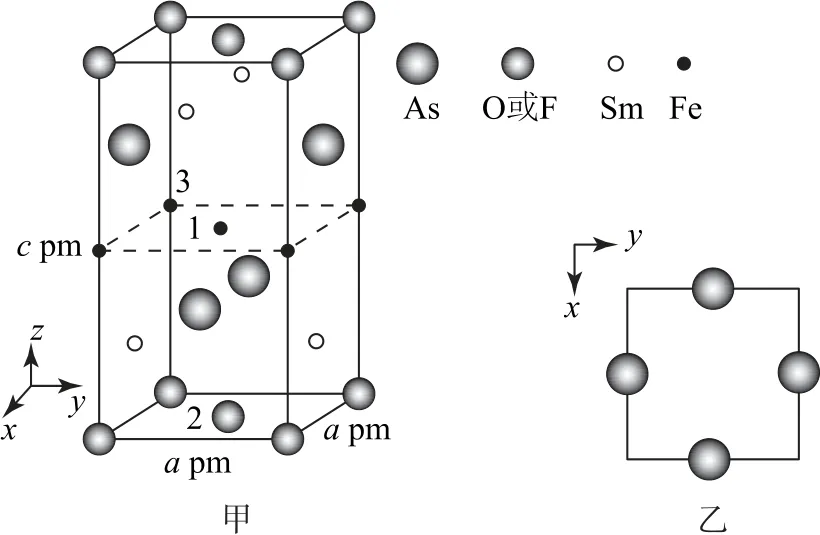
圖6
分析根據晶胞結構示意圖可知,晶胞中有4個Sm 位于面心,晶胞中Sm 原子的個數為,Fe位于晶胞的中心和棱上,晶胞中Fe原子的個數為1+,As原子位于4個面心,晶胞中As原子的個數為,O2-和F-的個數之和為2,F-的比例為x,O2-的比例為(1-x),故該化合物的化學式為SmFeAsO1-xFx,1個晶胞的質量為

1個晶胞的體積為V=a3×10-30cm3,則晶胞密度

總之,晶體密度的計算可按四步法進行,首先確定晶體的化學式,其次計算晶胞的質量和體積,最后根據密度計算公式求出晶體的密度.解題的關鍵是根據晶胞示意圖中各原子在晶胞中的位置,用均攤法計算出晶胞的化學式,再計算出晶胞的質量和體積,從而計算晶胞的密度.
(完)

