急性心肌梗死患者氧磷酶1 Q192R基因多態性與氯吡格雷抵抗的相關性
賈蔓箐, 王 洋, 蔡 靜, 劉 軍
(1. 新疆醫科大學第七附屬醫院 藥學部, 新疆 烏魯木齊, 830028;2. 新疆醫科大學第二附屬醫院 檢驗科, 新疆 烏魯木齊, 830028)
急性心肌梗死是臨床常見的心血管疾病, 其發病率、病死率呈逐年升高及日趨年輕化趨勢。經皮冠狀動脈介入術(PCI)是治療急性心肌梗死的有效方法,可顯著改善患者生活質量,延長生存時間[1]。雙聯抗血小板是急性心肌梗死患者術后的常規治療藥物,旨在預防術后血栓形成,降低心肌梗死復發率[2]。但部分急性心肌梗死患者存在氯吡格雷抵抗現象,發生率為11%~44%,使抗血小板治療效果欠佳[3]。因此,了解氯吡格雷抵抗相關因素,可為下一步臨床治療提供參考依據。目前,氯吡格雷抵抗主要集中于對CYP2C19基因單核苷酸多態性(SNP)的研究,且有研究[4]指出該基因多態性可影響體內氯吡格雷的代謝速度,CYP2C192和CYP2C193屬失功能等位基因,該位點基因突變會致氯吡格雷抵抗。但臨床對于氧磷酶1基因(PON1)缺乏系統性的研究。PON1是氯吡格雷發揮抗血小板聚集的關鍵酶之一,直接參與氯吡格雷活性代謝物的形成速度。因此,本研究探討PON1Q192R基因多態性與氯吡格雷抵抗性之間的相關性,為抗血小板藥物治療實踐提供參考,現報告如下。
1 資料與方法
1.1 一般資料
選取2019年1月—2021年3月收治的135例急性心肌梗死患者為研究對象。男88例,女47例; 年齡45~85歲,平均(65.58±4.15)歲; 體質量指數(BMI)20~38 kg/m2, 平均(27.14±2.51) kg/m2。納入標準: 經心肌酶學、心電圖、冠狀動脈造影等綜合檢查,與急性心肌梗死診斷標準相符[5]者; 均在院采用PCI治療者; 經檢查無氯吡格雷、阿司匹林禁忌證者; 病情穩定,服用藥物期間無心前區疼痛者; 對本研究知情并簽署同意書者。排除標準: 近期有活動性潰瘍、消化道出血、惡性腫瘤者; 有嚴重貧血、血小板計數異常者; 合并免疫系統疾病、血液系統疾病者; 有靜脈血栓史、持續性心房顫動、華法林長期使用史患者; 服用可能影響氯吡格雷藥效者。本研究通過醫院醫學倫理委員會審核。
1.2 方法
1.2.1 用藥方法: 所有患者術前24 h服用硫酸氫氯吡格雷片[賽諾菲(杭州)制藥有限公司,國藥準字H20056410]300 mg/次,阿司匹林(南京制藥廠有限公司,國藥準字H32024219) 300 mg/次; 術后更改劑量為氯吡格雷75 mg/次,阿司匹林100 mg/次; 術后在院均連續服用5 d; 出院后持續服用氯吡格雷75 mg/次,阿司匹林100 mg/次,連續12個月。
1.2.2 血小板聚集率檢測: 在標準用藥第5 天時,采集患者晨起用藥2.5 h的肘靜脈血3 mL, 置入含有3.8%枸櫞酸鈉抗凝管內,充分混勻。先離心5 min, 4 000轉/min, 獲取富含血小板的血漿,吸取余下血樣,高速離心15 min, 22 500轉/min, 獲得貧血小板血漿(PPP)。將獲得的PPP與富含血小板血漿混合,稀釋至2×105μmol/L, 置入6 μmol/L二磷酸腺苷(ADP)促使血小板聚集,以此測定血小板聚集率。按血小板聚集率高低分為2組,即抵抗組(聚集率>50%)、敏感組(≤50%)[6]。
1.2.3 資料分析: 調查入組患者的病歷資料,分析患者年齡、性別、BMI、吸煙史、合并癥(高血壓、糖尿病、高脂血癥)。實驗室檢查: 尿酸、低密度脂蛋白膽固醇與高密度脂蛋白膽固醇、同型半胱氨酸(Hcy)等。
1.2.4 基因多態性檢測:PON1Q192R基因多態性檢測采用原位雜交技術,采集所有患者全血200 μL, 置入2 mL離心管,管內置入1%氯化銨1 mL, 混合均勻,靜置5 min。DNA分離試劑盒提取基因組DNA, 使用TaqMan探針實時熒光聚合酶鏈反應檢測PON1基因,并進行PON1基因分型。嚴格按照說明書進行聚合酶鏈反應(PCR)擴增,將擴增產物與固定基因探針的基因芯片進行特異性雜交,采用酶促顯色反應。
PON1Q192R基因編碼區序列第192位點的氨基酸谷氨酰胺殘基(Glu)可突變成精氨酸R殘基(Arg), 故PON1有3種基因型:192QQ、192QR、192RR。若未發生基因突變的基因型為野生型(192QQ), 發生基因突變的基因型為突變型(QR+RR)。
1.3 觀察指標
比較氯吡格雷抵抗組、敏感組患者PON1Q192R基因分布情況: 包括野生型、SNP雜合子型及SNP純合子型; 比較PON1Q192R基因野生型、突變型的ADP血小板聚集率; 比較PON1Q192R基因野生型、突變型患者臨床資料: 年齡、性別、BMI、合并癥、合并用藥情況。
1.4 預后結局
本研究ACS患者出院后均隨訪1年,隨訪間隔2月,隨訪方式采用門診隨訪,記錄患者隨訪期間發生主要心血管不良事件(MACE)類型及時間。本研究設定MACE為心源性死亡、非致命性再次心肌梗死、嚴重心力衰竭、室顫以及惡性室性心動過速等。
1.5 統計學分析
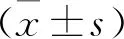
2 結 果
2.1 2組者PON1 Q192R基因分布情況
135例急性心肌梗死患者經血小板聚集測定,敏感組103例(76.30%), 抵抗組32例(23.70%)。氯吡格雷抵抗組患者PON1Q192R基因分布SNP雜合子型、SNP純合子型發生率高于敏感組,差異有統計學意義(P<0.05)。見表1。

表1 2組患者PON1 Q192R基因分布情況[n(%)]
2.2 PON1 Q192R基因野生型、突變型的ADP血小板聚集率及基本資料
PON1Q192R基因野生型的ADP血小板聚集率、MACE發生率低于突變型,差異有統計學意義(P<0.05)。見表2。

表2 PON1 Q192R基因野生型、突變型的ADP血小板聚集率及基本資料
2.3 2組術后1年終點事件發生情況
抵抗組術后1年終點事件發生率為25.00%, 高于敏感組的1.94%, 差異有統計學意義(P<0.05)。見表3。

表3 2組術后1年終點事件發生情況[n(%)]
2.4 相關性分析
Pearson線性相關性分析顯示,PON1Q192R基因SNP雜合子型、SNP純合子型與氯吡格雷抵抗的發生顯著相關(r=0.841, 0.863;P=0.012, 0.010)。
2.5 影響急性心肌梗死患者氯吡格雷抵抗的多元Logistic多因素分析
多元Logistic多因素分析顯示,PON1Q192R基因突變、ADP血小板聚集率是急性心肌梗死患者發生MACE的危險因素(P<0.05)。見表4。

表4 急性心肌梗死患者發生MACE的單因素Logistic回歸分析
3 討 論
急診PCI是急性心肌梗死的主要治療方法,患者術后需要雙重抗血小板聚集藥物治療,但臨床發現,部分患者即便按時、按量、按療程進行抗血小板治療,仍會發生支架內血栓、支架內狹窄等嚴重并發癥,嚴重影響預后。影響患者PCI術后生存質量的主要原因是血小板抵抗,其中臨床最常使用的抑制血小板聚集藥物氯吡格雷抵抗是影響患者術后生存質量的主要原因[7]。本研究發現,抵抗組術后1年終點事件發生率顯著高于敏感組(P<0.05), 表明當患者出現氯吡格雷抵抗后,心血管不良事件發生率顯著提高。本研究顯示, 135例急性心肌梗死患者經血小板聚集測定,敏感組103例(76.30%), 抵抗組32例(23.70%)。王焱等[8]研究表明,非致殘性缺血性腦血管事件患者氯吡格雷抵抗占20.60%。楊禹娟等[9]調查發現,冠心病患者PCI術后氯吡格雷抵抗發生率為24.00%。故氯吡格雷抵抗是抗血小板治療患者常見問題,有效分析影響氯吡格雷抵抗的相關因素,可為臨床治療提供參考。
PON1 是一種糖蛋白,主要由肝臟合成,廣泛分布在肝、腎、腦等臟器當中[10]。氯吡格雷在肝臟進行代謝時,PON1是促進其第2步代謝時的主要因子,影響氯吡格雷轉化為具備活性的硫醇終產物,并決定氯吡格雷活性產物的生成速度[11-12]。因此,研究PON1Q192R基因多態性是否能影響氯吡格雷抵抗具有重要意義。本研究中,氯吡格雷抵抗組患者PON1Q192R基因分布SNP雜合子型、SNP純合子型發生率顯著高于敏感組(P<0.05);PON1Q192R基因野生型的ADP血小板聚集率顯著低于突變型(P<0.05);PON1Q192R基因SNP雜合子型、SNP純合子型與氯吡格雷抵抗的發生顯著相關;PON1Q192R基因突變與ADP血小板聚集率是急性心肌梗死患者氯吡格雷抵抗的危險因素,上述結果表明研究分析PON1Q192R基因SNP,對預測氯吡格雷抵抗有重要意義。石蕊等[13]研究指出,PON1Q192R基因多態性可能是腦梗死患者3個月和12個月內梗死復發的遺傳易感因素。戴玉洋等[14]研究表明,PON1基因型組間血小板聚集率、氯吡格雷抵抗發生率并無差異,但其是影響急性冠狀動脈綜合征患者氯吡格雷抵抗的主要因素。多項研究表明,通過檢測PON1Q192R基因多態性,可有效評價氯吡格雷抵抗性。分析原因可能是PON1是影響氯吡格雷活化的限速酶,若PON1Q192R基因突變,會影響PON1酶活性,使氯吡格雷活化率受到干擾,進而導致氯吡格雷抵抗性[15]。研究發現,PON1Q192R基因SNP患者ADP血小板聚集率水平較高,可能是PON1Q192R基因突變導致氯吡格雷抵抗的原因之一,但具體機制仍需進一步研究。
綜上所述,急性心肌梗死患者PON1Q192R基因多態性與氯吡格雷抵抗相關性較高。PON1Q192R基因突變會誘發氯吡格雷抵抗,此時分析PON1Q192R基因突變對預測氯吡格雷抵抗有重要意義。但當基因為野生純合型時,無法判斷患者是否存在氯吡格雷抵抗,高齡、性別等因素也會相應造成氯吡格雷治療無效。本研究尚有不足,氯吡格雷在體內代謝過程受多基因影響,且氯吡格雷抵抗受其他非遺傳因素影響,故需擴大研究,以為臨床治療提供參考。

