葉類蔬菜中單核細胞增生李斯特氏菌PCR快速檢測方法的建立
李曉然 張若鴻 王 純 尹樹仁 王曉芳 楊 洋,* 崔生輝 郭云昌
(1 河北科技師范學院食品科技學院,河北 秦皇島 066600;2 中國食品藥品檢定研究院,北京 100050;3 國家食品安全風險評估中心,北京 100022)
葉類蔬菜富含膳食纖維、維生素和礦物質,有益于人體健康。然而,隨著葉類蔬菜消費量的增加,相關食源性致病菌引發的食源性疾病暴發也隨之增加,對公共健康造成了嚴重危害[1-2]。單核細胞增生李斯特氏菌(Listeriamonocytogenes)是一種常見的侵襲性食源性致病細菌。人體被該菌感染后易引發敗血癥和腦膜炎等侵襲性疾病,病死率較高(20%~30%)[3-4]。目前國外葉類蔬菜中該菌引發的李斯特菌病暴發數量逐漸攀升,國內也存在散發事件,且該趨勢仍在持續[5-6],因此急需建立一種快速可靠的單核細胞增生李斯特氏菌檢測方法,以確保葉類蔬菜的質量安全,為公共衛生安全提供保障。
傳統的基于細菌培養的檢測方法被認為是“金標準”,可靠準確但耗時耗力(5~7 d)[7]。為克服傳統方法的局限性,目前已開發多種食源性致病菌快速檢測方法,其中酶聯免疫吸附測定(enzyme-linked immunosorbent assay,ELISA)技術雖操作簡便,但需目標菌與抗體進行有效的物理接觸(靈敏度較低),且易受免疫原性的干擾[8]。光學/電化學生物傳感器和基因芯片技術具有高通量優勢,但檢測成本昂貴,對設備和操作人員技能要求較高[9-10]。聚合酶鏈式反應(polymerase chain reaction,PCR)雖已成為食源性致病菌檢測發展最成熟的技術[11],但PCR方法通常需要樣品前增菌處理來抑制背景微生物生長,也以提高檢測精確度。研究發現,葉類蔬菜基質中存在多個PCR反應抑制因子,如多糖、酚類化合物和葉綠素等[12-13]。β-環糊精(β-cyclodextrin,β-CD)是由7個葡萄糖單體連接成的中空截短圓錐形結構的葡萄糖低聚物,其分子內部疏水,外部親水[14]。葉類蔬菜表面的PCR抑制因子如蠟質物(疏水性化合物)可被捕獲到其內部,使存在于疏水性基質中的細菌被分離到水相中[2]。活性炭是一種具有極強吸附能力、較大表面積的多孔物質[12]。有研究表明,表面未包被的活性炭可吸附細菌細胞和PCR抑制因子,而牛乳蛋白包被的活性炭不會與細菌細胞結合,并保留大部分吸附能力(吸附PCR抑制因子)[12]。此外,iap基因(編碼單核細胞增生李斯特氏菌的侵襲性相關蛋白)在整個菌種中具有高度保守性,并且是PCR方法中常用目標基因之一[15-16]。而一些研究人員提出的目標基因在一些菌株中存在缺失/突變現象,如LIPI-1的prfA、mpl和LIPI-2的inlA[3,17]。因此,本研究利用β-CD和牛乳蛋白包被活性炭對樣品進行前處理,以消除葉類蔬菜中的PCR抑制因子,并使用基于iap基因的引物,旨在開發一種快速、靈敏、無需前增菌的單核細胞增生李斯特氏菌PCR檢測方法,為葉類蔬菜的質量安全提供有力保障,并為進一步預防食源性李斯特氏菌病暴發、提升我國食源性疾病預警效率做出貢獻。
1 材料與方法
1.1 試驗菌株
本研究所用菌株共計141株(表1),來自美國模式菌種保藏中心(American Type Culture Collection,ATCC)。以無菌操作,用無菌棉簽從平板上取本研究所用菌株的新鮮純培養菌落,轉移到含腦心浸液(brain heart infusion,BHI)肉湯和20%甘油的冷凍儲藏管中,混勻,儲存在-80℃的冰箱中。
菌株培養:將李斯特氏菌菌株接種在BHI瓊脂培養基中培養(18 h,37℃);微需氧條件(5%氧氣)下,將結腸彎曲菌和空腸彎曲菌菌株接種在Bolton肉湯中培養(24 h,42℃);副溶血性弧菌菌株接種在含有3% NaCl的Luria-Bertani培養基中生長(18 h,37℃);其他菌株接種到Luria-Bertani培養基上生長(18 h,37℃)。
1.2 主要試劑與儀器
BHI肉湯、BHI瓊脂、Bolton肉湯、李氏增菌肉湯(Listeriaenrichment broth,LB)、PALCAM培養基、科瑪嘉李斯特菌顯色培養基、TSA-YE培養基、革蘭氏染色試劑盒、單核細胞增生李斯特氏菌生化鑒定試劑盒,北京陸橋技術股份有限公司;Luria-Bertani培養基,上海君瑞生物技術有限公司;β-CD,河北科隆多生物科技有限公司;嬰幼兒脫脂乳粉,黑龍江飛鶴乳業有限公司;無水乙醇、氫氧化鈉、乙酸、乙酸鈉,上海阿拉丁生化科技股份有限公司;牛血清白蛋白、鮭魚精DNA、10×PCR buffer、dNTPs mix(1 mmol·L-1)、基于iap基因和prfA基因的引物、TaqDNA聚合酶(5 U·μL-1)、TaqPCR Premix、100 bp DNA Ladder,寶生物工程(大連)有限公司;瓊脂糖、0.5×三硼酸乙二胺四乙酸(Tris/Borate/EDTA,TBE)緩沖液,上海尚寶生物科技有限公司。
Bagmixer-400W均質器,法國Interscience公司;HYC-326A醫用低溫冰箱,青島海爾特種電器有限公司;X3R高速離心機,美國Thermo公司;DF-101 S磁力攪拌器,青島聚創環保集團有限公司;JUPT-III-10超純水發生器,廣州罡然機電設備有限公司;Personal Cycler PCR擴增儀,德國Biometra公司;DYY-11電泳儀,北京市六一儀器廠;Biospectrum 310凝膠成像系統,美國UVP公司。
1.3 試驗方法
1.3.1 人工污染葉類蔬菜樣品 葉類蔬菜(菠菜、生菜、油麥菜、油菜和大白菜)在被目標菌人工污染前于2℃保存24 h。然后修剪蔬菜以去除老化、受損的葉子。按1.1節,BHI培養單核細胞增生李斯特氏菌菌株ATCC 19111(18 h,37℃),使用無菌生理鹽水將新鮮培養物10倍系列稀釋(100~108)。按《GB 4789.30-2016食品安全國家標準食品微生物學檢驗: 單核細胞增生李斯特氏菌檢驗》[18]中的平板計數法,對稀釋的菌懸液進行計數,以獲取所需目標菌濃度(100~105CFU·mL-1)的菌懸液。在生物安全柜中分別將不同濃度的菌懸液均勻地接種在菠菜葉的正面與背面,每面滴20滴,每滴10 μL(其他葉類蔬菜的操作步驟相同)。接種完的菠菜鼓風干燥30 min,使液滴蒸發/吸附到菠菜葉表面。然后將其放入無菌未封口的塑料袋中(允許氣體交換),保存在冰箱中(4℃過夜),確保目標菌有效附著在樣品上。未接種目標菌的菠菜作為陰性對照。第二天,按標準GB 4789.30-2016[18]對樣品進行計數,以確定目標菌濃度。將75 mL無菌生理鹽水倒入有25 g菠菜葉(100~104CFU·25g-1)的均質袋中,230 r·min-1均質2 min。均質后樣品用于靈敏度測試的樣品前處理。
1.3.2 牛乳蛋白包被活性炭的制備 取嬰幼兒脫脂乳粉(24.00、12.00、6.00、3.00、1.50、0.75、0.38 g)分別倒入盛有25 mL超純水的400 mL燒杯中,磁力攪拌器中速攪拌至乳粉完全溶解(約2 min)。向每個燒杯中倒入50 mL 95%乙醇,中速磁力攪拌(2 min)以沉淀牛乳蛋白。將沉淀的每個牛乳蛋白轉移至250 mL離心瓶中,室溫(20~25℃)下離心(5 000 r·min-1)5 min。離心所得沉淀重懸于150 mL超純水中,用0.1 mol·L-1氫氧化鈉(sodium hydroxide,NaOH)調節pH值至9.0。
用篩子過篩活性炭(0.85~2.0 mm顆粒)。超純水洗滌200 g活性炭3次,以除去雜質,并于55℃條件下干燥。分別將之前制備好的不同濃度牛乳蛋白液倒入燒杯,然后將44 g干燥的活性炭倒入其中。將燒杯置于恒溫振蕩培養箱中,37℃、150 r·min-1振蕩2 h。傾倒上清液,用超純水輕輕漂洗底層活性炭3次,以除去未結合的牛乳蛋白。將燒杯置于55℃培養箱中,直至牛乳蛋白包被活性炭完全干燥,以備用。
1.3.3 β-CD溶液處理樣品 將8 g β-CD倒入有100 mL去離子水的500 mL無菌燒瓶中,攪拌加熱直至β-CD完全溶解。使用前,將制備好的8% β-CD溶液冷卻至55℃。為去除樣品中的疏水性化合物(葉類蔬菜表面蠟質物),將8% β-CD溶液(100 mL)倒入各種樣品(菠菜、生菜、油麥菜、油菜和大白菜)勻漿中,并使β-CD的最終濃度為5 g·100 mL-1。均質勻漿(230 r·min-1,2 min,37℃),隨后將其轉至250 mL離心瓶中,1 000 r·min-1離心5 min,以沉積大顆粒蔬菜組織和大多數β-CD復合物。所得上清液于10 000 r·min-1條件下離心10 min,所得沉淀重懸于30 mL 0.01 mol·L-1乙酸生理鹽水緩沖液(0.85%氯化鈉、乙酸、乙酸鈉,pH值 5.0)中,用于牛乳蛋白包被活性炭處理。
1.3.4 牛乳蛋白包被活性炭處理樣品 取1.3.2節制備好的4.6 g牛乳蛋白包被活性炭倒入燒杯中,用20 mL無菌生理鹽水清洗兩次,將其與之前β-CD溶液處理過的30 mL樣品勻漿混合。混合物在室溫下,160 r·min-1振蕩15 min。將0.2 g無菌玻璃棉填入到50 mL無菌塑料注射器底部,上述混合物轉至注射器內,用乙酸生理鹽水緩沖液清洗,直至無菌離心管中收集到30 mL洗脫液。洗脫液于10 000 r·min-1條件下離心10 min,以沉淀細菌細胞,棄上清液保留沉淀,用于模板DNA制備。
1.3.5 模板DNA制備 將含細菌細胞的沉淀物重懸于總混合體系0.5 mL的離心管中,該混合體系包含50 μL(5 mg·mL-1)牛血清白蛋白(bovine serum albumin,BSA)、50 μL(0.05 mg·mL-1)鮭魚精脫氧核糖核酸(deoxyribonucleic acid,DNA)和300 μL超純水。將離心管沸水浴10 min,以裂解細菌細胞。裂解液在冰上冷卻至室溫,離心(12 000 r·min-1,5 min)。上清液小心轉移至新的無菌離心管中,加入等體積冷卻的無水乙醇以沉淀DNA,離心(12 000 r·min-1,15 min)。棄上清液,然后加100 μL無菌去離子水溶解沉淀的DNA。DNA樣品分裝,每份10 μL,用于PCR檢測。
1.3.6 PCR反應體系的建立 本方法使用的基于目標菌iap基因的特異性引物(序列01:5′-A C A A G C T G C A C C T G T T G C AG-3′,02:5′-T G A C A G C G T G T G T A G T A G CA-3′),由寶生物工程(大連)有限公司合成,目標擴增產物為131 bp。已發表的基于目標菌prfA基因的引物(01:5′-C C C A A G T A G C A G G A C A T G C T AA-3′,02:5′-G G T A T C A C A A A G C T C A C G AG-3′)作為對照[19]。
基于iap基因引物的50 μL PCR反應體系包含:10×PCR buffer 5 μL、1 mmol·L-1脫氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)mix 4 μL、40 μmol·L-1正反向引物各0.5 μL、5 U·μL-1TaqDNA聚合酶0.25 μL、模板DNA 1 μL、無菌超純水38.75 μL。基于prfA基因引物的50 μL PCR反應體系包含:TaqPCR Premix 25 μL、20 μmol·L-1正反向引物各1 μL、模板DNA 1 μL、超純水22 μL。PCR反應條件:94℃預變性4 min;94℃變性1 min,55℃退火1 min,72℃延伸1 min,循環30次(基于prfA基因的引物循環25次);72℃終延伸7 min(基于prfA基因的引物終延伸6 min)。凝膠電泳前,將樣品于4℃保存。所有PCR試驗都有無菌超純水代替模板DNA的陰性對照。目標菌菌株ATCC 19111的純培養物菌懸液(1 μL,104CFU·mL-1)作為陽性對照。所得PCR產物在0.5×TBE緩沖液體系中的2%瓊脂糖凝膠上,恒壓100 V電泳1 h,然后用凝膠成像系統觀察結果。
1.3.7 引物特異性測試 141株細菌菌株包括78株單核細胞增生李斯特氏菌、29株其他李斯特氏菌、34株非李斯特氏菌(其他常見致病菌)。菌株按1.1節進行培養,所得新鮮培養物按1.3.5節方法制備模板DNA。然后分別用包含iap和prfA引物的PCR反應體系(1.3.6)對模板DNA進行檢測。通過檢驗引物在這些菌株中辨別目標菌與非目標菌的能力,從而驗證特異性。
1.3.8 方法靈敏度測試 為確定本方法在人工染菌葉類蔬菜中的靈敏度,將目標菌株ATCC 19111的10倍系列稀釋液人工污染每25 g菠菜葉,以獲取所需目標菌濃度的菠菜葉樣品(100~104CFU·25g-1),其他葉類蔬菜按1.3.1進行相同的操作。所得樣品均質液按本方法進行樣品前處理,按1.3.5制備模板DNA,每1 μL模板DNA懸液用于PCR。隨后PCR產物進行凝膠電泳,凝膠成像系統觀察結果,以確定檢測限。每個包含獨立制備樣品(染菌濃度100~104CFU·25 g-1的每種葉類蔬菜)的試驗重復10次。
1.3.9 方法實用性測試 為評估本方法的實用性,對蔬菜種植基地采集的2 500份葉類蔬菜樣品(新鮮菠菜、生菜、油麥菜、油菜和大白菜各500份)中的目標菌進行檢測。同時使用標準GB 4789.30-2016[18]做檢測對比。
1.3.10 方法所用主要試劑的測試 為確定本方法所用主要試劑的穩定性(保質期),對本方法的靈敏度和實用性進行評估。試劑[0.1 mol·L-1NaOH、0.01 mol·L-1乙酸生理鹽水緩沖液、8% β-CD溶液、牛乳蛋白包被活性炭、BSA(5 mg·mL-1)、鮭魚精DNA(0.05 mg·mL-1)、40 μmol·L-1正向引物和反向引物(基于iap基因)、TaqDNA聚合酶(5 U·μL-1)]在測試前均置于-20℃冰箱。分別用保存了3、6、12個月的試劑,按本方法對人工染菌葉類蔬菜樣品(菠菜、生菜、油麥菜、油菜和大白菜)進行檢測,以確定本方法的靈敏度。不同人工染菌濃度(100~104CFU·25g-1)的每種蔬菜樣品試驗重復5次。為評估本方法的實用性,分別按本方法(分別使用保存了3、6、12個月的試劑)和標準GB 4789.30-2016[18]對蔬菜種植基地采集的樣品(5種葉類蔬菜,各300份)進行目標菌檢測。
2 結果與分析
2.1 本方法的特異性
由表1可知,基于prfA基因的引物對6株目標菌株(NCT 0890、ATCC 7645、ATCC BAA-348、ATCC 51781、ATCC BAA-2657和ATCC 19115 D-5)的檢測出現了假陰性結果、對2株非目標菌菌株(伊氏李斯特氏菌ATCC 700402、伊氏李斯特氏菌BAA-753)的檢測出現了假陽性結果。相比之下,本方法使用的基于iap基因的引物能夠正確識別所有菌株,未出現假陽性或假陰性結果,并且在這些菌種中未檢測到非特異性擴增子。因此本方法的iap引物序列對單核細胞增生李斯特氏菌的檢測具有良好的特異性,PCR檢測的特異性為100%。

表1(續)
2.2 本方法的靈敏度
根據試驗條件優化結果,1.5 g乳粉所得牛乳蛋白包被44 g活性炭(表面包被的牛乳蛋白最多為0.45±0.08 g)處理樣品的效果最好。由圖1可知,當樣品人工染菌濃度為101CFU·25g-1時,可見清晰條帶(陽性結果),PCR擴增產物為131 bp,與預期結果相同。由表2可知,用本方法可檢測到101CFU·25g-1樣品中的目標菌,且在染菌濃度高于101CFU·25g-1的樣品中也獲得了相同的陽性結果。因此,本檢測方法的檢測限為101CFU·25g-1。

注:泳道1:100 bp DNA Ladder;泳道2:使用單核細胞增生李斯特氏菌ATCC 19111的 PCR陽性對照;泳道3:不含目標DNA的PCR陰性對照;泳道4~15:從人工染菌樣品(101 CFU·25g-1)中擴增出的PCR產物;泳道4~6:菠菜樣品;泳道7~8:生菜樣品;泳道9~10:油菜樣品; 泳道11~12:大白菜樣品;泳道13~15:油麥菜樣品。Note: Lane 1: 100 bp DNA Ladder. Lane 2: A PCR positive control that used L. monocytogenes ATCC 19111. Lane 3: A PCR negative control without target DNA. Lanes 4~15: PCR products amplified from 101 CFU·25g-1 of artificially contaminated samples. Lanes 4~6: Spinach samples. Lanes 7~8: Lettuce samples. Lanes 9~10: Cole samples. Lanes 11~12: Cabbage samples. Lanes 13~15: Lactuca sativa L. samples.圖1 人工染菌樣品(101 CFU·25g-1)的PCR擴增產物Fig.1 PCR amplification products of artificially contaminated samples (101 CFU·25g-1)
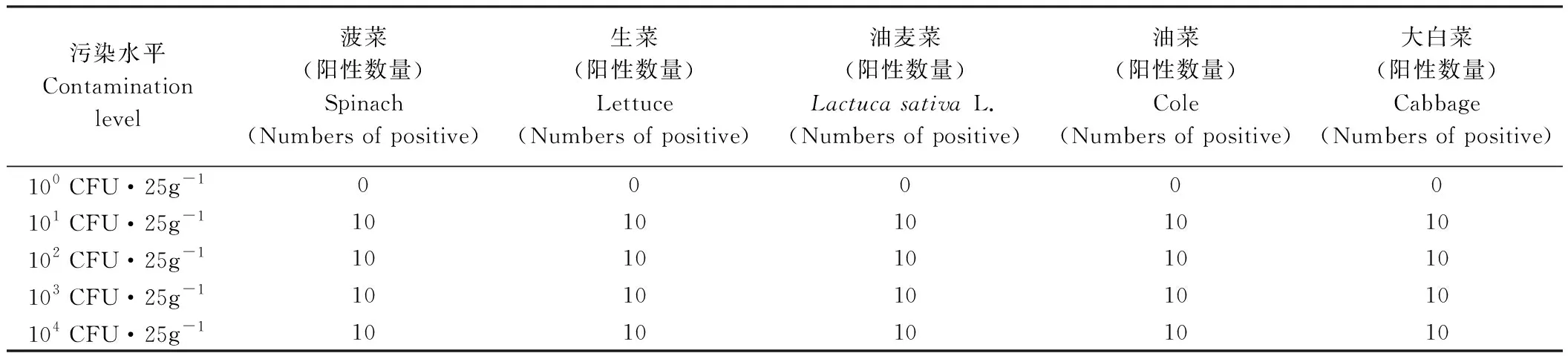
表2 用于檢測人工染菌葉類蔬菜中單核細胞增生李斯特氏菌的所建立方法的靈敏度Table 2 The sensitivity of developed method used for the detection of L. monocytogenes in artificially contaminated leafy greens
2.3 本方法的實用性
由表3可知,本方法和國標法(GB 4789.30-2016)[18]中菠菜、生菜、油菜的檢出率均分別為5%、3%、1%,其他葉類蔬菜中未檢測到目標菌;菠菜、生菜、油菜中活菌檢測率為100%,而其他種葉類蔬菜均為0%;兩種方法檢測結果的符合率為100%;與GB 4789.30-2016檢測時間(6 d)相比,本快速檢測方法僅用時4 h。綜上,本方法能夠準確地從葉類蔬菜中檢測出目標菌(未出現假陽性/假陰性結果),可作為檢測葉類蔬菜中單核細胞增生李斯特氏菌污染的快速可靠方法。
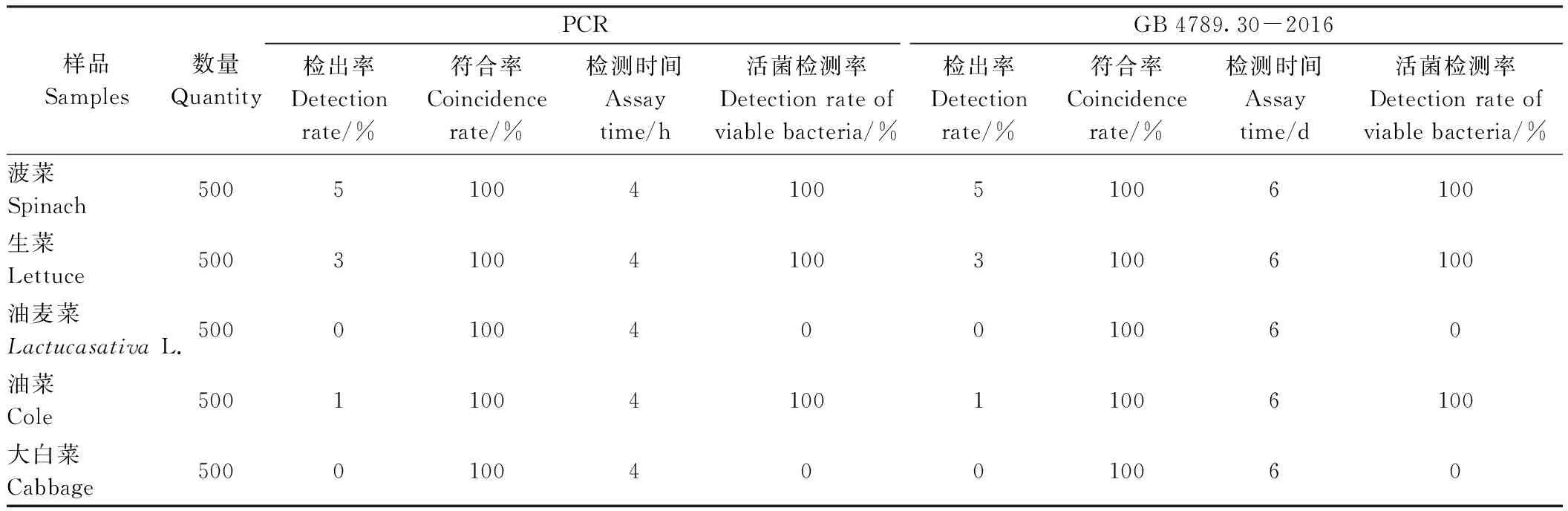
表3 本方法和常規培養方法對實際葉類蔬菜中單核細胞增生李斯特氏菌的檢測Table 3 The detection of L. monocytogenes in natural leafy greens using the developed method and conventional culture method
2.4 本方法所用主要試劑的穩定性
分別用-20℃保存了3、6、12個月的試劑,按本方法檢測染菌濃度101CFU·25g-1以下的葉類蔬菜樣品后,均未檢出目標菌;而分別用-20℃保存了3、6、12個月的試劑,按本方法檢測染菌濃度101CFU·25g-1及以上的樣品后,均檢出目標菌,表明本方法的檢測限仍為10 CFU·25g-1。
在試劑不同保存條件下,本試驗建立的快速檢測方法和國標法對實際葉類蔬菜樣品的檢測結果見表4。結果表明,使用保存了3、6、12個月的試劑,兩種方法的目標菌檢出率、活體菌檢測率均一致(符合率100%),表明本方法所用主要試劑在規定保存條件、保存時間內使用,靈敏度和實用性穩定;試劑可在-20℃保存至少12個月后正常使用,在冷凍條件下具有良好的穩定性。
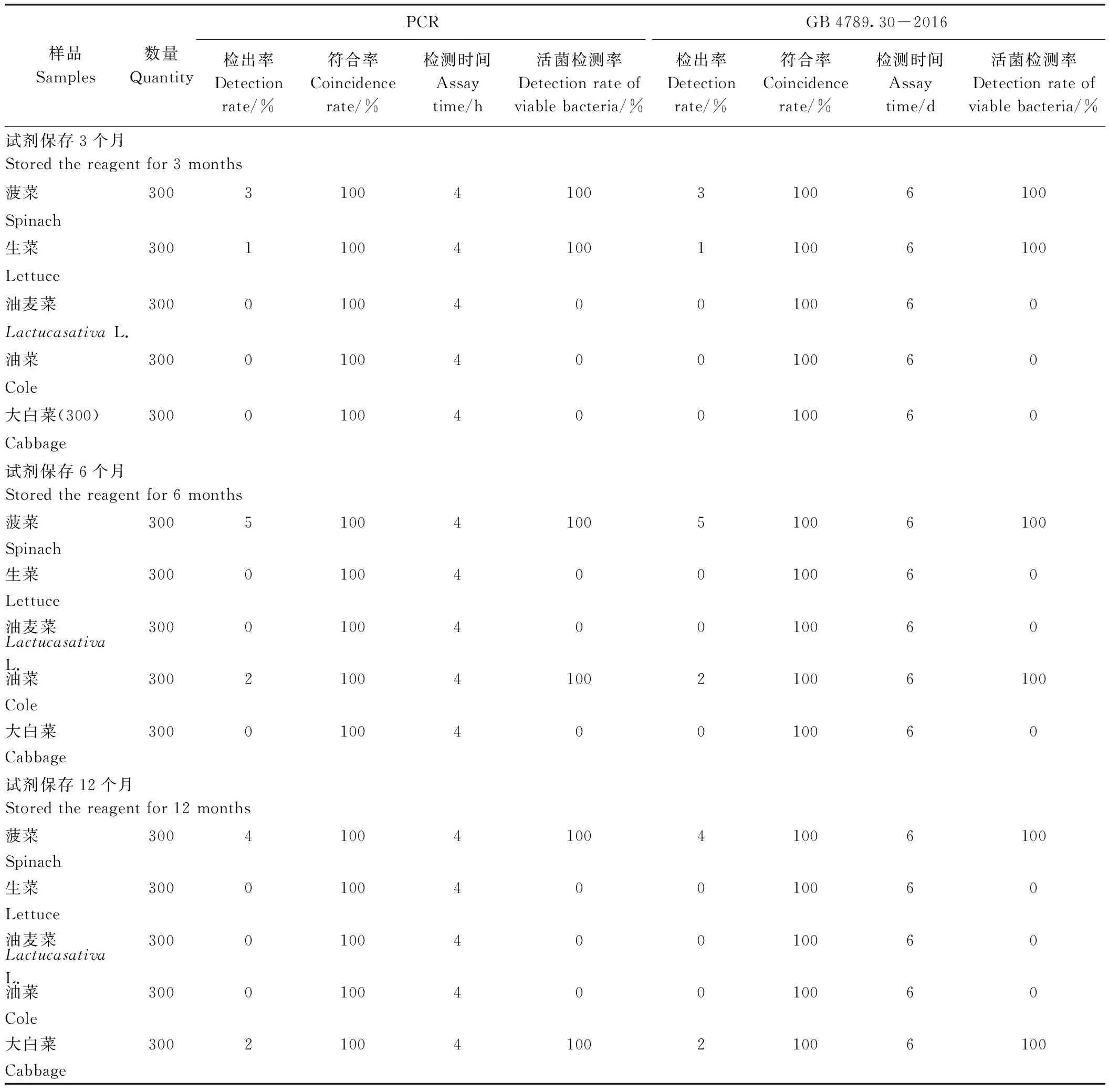
表4 本方法的試劑穩定性測試(實用性)Table 4 Reagent stability assay of the developed method (application)
3 討論
食源性致病菌檢測是評估葉類蔬菜微生物質量安全的重要舉措之一,可為消費者健康提供切實保障。其中PCR已成功用于單核細胞增生李斯特氏菌的檢測,是一種高效便利的分子方法[11]。然而,因樣品中存在許多PCR抑制因子,會抑制目標DNA的特異性擴增并降低檢測靈敏度[12,15]。因此,本研究基于β-CD和牛乳蛋白包被活性炭的樣品前處理(可消除PCR抑制因子),建立無需前增菌的PCR快速檢測方法具有重要意義。
綜合比較前人的單核細胞增生李斯特氏菌檢測方法研究[15-16],本方法中PCR的目標基因iap在目標菌種中具有高度保守性。而一些研究人員提出的目標基因(prfA、mpl、hlyA、inlA)在該菌一些菌株中存在缺失/突變現象,并且一些親緣較近的非李斯特氏菌(金黃色葡萄球菌、蠟樣芽孢桿菌等)中存在李斯特氏菌毒力基因同源物,可能會導致假陰性或假陽性結果[3,17]。此外,特異性測試需要充足數量的菌株來支撐,且應包含目標菌與其他相關菌種。盡管目前許多PCR方法中使用的引物特異性為100%,但其中一些研究僅用有限數量的標準菌株(4~33株)進行測試[13,20-21]。相比之下,本方法的iap引物序列測試的菌株多達141株(78株目標菌、63株非目標菌),特異性結果更準確、更有說服力。
因葉類蔬菜基質中存在多種會影響樣品中目標菌回收并降低靈敏度的物質[12],提高檢測方法的靈敏度是艱巨的挑戰之一。本方法樣品前處理中用到的牛乳蛋白包被活性炭可吸附葉類蔬菜中的葉綠素、酚類化合物、多糖等PCR抑制因子;而β-CD可捕獲蔬菜表面蠟質物(疏水化合物),使葉表面的細菌細胞易被分離到水相中,以便目標菌回收。本方法可實現濃度低至10 CFU·25g-1的單核細胞增生李斯特氏菌超靈敏檢測,且檢測時間縮至4 h(無需前增菌)。與其他基于各種樣品前處理的PCR方法相比,本方法檢測限具有明顯優勢。如用于克服PCR抑制的前增菌步驟雖盡可能避免了假陰性結果,但耗時較長(12~18 h),且由于葉類蔬菜中單核細胞增生李斯特氏菌的含量通常較低,有時增菌后也未能檢出該菌[13,22]。近年來,過濾和免疫磁性分離(immunomagnetic separation,IMS)常用于PCR方法中的前處理,可濃縮樣品中的目標菌到可檢測濃度[23-24]。值得一提的是,死菌中的DNA在細胞活力喪失后的多天內仍可作為PCR模板,可能導致假陽性結果,而本方法還不能區分死菌和活菌[25]。前人研究表明,基于過濾的方法可實現活菌的特異性檢測。如Murakami[26]利用過濾前處理,8 h內在生菜中檢測到1 CFU·g-1的單核細胞增生李斯特氏菌,比本研究的檢測限低2.5倍;Garrido-Maestu等[21]在24 h內從雞肉樣品中獲得了與本研究相近的檢測限(9.5 CFU·25g-1)。但仍存在樣品基質顆粒堵塞過濾器,影響目標菌分離的缺陷,且仍需幾個小時的前增菌[5]。此外,一些基于IMS的PCR方法研究報道了相似的檢測限[20,24]。然而,IMS存在抗體交叉反應風險,所制備的用于捕獲目標菌的單克隆/多克隆抗體可能會與親緣關系較近的非目標菌結合[27]。
本研究使用開發的檢測方法,對基地采集的 2 500 份葉類蔬菜樣品進行了測試,其中菠菜的單核細胞增生李斯特氏菌污染率最高(5%),其次是生菜(3%)和油菜(1%)。菠菜、生菜的污染率較高可能是因為用于作物生產的土壤常用動物糞便(肥料)進行改良,其中潛在含有致病菌,且靠近被污染土壤表面的菠菜和生菜葉表面積較大[2,28]。還有研究表明,灌溉水和雨水的水滴也會將土壤顆粒帶到葉面上,導致污染[29]。此外,該菌的病死率較高(20%~30%),而某些易被該菌污染的葉類蔬菜(生菜、大白菜)卻常被生食,這顯然是李斯特菌病的潛在傳播途徑之一,應引起消費者和相關監管部門的關注[30]。總體上,本研究建立的快速、靈敏、特異的檢測方法有助于更好地了解掌握葉類蔬菜中單核細胞增生李斯特氏菌的流行情況且無需前增菌,省時省力,能提供更多可重復性結果,有助于預防和降低單核細胞增生李斯特氏菌對公眾健康造成的危害。
4 結論
本研究將β-CD和牛乳蛋白包被活性炭用于PCR樣品前處理,無需前增菌,可在4 h內快速、靈敏、特異地檢測葉類蔬菜中單核細胞增生李斯特氏菌。該方法操作簡便,能克服葉類蔬菜復雜基質的干擾,可作為分析實驗室的一個實用可靠的診斷工具。也可為葉類蔬菜的質量安全,消費者的健康提供切實保障,同時為食源性單核細胞增生李斯特氏菌的監測提供技術支持。

