小檗堿抑制JAK2/STAT3信號通路緩解高糖誘導的足細胞EMT和凋亡
吳 昊,楊 琳,唐麗琴,2,魏 偉
作者單位:1安徽醫科大學臨床藥理研究所,抗炎免疫藥物教育部重點實驗室,合肥 2300322中國科學技術大學附屬第一醫院藥劑科,合肥 230001
糖尿病腎病(diabetic nephropathy,DN)是一種慢性腎病,是1型和2型糖尿病的一種慢性微血管并發癥。高血糖、高血脂、代謝異常、微血管循環障礙和炎癥反應等都可以引起糖尿病腎病的發生。糖尿病腎病的主要病理特征是腎小球基底膜增厚、細胞外基質增生、系膜細胞增殖、足細胞損傷和腎小管纖維化等[1]。研究[2]發現,足細胞上皮間質轉化(epithelial-mesenchymal transition,EMT)和凋亡在糖尿病腎病足細胞損傷中起著重要作用,足細胞發生EMT和凋亡后會使腎小球的濾過屏障受損,腎小球濾過率降低,出現蛋白尿,加快糖尿病腎病進程。信號轉導子和轉錄激活子3(signal transducer and activator of transcription 3,STAT3)是酪氨酸激酶2(janus kinase 2,JAK2)的下游信號[3],JAK2的激活可引起STAT3的磷酸化,磷酸化的STAT3會影響細胞的生長、凋亡和EMT過程[4]。小檗堿(berberine,BBR)是一種季銨類生物堿,具有降血糖、調節血脂、抑制炎癥和腎臟保護等作用,課題組前期研究[5-6]發現,BBR可能在DN的發生發展中起著重要作用,但是其具體機制仍不清晰。因此該文研究了BBR對足細胞EMT和凋亡的緩解作用以及其與JAK2/STAT3信號通路的關系,為臨床上對DN的防治提供了新的思路。
1 材料與方法
1.1 實驗材料與儀器小鼠MPC5細胞系(BNCC 337685),BBR(BW 50137,純度為98.37%,高效液相色譜法)購自北京北納創聯生物技術研究院。細胞凋亡試劑盒(貨號:AP101-100-kit,杭州聯科生物技術股份有限公司);抗熒光淬滅劑(貨號:P0126,上海碧云天公司);RPMI 1640培養基(貨號 :SH30809.01,上海江林生物科技有限公司);Transwell 小室(貨號:3422,Corning公司);兔抗磷酸化酪氨酸激酶2(phosphorylated janus kinase 2,p-JAK2)抗體(貨號:4406T)、鼠抗STAT3抗體(貨號:9139S)、兔抗磷酸化信號轉導子和轉錄激活子3(phosphorylated signal transducer and activator of transcription 3,p-STAT3)抗體(貨號:9145S)、兔抗細胞凋亡調節因子(bcl-2 interacting mediator of cell death,Bim)抗體(貨號:2933)購自美國Cell Signaling Technology公司;兔抗JAK2抗體(貨號:17670-I-AP)、鼠抗波形蛋白(vimentin)抗體(貨號:60330-1-Ig)購自武漢Proteintech公司;兔抗足細胞裂孔膜蛋白(nephrin)抗體(貨號:ab216341)、鼠抗α-平滑肌肌動蛋白(alpha-smooth muscle actin,α-SMA)抗體(貨號:ab7817)購自英國abcam公司。激光共聚焦顯微鏡購自德國萊卡公司;OLYMPUS CKX 31型倒置顯微鏡購自日本奧林巴斯有限公司;FC貝克500型貝爾曼流式細胞儀購自美國貝克曼庫爾特公司;電泳架購自北京六一儀器廠;Image Quant Las 4000 mini型化學發光成像分析儀購自美國GEHealthcare Life Sciences公司;電子分析天平購自上海精天電子儀器廠。
1.2 方法
1.2.1細胞培養 將復蘇的足細胞用含有10%血清、1%雙抗、0.2% γ-干擾素的 RPMI 1640完全培養基重懸,置于37 ℃、5% CO2的培養箱中培養,待細胞長至培養瓶的90%左右時,消化離心進行后續實驗。
1.2.2流式細胞術檢測細胞凋亡 6孔板中加入2 ml 1×106/ml細胞懸液,細胞貼壁后隨機分為5組,即正常組(Control,葡萄糖濃度11.1 mmol/L)、模型組(HG,葡萄糖濃度30 mmol/L)和不同濃度BBR給藥組(30、60、90 μmol/L),按分組加高糖刺激和給藥之后繼續培養24 h,用不含EDTA的胰酶消化,1 500 r/min,4 ℃離心10 min后,去除上清液,每管加入500 μl稀釋5倍的Binding buffer,混勻,將混勻后的液體轉移至流式管中,加入凋亡試劑盒中的相應抗體,室溫避光孵育5 min后,上機檢測觀察每組細胞的凋亡情況。
1.2.3劃痕實驗檢測細胞遷移 在6孔板背面水平劃出三條平行的直線,間距相等,然后將細胞懸液接種于6孔板中,待細胞長至6孔板的80%左右時在孔中均勻的劃出與背面直線垂直的三條直線,PBS清洗2次,分組加刺激和給藥同1.2.2項,于0、24 h在顯微鏡下拍照留存,用image J軟件分析劃痕面積,并按公式計算劃痕愈合率,劃痕愈合率=(0 h劃痕面積-24 h劃痕面積)/0 h劃痕面積×100 %。
1.2.4Transwell法檢測細胞遷移 24孔板中加入500 μl含15% FBS的RPMI 1640培養基,然后將Transwell小室放入24孔板中,上室加入200 μl 1×104/ml含5% FBS的RPMI 1640培養基的細胞懸液,分組和加藥同1.2.2項,培養24 h后取出 Transwell小室,預冷PBS洗2次,洗去死細胞,用含0.05%結晶紫的PBS染色20 min,PBS清洗2次,擦去上室未遷移的細胞,倒置顯微鏡下觀察結果,隨機選取5個視野拍攝保存,計算每個視野的細胞數。
1.2.5Western blot檢測相關蛋白表達 將細胞懸液以1×108個/孔接種于6孔板,分組及加藥同1.2.2項,37 ℃培養24 h后,PBS清洗2次去除死細胞,每孔加100 μl RIPA細胞裂解液(RIPA ∶PMSF ∶磷酸酶抑制劑=99 ∶1 ∶1),放置1 h后,將細胞刮下并收集于EP管,12 000 r/min,4 ℃離心10 min,吸上清液于新的EP管中,加入適量5×蛋白上樣緩沖溶液,煮沸10 min后得到蛋白。進行10% SDS-PAGE電泳,分別孵育nephrin、α-SMA、vimentin、JAK2、p-JAK2、STAT3、p-STAT3、Bim蛋白對應抗體,最后于化學發光成像分析儀上進行檢測,所得結果用image J軟件進行灰度分析。
1.2.6激光共聚焦法檢測nephrin、α-SMA、vimenin的表達 將細胞懸液接種于含有蓋玻片的24孔板中,分組加刺激和給藥同1.2.2項,37 ℃培養24 h后,預冷PBS洗去死細胞,經過4%多聚甲醛100 μl固定30 min、0.5% BSA 120 μl封閉1 h、一抗80 μl 4 ℃孵育過夜、熒光二抗(1 ∶100)120 μl 37 ℃孵育2 h、DAPI 100 μl染核10 min等步驟后,指甲油封片。激光共聚焦顯微鏡下觀察細胞熒光結果并拍照留存。
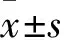
2 結果
2.1 BBR對足細胞凋亡的影響流式細胞術結果顯示(圖 1),HG組與Control組相比,足細胞凋亡率上升(F=38.627,P<0.01);BBR給藥組(30、60、90 μmol/L)與HG組相比,足細胞凋亡率逐漸降低。
2.2 BBR對足細胞遷移能力的影響劃痕實驗結果顯示(圖2A),HG組與Control 組相比,劃痕愈合率增加(F=34.139,P<0.01);BBR給藥組(30、60、90 μmol/L)與HG組相比,劃痕愈合率逐漸降低,BBR給藥組(30、60、90 μmol/L)均能降低足細胞的異常遷移。Transwell實驗結果顯示(圖2B),HG組與Control組相比,遷移到下室的足細胞增多(F=51.417,P<0.01);BBR給藥組(30、60、90 μmol/L)與HG組相比,遷移到下室的足細胞減少。
2.3 BBR對p-JAK2、p-STAT3和Bim蛋白表達的影響Western blot結果顯示(圖 3),HG組與Control組相比,足細胞的p-STAT3、Bim和p-JAK2的蛋白表達增加(F=10.875、30.433、13.709,P<0.05);BBR給藥組(30、60、90 μmol/L)與HG組相比,足細胞的p-STAT3、Bim和p-JAK2的蛋白表達降低。

圖1 BBR對足細胞凋亡的影響

圖2 BBR對足細胞遷移能力的影響

圖3 BBR對p-JAK2、p-STAT3和Bim蛋白表達的影響
2.4 BBR對nephrin、α-SMA 和vimentin表達水平的影響Western blot結果顯示(圖4A),HG組與Control組相比,足細胞上nephrin的蛋白表達降低(F=9.382,P<0.05),vimentin和α-SMA的蛋白表達增加(F=6.628、3.683,P<0.05);BBR給藥組(30、60、90 μmol/L)與HG組相比,能夠增加足細胞上nephrin的蛋白表達,降低vimentin和α-SMA的蛋白表達。激光共聚焦結果顯示(圖4B),HG組與Control組相比,足細胞核和細胞質上的nephrin的熒光強度降低(F=9.722,P<0.01),足細胞質上vimentin和α-SMA的熒光強度增加(F=12.931、4.820,P<0.05),即nephrin的表達降低,vimentin和α-SMA的表達增加;BBR 給藥組(30、60、90 μmol/L)與HG組相比,能夠增加nephrin的熒光強度,降低vimentin和α-SMA的熒光強度,即nephrin的表達增加,vimentin和α-SMA的表達降低。
3 討論
足細胞是一種終末分化的上皮細胞,覆蓋在腎小球基底膜外,是腎小球濾過屏障的重要組成部分,對維持腎小球濾過功能至關重要[7]。DN時,足細胞的形態和數量發生變化,即足細胞肥大,足突融合甚至消失,足細胞丟失等[8]。足細胞丟失是DN足細胞損傷的顯著性標志,有研究[9]發現,足細胞EMT和凋亡是造成足細胞丟失的主要機制,它們在足細胞損傷中起著關鍵作用。足細胞EMT是指足細胞失去其標志性的上皮特征而獲得間充質細胞特征的過程。足細胞發生EMT后,其上皮細胞樣標志蛋白如nephrin、E-cadenrin和ZO-1等表達降低,間充質細胞樣標志蛋白如α-SMA、vimentin等表達升高,遷移能力增加,可使足細胞從腎小球基底膜上脫落,使腎小球濾過屏障受損,出現蛋白尿[10-11]。足細胞凋亡是足細胞的一種程序化死亡,發生凋亡后,其凋亡能力升高,數量顯著減少,可使腎小球的濾過屏障受損,腎小球的濾過率降低,進而出現一系列腎臟疾病。本實驗研究結果顯示,使用30 mmol/L葡萄糖成功刺激足細胞24 h 后,足細胞出現EMT和凋亡現象。與Control組相比,HG組足細胞的遷移能力增加,足細胞上nephrin表達降低,α-SMA、vimentin和Bim表達增加。而不同濃度BBR 給藥后,足細胞的凋亡率降低,異常遷移減少,足細胞上nephrin表達增加,α-SMA、vimentin和Bim表達降低。這些結果說明BBR可以緩解高糖誘導的足細胞EMT和凋亡,發揮保護足細胞作用。但具體作用機制不明,仍需進一步探索。
JAK2/STAT3信號通路是重要的信號轉導通路,在生物體中廣泛存在,參與多種疾病的發展過程。JAK2是STAT3的上游激酶,活化后的JAK2會激活 STAT3,使STAT3在Y705位點上被磷酸化[12]。磷酸化的STAT3會以二聚體的形式從細胞質進入細胞核,激活細胞因子應答基因的轉錄[13]。研究[14]表明,JAK2/STAT3信號通路在細胞的EMT和凋亡中發揮著重要作用,如:JAK2/STAT3通路可誘導轉錄因子Slug的上調,促進膠質瘤細胞EMT過程;姜黃素可通過抑制JAK2/STAT3信號通路的激活來緩解膿毒癥腎損傷細胞的異常凋亡[15]。本實驗通過檢測JAK2/STAT3信號通路的相關蛋白顯示,HG刺激足細胞后,p-JAK2、p-STAT3的蛋白表達增加,足細胞發生EMT和凋亡現象。BBR 給藥后,p-JAK2、p-STAT3的表達降低,足細胞的EMT和凋亡現象隨之減輕。由此可以得出,高糖可能通過調節JAK2/STAT3信號通路導致足細胞EMT和凋亡,而BBR可能通過調節JAK2/STAT3信號通路來緩解這種現象的發生。

圖4 BBR對nephrin、α-SMA和vimentin表達的影響
綜上所述,HG刺激能夠激活JAK2/STAT3信號通路,誘導足細胞的EMT和凋亡過程,而BBR可以通過抑制JAK2/STAT3信號通路來緩解足細胞的EMT和凋亡過程,調節相關蛋白的表達,發揮對足細胞保護作用。

