獼猴原代腎小球系膜細胞分離提取培養與鑒定
劉瀟一,張春梅,張 磊,許 振,魏 琦,蔣海峰,董婷玉,楊雪枝,嚴尚學,常 艷,魏 偉
作者單位:安徽醫科大學臨床藥理研究所,抗炎免疫藥物教育部重點實驗室,抗炎免疫藥物安徽省協同創新中心,安徽醫科大學類風濕關節炎研究中心,合肥 230032
有報道[1]認為,大約10.8%的人群會受到腎臟疾病的影響。腎臟疾病主要損害的病理部位是腎小球,腎小球是腎組織中主要起濾過作用的單位[2]。腎小球系膜細胞(glomerular mesangial cells,GMCs)過度增殖是腎小球疾病(如腎小球腎炎、狼瘡性腎炎、糖尿病腎病等)的主要病理特征[3]。
腎小球主要由內皮細胞、上皮細胞和GMCs組成。原代腎組織中細胞提取培養中,與內皮細胞與上皮細胞相比,GMCs是較易生長的腎小球細胞,因為它們的生長需求最小,增殖能力較強[4]。目前已有對大鼠、小鼠、兔、人及豬的GMCs分離方法的報道[5],但尚未見對獼猴原代GMCs分離方法的報道。有文獻[6]報道稱,可以利用小鼠腎臟進行GMCs培養,但其操作步驟繁瑣,利用50、100目和200目三道篩網才能篩出純度較高的腎小球組織。腎小球位于腎臟腎皮質部位,小鼠腎皮質部位小,需要足夠量的小鼠腎組織才能貼出GMCs[6]。人原代GMCs的提取方法也有報道[7],但是取材較為困難(一般為胎兒的腎)。與其他實驗動物相比,獼猴與人類的遺傳基因、生理病理狀態以及免疫反應和新陳代謝具有高度的相似性,社會行為也與人類似,是基礎研究和臨床應用之間的一個理想轉化模型[8]。該研究結合已有的文獻報道,以及GMCs的生理特性和生長要求,成功建立了獼猴原代GMCs的分離培養方法,并對其進行鑒定和功能研究,為進一步研究提供實驗材料與工具。
1 材料與方法
1.1 實驗動物選取12只3~5歲普通級雄性實驗獼猴,體質量為4~6 kg,飼養于安徽醫科大學臨床藥理研究所實驗動物中心。溫度:20~26 ℃;日溫差:≤4 ℃;相對濕度:40%~70%。晝夜交替滿足獼猴作息時間,飼料、水不受限制,通過瓜果蔬菜補充營養,定時為獼猴播放音樂及視頻,嚴格遵守動物福利標準。實驗動物購自旌德縣皖南獼猴馴養繁殖基地,生產許可證號:SCXK(皖)2020-001。實驗動物使用許可證號:SYXK(皖)2020-001。該實驗過程經安徽醫科大學臨床藥理研究所動物倫理委員會批準(批準號:PT-2020-001)。
1.2 主要實驗試劑及儀器注射用鹽酸替來他明鹽酸唑拉西泮(舒泰50)購自上海維克有限公司;DMEM基礎培養基和胎牛血清(fatal bovine serum, FBS)購自以色列Biological Industries公司; 0.25%胰蛋白酶(含EDTA)購自上海碧云天生物技術研究所;小鼠腎小球系膜細胞系 SV40 MES 13 購自武漢普諾賽(Procell)生命科技有限公司;DAPI染色液和0.5%結晶紫水溶液購自北京索萊寶生物科技有限公司;CCK-8試劑盒購自合肥Biosharp公司;TNF-α購自美國 PeproTech公司;α-SMA(兔抗單克隆抗體,美國Proteintech公司)、GAPDH(兔抗單克隆抗體,美國Proteintech公司); Nephrin(兔多克隆抗體,美國affinity公司)抗體;Transwell小室均購自美國Corning公司;Ⅵ型膠原酶購自美國Sigma公司。DMi1型倒置生物顯微鏡:徠卡顯微系統(上海)有限公司;BX 53正置顯微鏡:日本OLYMPUS公司;Image Xpress Micro4型高內涵細胞成像分析儀:美國Molecular Devcies公司; Infinite M1000 PRO多功能酶標儀:瑞士TECAN公司。
1.3 獼猴腎小球系膜細胞分離及培養方法
1.3.1動物麻醉與提取腎小球 獼猴在肌肉注射舒泰50(6 mg/kg)深度麻醉后,采取股動脈放血處死。獼猴處死后解剖,在超凈臺中沿腹部中線打開腹腔,無菌取出獼猴腎臟。利用預冷的無菌生理鹽水沖洗腎臟,去除腎組織中的血塊和血紅細胞,之后轉移至另一個空的無菌大皿中。利用無菌眼科剪、眼科鑷去除多余腎組織(如:腎盂和腎包膜),利用無菌手術刀剖開腎臟,取一小塊腎皮質。將腎皮質放入無菌1.5 ml離心管中,利用無菌眼科剪剪碎腎皮質,組織塊大小≤1 mm3;加入少量混有高糖DMEM的無菌生理鹽水混勻,利用巴氏吸管分次吸取剪碎的腎組織懸液放到重疊的2層紗網上(上100目,下200目),利用5 ml注射器輕碾組織塊,同時利用無菌生理鹽水沖洗,直至組織塊發白;將200目紗網轉移到無菌大皿中,巴氏吸管吸取無菌生理鹽水反復反向沖洗200目紗網上碾碎的組織塊,收集沖下的組織塊,轉移至無菌15 ml離心管中。離心管低速離心5 min ,轉速1 000 r/min,之后棄去上清液,加入適量的無菌生理鹽水構成腎小球懸液,整個過程盡量控制在2~3 h之內且保持無菌操作。
1.3.2腎小球活性鑒定及計數 取上述腎小球組織懸液90 μl,加入定量10 μl的0.4%臺盼藍溶液充分混勻,5 min后立即取10 μl滴于覆以蓋玻片的細胞計數板上,5×物鏡下觀察提取腎小球的數量、染色情況及有無脫去布曼囊,并進行腎小球計數。腎小球活性及濃度的計算公式[9]如下

1.3.3獼猴腎小球消化與接種腎小球 在腎小球懸液中分別加入不同濃度的Ⅵ型膠原酶(0.1 mg/ml 及0.2 mg/ml)和0.02 mg/ml Dnasel,分別放入37 ℃恒溫培養箱中震蕩充分消化不同時間(10 min和15 min),之后加入2 ml 20%FBS-DMEM培養液終止消化,充分混勻。再迅速以1 000 r/min轉速,離心5 min。盡量完全去除上清液,加入500 μl 20%FBS-DMEM培養液進行重懸。利用移液槍吸取適量重懸液至培養瓶中(盡量鋪滿瓶底),同時輕輕晃動培養瓶使上述腎小球懸液均勻鋪在瓶底后,將培養瓶的培養面朝上放入37 ℃、5% CO2恒溫培養箱中,使腎小球組織塊貼壁,4~5 h后再緩慢將細胞瓶翻面培養,并加入3 ml 20%FBS-DMEM培養液,使完全培養液浸潤,培養細胞。注意3 d內勿晃動培養瓶,4 d采用半定量換液,目的是給貼壁腎小球組織適應環境;8 d首次全量換液并觀察腎小球細胞生長情況,之后每隔3 d全量換液1次,直至細胞鋪滿瓶底進行首次消化傳代。
1.3.4原代系膜細胞的傳代培養 往培養瓶內加入適量0.25%胰蛋白酶(含EDTA)消化腎小球細胞(細胞以鋪滿瓶底為度,同時消化液應提前在室溫條件下進行復溫),置于37 ℃、5% CO2恒溫培養箱中1 min后拿出,在倒置顯微鏡下觀察細胞形態變化(細胞回縮變圓)時加入完全培養液終止其消化。用移液槍吸取培養液,輕輕反復吹打培養瓶壁上的細胞,收集細胞懸液于15 ml離心管中,以 1 000 r/min 的轉速,離心5 min,棄去上清液,使用適量20%FBS-DMEM培養液重懸細胞。細胞計數板計數后,稀釋成適當密度接種于新的培養瓶中繼續培養。
1.4 獼猴原代系膜細胞的鑒定
1.4.1形態學觀察 倒置光學顯微鏡觀察并拍照記錄獼猴原代GMCs形態特征和生長狀況。
1.4.2免疫熒光鑒定 選擇狀態良好的GMCs(3~4代)種在鋪有無菌蓋玻片的24孔板中培養24 h,利用SV40 MES 13(小鼠系膜細胞系)做陽性對照,細胞密度約為50%~60%。加入PBS輕輕晃動洗滌3 min×2 次;加入預冷的4%多聚甲醛固定20 min,棄去,加入PBS輕輕晃動洗滌3 min×3 次;加入含0.5%BSA的PBS,室溫封閉30 min,棄去封閉液;分別在加入抗兔的Nephrin和α-SMA一抗(一抗濃度為1 ∶100),4 ℃過夜,加入PBS輕輕晃動洗滌3 min×3 次;加入594標記的山羊抗兔二抗(1 ∶1 000)37 ℃搖床賦予2 h,PBS輕輕晃動洗滌5 min ×3次;加入DAPI染細胞核,室溫搖床賦予8 min,PBS輕輕晃動洗滌5 min×3 次;摳片加入抗熒光淬滅劑,封片;熒光顯微鏡下觀察。
1.4.3Western blot法檢測蛋白表達 利用配置好的細胞裂解液提取本方法獲得的GMCs以及SV40 MES 13的蛋白,配制10%的SDS-PAGE凝膠,上樣電泳,轉移至PVDF膜上,利用TBST配制的5%脫脂牛奶37 ℃搖床封閉2 h,洗去牛奶后,用1 ∶1 000的兔抗Nephrin和α-SMA多克隆抗體或1 ∶1 000兔抗GAPDH抗體4 ℃ 條件下孵育過夜,1 ∶10 000兔二抗 37 ℃搖床孵育2 h,洗去二抗后,加入提前配置好的顯影液曝光,采用 Image J圖像分析軟件進行條帶灰度值分析,比較各組之間的差異。
1.5 獼猴腎小球原代系膜細胞功能實驗
1.5.1高內涵檢測細胞增殖能力 0.25%胰蛋白酶消化細胞,20%FBS-DMEM培養液終止消化,并制備細胞懸液。細胞計數,以0.4×104個細胞均勻鋪入96孔板,利用10 ng/ml TNF-α刺激24 h[10]。96孔板用生理鹽水洗3次,每次3 min。 4%多聚甲醛固定30 min,并用生理鹽水清洗。加DAPI染核5~8 min,生理鹽水洗3次,加入適量生理鹽水,并用高內涵成像系統拍照。
1.5.2CCK-8法檢測細胞生長活力 細胞制成懸液后,以0.4×104個/孔鋪入96孔板,饑餓處理之后24 h加10 ng/ml TNF-α。37 ℃、5%CO2恒溫培養箱培養24 h,生理鹽水洗滌細胞。每孔加100 μl 20%FBS-DMEM完全培養液、10 μl CCK-8試劑繼續培養1~2 h后,利用酶標儀檢測其吸光度(λ=450 nm)。
1.5.3Transwell法檢測獼猴腎小球系膜細胞遷移能力 細胞制成懸液后,接種于24孔板,10 ng/ml TNF-α刺激24 h。消化細胞并將Transwell小室放入24孔板,上室加細胞懸液,下室加20%FBS-DMEM培養液。37 ℃、5%CO2恒溫培養箱中遷移24 h;將小室放入4%多聚甲醛固定30 min;并用生理鹽水清洗;含0.1%結晶紫的生理鹽水,染色20 min;顯微鏡下觀察拍照,每組隨機選取9個視野,統計遷移細胞數目。
1.5.4細胞劃痕實驗檢測獼猴腎小球原代系膜細胞遷移能力 取原代GMCs,24 h后融合率達100%后,用200 μl無菌槍頭垂直于孔板底部中央劃痕,棄去培養基,無菌PBS沖洗脫落細胞,10 ng/ml TNF-α刺激24 h,分別于0、24 h進行拍照,觀察劃痕愈合情況,計算劃痕愈合率。劃痕愈合率(%)=(0 h劃痕距離-24 h劃痕距離)/0 h劃痕距離×100%。
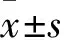
2 結果
2.1 腎小球提取條件的比較Ⅳ型膠原酶不同濃度和消化的時間,細胞最開始爬出的速度及狀態不同。3 d觀察0.1 mg/ml Ⅳ型膠原酶消化10 min的腎小球貼壁較多,0.2 mg/ml Ⅳ型膠原酶消化15 min的腎小球貼壁較少。7 d后0.2 mg/ml Ⅳ型膠原酶消化10 min,15 min和0.1 mg/ml Ⅳ型膠原酶消化15 min的腎小球細胞呈星形或紡錘形細胞數量較少,生長緩慢(圖1A~D);0.1 mg/ml Ⅳ型膠原酶消化10 min的腎小球細胞生長狀態較好(圖1A)。21 d后0.2 mg/ml Ⅳ型膠原酶消化15 min的腎小球已無細胞生長,0.1 mg/ml Ⅳ型膠原酶消化15 min的腎小球細胞有較少的細胞生長;0.1 mg/ml Ⅳ型膠原酶消化10 min的腎小球細胞生長旺盛。
2.2 腎小球系膜細胞的形態學鑒定經2種不同目數的紗網提取的腎小球用0.4%臺盼藍染色后于倒置顯微鏡下觀察顯示: 大部分腎小球均脫去布曼囊(腎小球中有細胞散出,但又不破碎)且不著色(圖2A)。原代培養的腎小球3 d后開始貼壁。應用倒置顯微鏡觀察顯示:培養7 d后腎小球周圍已有細胞移出,腎小球組織周圍出現梭形及星形或不規則形狀的細胞,細胞胞體中央有一清晰的卵圓形核,胞質向外伸出數個長短不一的突起,處于指數增生期的細胞常呈放射狀(圖1A,圖2B)。21~28 d原代GMCs生長進入旺盛時期,不少地方的細胞匯合,且呈堆疊狀生長狀態(圖2C~D)。
2.3 原代腎小球系膜細胞Nephrin和α-SMA蛋白表達提取原代GMCs、SV40 MES 13蛋白,免疫熒光和Western blot法檢測細胞中Nephrin(相對分子量為 135 ku)和α-SMA(相對分子量為 42 ku)蛋白表達。結果顯示,分離培養得到的原代GMCs α-SMA表達水平與對照組SV40 MES 13 α-SMA蛋白表達相似;SV40 MES 13和原代GMCs均不表達Nephrin蛋白(圖3、4) 。

圖1 D7原代腎小球細胞生長情況 ×50

圖2 原代GMCs形態學

圖3 免疫熒光鑒定原代GMCs Nephrin;α-SMA蛋白表達 ×50
2.4 獼猴腎小球原代系膜細胞功能實驗
2.4.1TNF-α對獼猴原代腎小球系膜細胞活力以及增殖的影響 傳代后的GMCs均勻鋪在到96孔板中,10 ng/ml TNF-α刺激24 h后加CCK-8檢測λ =450 nm處的吸光度,與Control組相比,10 ng/ml TNF-α刺激組GMCs活力提高(圖5B)。圖5C和5D顯示高內涵成像系統法檢測原代GMCs的增殖能力。根據細胞直徑最小到最大范圍和細胞熒光最弱到最強范圍設定軟件參數,減去背景熒光強度,統計分析所有細胞。導出的Excel表格,統計每組細胞的細胞總數,分析細胞的增殖能力。與Control組相比,原代GMCs經TNF-α刺激后增殖能力增強(圖5A)。

圖4 Western blot法鑒定原代GMCs Nephrin、α-SMA蛋白表達
2.5 TNF-α對獼猴原代腎小球系膜細胞遷移的影響Transwell小室檢測原代GMCs遷移功能,利用結晶紫染色后,利用顯微鏡進行拍照觀察記錄。與Control組相比,TNF-α刺激后原代GMCs遷移數量顯著增多(圖6A)。對細胞進行計數統計分析可知,TNF-α刺激后原代GMCs遷移能力增強(圖6A)。劃痕實驗檢測結果顯示,與Control組相比,TNF-α刺激組劃痕愈合率增加(圖6B),且差異有統計學意義。
3 討論
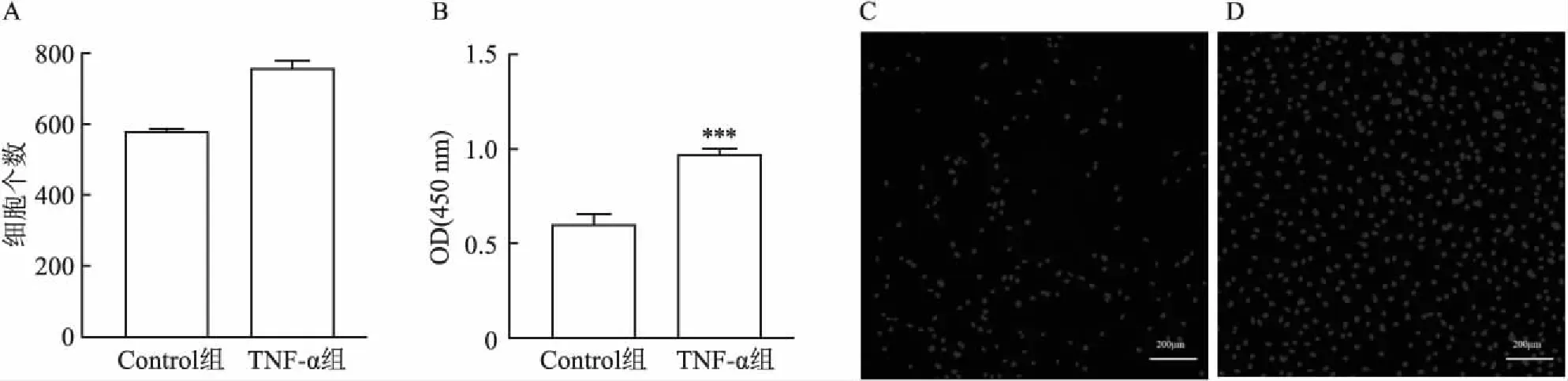
圖5 TNF-α對原代GMCs活力以及增殖的影響 ×50

圖6 TNF-α對獼猴原代腎小球系膜細胞遷移的影響 ×50
膠原酶法和組織黏附法是目前培養原代GMCs常用的方法。膠原酶消化法適用于大部分的實驗動物,然而組織黏附法只適用于幼年時期的動物,這對實驗動物的年齡有限制。本實驗利用組織黏附法貼獼猴原代GMCs,但是未見原代GMCs移出,所以結合以上原因,采取了膠原酶消化法獲取原代GMCs。由于不同動物適用的消化條件不同,所以課題組對比了幾種不同的消化濃度和時間,根據腎小球活性、貼壁數量、GMCs貼出的時間和GMCs傳代后的狀態,選出最適合獼猴原代GMCs的消化條件(0.1 mg/ml Ⅳ型膠原酶消化10 min)。根據以上結果可知Ⅳ型膠原酶消化濃度過大或者消化時間過長會導致腎小球活性降低,不容易貼出細胞,貼出的細胞生長速度緩慢。0.1 mg/ml Ⅳ型膠原酶消化10 min細胞生長旺盛,這與已有文獻報道的消化濃度相比較低,保持腎小球活性。之前小鼠提取腎小球過程中,需要利用三層篩網才能提取出較純的腎小球,但是本實驗采用了兩層篩網便提取出較純腎小球。在培養過程中,翻轉培養瓶的時間很重要,一般為4~5 h,若時間過短腎小球則未貼壁;過長則導致腎小球組織活性喪失。首次換液時間一般為3~4 d且為半定量換液,之后每天觀察GMCs的移出情況。由于適宜上皮細胞生長的血清濃度為5%,培養內皮細胞通常需要額外加生長因子,體外培養要求條件與GMCs不同,且原代上皮細胞和內皮細胞培養一般需要5~7 d傳代,而GMCs則需要21~30 d[11]。經過以上條件篩選和形態學觀察,以及利用免疫熒光和Western blot法檢測特異性蛋白表達鑒定提取的GMCs符合實驗要求。本次實驗顯示,系膜細胞傳5~6代形態和功能便開始變化,不能支持后續實驗。
TNF-α是一種促炎細胞因子,主要由多種免疫細胞(如活化的巨噬細胞、T淋巴細胞和自然殺傷細胞)產生[12],生理條件下,它具有顯著的抗病毒效應,維持機體穩態的作用[13]。炎癥狀態下,TNF-α可以通過NF-κB通路導致GMCs功能發生改變[14]。所以本實驗選用TNF-α為刺激劑,檢測獼猴原代GMCs功能的變化,經刺激后原代GMCs的增殖和遷移能力顯著增強,這提示獼猴原代GMCs提取成功。
GMCs是體外研究腎小球疾病的一個很好的實驗模型,它存在于腎小球毛細血管袢中,能維持腎小球濾過屏障功能。人類疾病的動物模型對于了解疾病的發生發展機制和治療干預方式至關重要。人類與非人類靈長類動物各個系統發育具有密切的聯系,并且與它們的生理有許多相似之處,例如高度相似的免疫系統以及相似的組織結構等[15]。之前無論是小鼠、大鼠、兔等動物原代GMCs,都難以完整體現人原代GMCs的生理病理功能。本研究以獼猴為實驗動物成功探索出非人靈長類動物GMCs的分離方法,并對GMCs的功能進行了鑒定,為研究腎臟相關疾病提供了一個體外細胞模型。

