SOD擬似劑Tempol改善間歇性低氧小鼠主動脈舒張功能
蔣 倩,圣 豪,劉國瑩,余孝海,鐘明奎
作者單位:安徽醫科大學生理學教研室,合肥 230032
阻塞性睡眠呼吸暫停(obstructive sleep apnea, OSA)是影響5%普通人群和 18% 50歲以上老年人群的常見疾病[1-2]。OSA的特點是睡眠期間反復呼吸暫停,導致間歇性低氧和睡眠片段化,是高血壓、缺血性心臟病、動脈粥樣硬化、冠心病、中風等心腦血管疾病的獨立危險因素。間歇性低氧(intermittent hypoxia,IH)可通過氧化應激、一氧化氮利用不足、全身炎性反應、交感神經過度激活和內皮修復能力降低等途徑導致血管內皮功能障礙,進而增加高血壓等心血管疾病的發生風險[3]。Tempol是一種抗氧化劑[4],作為SOD類似物,可以穿透細胞膜并與細胞內和細胞外的氧自由基反應,通過清除ROS減少氧化應激保護血管內皮功能[5-6]。該研究旨在探討口服Tempol對IH引起的小鼠心血管損傷的保護作用。
1 材料與方法
1.1 材料
1.1.1實驗動物 36只雄性清潔級C57小鼠,體質量(24±3)g,由安徽長臨河醫藥科技有限公司提供,合格證號[Scxk(皖)2017-001]。動物分籠飼養,自由攝食和飲水,通風良好,室溫18~25 ℃。
1.1.2儀器 測氧儀(CYS-1型,南京新飛分析儀器制造有限公司);DMT 620M血管張力測定系統(丹麥DMT公司);倒置熒光顯微鏡,冰凍切片機(德國徠卡);全自動酶標儀(南京德鐵實驗設備有限公司)。
1.1.3試劑 醫用壓縮氧氣(濃度>99.9%)、壓縮氮氣(濃度>99.9%)由合肥眾益化工產品有限公司充裝;Dihydroethidium(DHE)、NO測試盒購自上海碧云天生物技術有限公司;Tempol、乙酰膽堿(acetylcholine,ACh)、硝普納(sodium nitroprusside,SNP)、苯腎上腺素(phenylephrine,Phe)購自美國Sigma公司。
1.2 方法
1.2.1IH模型的制備和分組 小鼠在適應性飼養1周后進行實驗,隨機分成正常氧量組(Control)、間歇性低氧組(IH)、間歇性低氧Tempol干預組(IH+Tempol),每組12只。本研究采用IH誘導小鼠心血管損傷模型,通過氮氣稀釋原理,向低氧艙循環充入氮氣和氧氣,每一循環為9 min,4 min充入氮氣,隨之5 min充入氧氣,由測氧儀監測間歇性低氧艙中的氧濃度,調節氣體流量,使每一循環間歇性低氧艙內的最低氧濃度達到6%左右,持續時間為45 s左右,然后再逐漸恢復至21%,間歇性低氧艙內氮氣和氧氣的轉換通過定時電磁轉換器來完成(圖1)。將IH組以及IH+Tempol組小鼠放進低氧倉內,進行每天8 h的間歇性低氧處理(9 ∶00 am-5 ∶00 pm),連續4周。Control組除不入箱內,其余均與IH組進行相同處理。在間歇性低氧處理3周之后,IH+Tempol組連續1周每天使用Tempol(100 mg/kg)給予灌胃處理,而Control組和IH組則灌注相同體積0.9%生理鹽水。實驗第4周末,處死小鼠,進行血管離體實驗。

圖1 間斷性低氧艙內氧含量的變換模式
1.2.2心臟重量指標測定 實驗模型制備完成后,首先進行小鼠體質量測量,隨即用10%水合氯醛(0.05 ml/10 g)腹腔注射麻醉。將麻醉小鼠固定,準備成套眼科剪與鑷子打開小鼠胸腔,將心肺等器官充分暴露,隨即將還在跳動的心臟迅速摘取,剝離多余結締組織等,隨后置于冰冷生理鹽水中,輕輕沖洗,擠壓多余血水,用吸水紙將心臟中多余水分吸除,稱重后立即進行稱重后液氮存放,計算心重指數為心臟重量/體質量(mg/g);將小鼠脛骨完整分離出,取出測量長度,計算心臟重量/脛骨長度(mg/cm)的比值。
1.2.3離體血管張力檢測 利用CO2吸入法麻醉并處死小鼠,采用上述方法摘取小鼠心臟后,緊貼小鼠脊柱,取出完整胸主動脈,操作需動作快速輕柔,對血管無牽拉。將血管放置在預先接通混合氧(95%O2和5%CO2)的Krebs溶液中,借助顯微鏡,將包裹在血管周圍多余脂肪和結締組織以及其他雜質從外壁上小心清除,使其達到干凈透明狀態。然后將胸主動脈分別截斷為2 cm左右。手持眼科鑷,將血管環固定在Myograph 張力器兩端,浴槽中持續通入混合氧,預置5 ml的Krebs液,全程保持pH值7.4,溫度37 ℃。待血管穩定后,再給予2 mN的前負荷,緩慢拉伸血管環,并利用Powerlab系統記錄血管張力的變化。待平衡30 min后,加入高鉀溶液刺激血管,每次60 mmol/L,2次/15 min。血管達到最大收縮時,吸出高鉀溶液,隨后用Krebs液洗脫殘留藥物,3次/15 min。隨后加入3 μmol/L Phe刺激血管預收縮,在收縮達到穩定峰值時,加入ACh(10-8~10-5.5mol/L)或SNP(10-9~10-5mol/L),檢測血管內皮依賴性與內皮非依賴性舒張功能。ACh可激動血管內皮細胞M3亞型,促進內皮依賴性舒張因子(endothelium-derived relaxing factor, EDRF)之一NO的釋放,從而引起鄰近平滑肌細胞松弛,促使血管內皮性依賴性舒張;SNP致使平滑肌松弛,在血管平滑肌內代謝產生NO,引起血管非內皮依賴性舒張。
1.2.4胸主動脈中NO測定 取剝離干凈的胸主動脈加入裂解液,使用低溫超聲裂解儀裂解組織,離心取上清液;使用裂解液將1 mol/L的NaNO2稀釋成1、10、20、40、60、80、100 μmol/L的標準品;配制1 mol/L的NaNO2,參考說明書的操作步驟操作,用全自動酶標儀測量出吸光度(optical density, OD)值。
1.2.5胸主動脈中活性氧(reactive oxygen species,ROS)測定 將剝離干凈的胸主動脈用OTC包埋,冰盒靜置后放入液氮,最后置-80 ℃冰箱保存。使用冰凍切片機將包埋好的血管切成5μm的病理切片。將DHE ROS熒光探測液(5 μmol/L)與標本常溫避光孵育5~ 20 min。DHE在超氧化物生成處被氧化成為氧化乙錠,與DNA相結合之后,可被激發出紅色的熒光,通過熒光顯微鏡觀察熒光的強度,并ImageJ軟件計算血管內ROS含量。
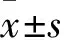
2 結果
2.1 Tempol對IH小鼠主動脈舒張功能的影響離體血管張力檢測結果顯示:3組小鼠胸主動脈內皮依賴性舒張功能存在明顯差異[F(2,15)=27.54,P<0.001](圖2A)。與Control組相比,IH 4周后,Phe預收縮的胸主動脈環對ACh引起的內皮依賴性舒張顯著降低(P<0.001);口服SOD類似物tempol可改善IH引起的內皮依賴性舒張功能(P<0.001),但不能完全恢復正常內皮依賴性舒張水平。3組間Phe預收縮的胸主動脈環對SNP引起的內皮非依賴性舒張差異無統計學意義(圖2B)。提示IH可能是通過影響內皮細胞而不是平滑肌細胞引起血管舒張功能的改變。
2.2 Tempol對IH小鼠主動脈中ROS與NO含量的影響圖3A-C依次為Control組、IH組、IH+Tempol組小鼠胸主動脈DHE熒光染色后顯示ROS分布與濃度。熒光亮度與ROS含量正相關,亮度越強,ROS含量越多。分析結果顯示:與Control組相比,IH組小鼠胸主動脈中ROS熒光強度顯著升高(P<0.001),口服Tempol可降低IH小鼠胸主動脈中ROS水平(P<0.001),但不能恢復到正常水平(P<0.001)(圖3D)。提示Tempol作為超氧陰離子清除劑可通過減少血管中活性氧的產生或者清除活性氧來發揮保護心血管的作用。NO測定結果顯示:與Control組相比,IH組小鼠胸主動脈中NO含量降低(P<0.001),口服Tempol后,可以提高IH小鼠胸主動脈中的NO含量(P<0.01),但不能恢復到正常水平(P<0.001) (圖3E)。提示Tempol可能是通過減少活性氧的產生,提高NO生物利用率來減少血管內皮功能損傷,從而發揮心血管保護作用。
2.3 Tempol對IH小鼠體質量和心臟重量的影響與Contol組相比,間歇性低氧4周后,IH組小鼠體質量顯著降低[F(2,21)=15.28,P<0.001],而心臟重量/體質量比值[F(2,21)=19.16,P<0.001]和心臟重量/脛骨長度比值[F(2,21)=12.08 ,P<0.001]顯著增加,提示間歇性低氧小鼠出現心肌肥大。口服Tempol后,與IH組比較,IH+Tempol 組小鼠的體質量明顯增加(P<0.01),心臟重量/體質量比值(P<0.01)和心臟重量/脛骨長度比值(P<0.01)明顯下降,提示Tempol可抑制IH小鼠心肌肥大。見表1。

表1 Tempol對間歇性低氧小鼠體質量和心臟重量的影響

圖2 Tempol對IH小鼠主動脈內皮依賴性舒張功能的影響

圖3 小鼠主動脈ROS和NO含量 SP×400
3 討論
本研究顯示經IH處理4周,可引起小鼠胸主動脈對ACh引起的內皮依賴性舒張功能下降、心肌肥大,胸主動脈中ROS增加而NO水平降低,提示IH引起的心血管功能障礙可能與氧化應激增加使NO的生物利用度下降有關;口服SOD類似物Tempol,使IH小鼠胸主動脈中ROS水平降低、NO濃度增加,改善IH引起的內皮依賴性舒張功能和心肌肥大。
OSA是多種心腦血管疾病的獨立危險因素,是患者致殘和死亡的主要原因,IH是OSA的主要病理生理學特點和損傷機制,被認為是引起心腦血管疾病的最為重要的因素[7]。反復IH可引起氧化應激和ROS增加,而ROS可作為信號分子在OSA引起的并發癥中起著重要的作用,抑制ROS對心血管具有重要的保護作用[8]。ROS是氧在生物體內通過單電子還原產生化學性質活潑的物質,包括超氧陰離子(·O-2)、羥自由基(·OH)和過氧化氫(H2O2)等。細胞內的ROS來源于氧化酶催化的代謝產物和線粒體電子傳遞鏈,涉及ROS代謝的酶有NAD(P)H 氧化酶(NOX)、黃嘌呤氧化酶、超氧化物歧化酶(SOD)和過氧化氫(CAT)等。超氧化物會氧化生物分子,與NO的反應促進過氧亞硝酸鹽的形成,減少NO的生物利用度。而在SOD的作用下CAT酶和谷胱甘肽過氧化物酶則可將過氧化氫轉化為水和氧氣,在ROS的代謝中發揮了重要作用。Tempol 是一種可透膜的金屬非依賴性SOD擬似物,可以減輕自由基引起的損傷,提高NO的生物利用度,在氧化應激的動物模型中發揮有益的作用[9]。本研究中,Tempol可抑制IH小鼠主動脈中ROS水平,提高NO濃度,顯著改善IH小鼠血管內皮依賴性舒張功能和心肌肥大。Troncos et al[10]也發現,Tempol可明顯降低間歇性低氧模型大鼠的血壓、血漿內皮素和血管內ROS水平,提示ROS在IH誘發的心血管疾病中起著重要作用。
血管內皮細胞是連續覆蓋于血管腔表面的單層上皮細胞,是多種血管活性物質的產生和作用部位,在維持血管張力、參與管壁炎癥修復、調節血管生長以及調控血小板聚集和凝血功能等方面起著重要作用。內皮細胞可通過產生的NO,促進局部血管舒張,抑制血小板聚集、單核細胞黏附和血管平滑肌增殖來維持血管正常的形態和功能。內皮功能障礙被認為是心血管疾病發展過程中最早可檢測到的和可能被逆轉的異常之一。內皮功能障礙通常指的是內皮依賴性血管舒張功能受損,與NO生物利用度降低有關;而非內皮依賴性血管舒張功能受損,則表示與血管壁中的平滑肌功能障礙有關的進一步的結構損傷。慢性IH可通過氧化應激、一氧化氮利用不足、全身炎性反應、交感神經過度激活和內皮修復能力降低等途徑導致血管內皮功能障礙能,進而增加高血壓等心血管疾病的發生風險,可能是引起間歇性小鼠心肌肥大的機制之一。本研究顯示,IH小鼠胸主動脈對ACh引起的內皮依賴性舒張功能下降,而對SNP引起的非內皮依賴性舒張功能正常,提示血管內皮功能受損可能是IH引起心血管疾病的重要原因之一,具體機制有待進一步研究。

