CT技術應用于肺癌患者預測外周中心靜脈置管置入長度的價值研究
關務達
(遼陽市結核病醫院CT室,遼寧 遼陽 111000)
目前隨著CT技術的發展,CT技術廣泛的應用于臨床各個科室,之前研究人員人分析2005年250例肺栓塞疑似患者胸部增強CT圖像,并利用三維重建算法將圖像重建成人體肺血管三維模型并將患者上腔靜脈相對位置進行一個全方位測量,包括患者上腔靜脈表面標志物和患者肺栓塞上腔靜脈關系對應,如肺栓塞患者上腔靜脈位置長度、路易斯角和第二、三肋骨間隙[1]。結果表明上腔靜脈表面標志物位置和上腔靜脈不完全一致,所以并非所有患者都能在置管過程中使用上腔靜脈表面標志物來定位[2]。多層CT層析成像技術定位外周中心靜脈置管更加準確。多層螺旋CT具有血管成像功能且多層螺旋CT能準確測量患者胸鎖關節與患者心臟陰影右上緣長度[3]。經外周靜脈穿刺置入中心導管(PICC)是一種深靜脈置管技術,其從外周靜脈置入,末端位于上腔靜脈,其廣泛應用于血液制品輸入、長期靜脈輸液或高滲藥物的輸入、化療等。在經外周靜脈穿刺置入中心導管置管中,上腔靜脈下1/3段是理想的經外周靜脈穿刺置入中心導管尖端位置。如果經外周靜脈穿刺置入中心導管異位,導管末端不能進入上腔靜脈下1/3段,相關并發癥的發生率會增加,導管保留時間會縮短。因此,有效定位經外周靜脈穿刺置入中心導管具有重要意義。經外周靜脈穿刺置入中心導管置管后尖端位置的合理性主要通過胸部X線檢查,但胸部X線很難直接確定上腔靜脈的位置,臨床認為氣管隆凸下約2個椎體單位可作為上腔靜脈下端的參考,但仍缺乏相關研究報道。患者胸鎖關節與患者心臟陰影右上緣的長度可指導臨床護士將外周中心靜脈置管尖端準確地放置在患者上腔靜脈與患者右心房交界處[4],筆者對我院確診時已進行CT檢查的肺癌患者,在不增加肺癌患者輻射情況下,收集肺癌患者原始資料,對肺癌患者采用CT技術應用于肺癌患者預測外周中心靜脈置管置入長度的價值,對CT技術預測外周中心靜脈置管置入長度效果進行了系統的試驗,研究如下。
1 資料與方法
1.1 一般資料 選取2019年1月至2020年1月在遼陽市結核病醫院CT室的80例肺癌患者,隨機分為試驗組和對照組,對兩組肺癌患者均采用從穿刺點測量至右胸鎖關節的距離來預測外周中心靜脈置管置入長度,對照組40例肺癌患者在此基礎上加用向下反折至第四肋間這一種體外測量法方法預測外周中心靜脈置管置入長度,肺癌患者性別男20例,肺癌患者性別女20例,肺癌患者病程0.50~1.20年,肺癌患者平均病程(1.00±0.35)年;試驗組40例肺癌患者在此基礎上加用CT技術應用于胸鎖關節到心臟陰影右上緣的垂直距離來預測外周中心靜脈置管置入長度,肺癌患者性別男20例,肺癌患者性別女20例,肺癌患者病程0.60~1.30年,肺癌患者平均病程(1.10±0.21)年,經統計學分析兩組肺癌患者的基本情況無統計學差異(P>0.05),可以比較。患者對本研究知情同意并簽署知情同意書,本研究已獲得我院倫理委員會的批準。
1.2 納入標準與排除標準 納入標準:納入需要長期住院或者需要靜脈輸液以及需要化療的患者,患者年齡30~78歲。患者自愿參加研究并符合外周中心靜脈置管置入要求。在過去兩個月有CT拍攝的歷史患者。排除標準:排除有胸部放療史患者以及不能仰臥患者,排除不能完全伸展上肢和上腔靜脈壓迫患者,排除進行過全肺葉切除患者。
1.3 方法 兩組患者均由2名省級護士負責導管治療,2名護士負責導管,2名護士協助導管治療,確保導管治療的均勻性。2名主管放射科的技術人員具有10年放射診斷經驗。對照組從穿刺點到右胸鎖關節再到第四肋間間隙進行體外測量,評估患者靜脈并確定穿刺部位:患者平躺在經外周靜脈置入中心靜脈導管床上,穿刺側上肢外展與身體成90°,并記錄開始時間,臨床根據患者的情況選擇穿刺手臂,并在靠近腋窩的上臂上綁止血帶,將經外周靜脈置入中心靜脈導管插入,其中護士手持超聲探頭掃描上臂內側靜脈,評估靜脈的深度、直徑、走行方向、分叉位置及周圍組織,避開靜脈竇、平行動靜脈和異常靜脈,用超聲探頭輕輕按壓靜脈,檢查靜脈內是否有血栓,評估靜脈彈性,確定穿刺靜脈通暢,標記預穿刺點并取下止血帶。在選擇靜脈穿刺時,首選上臂貴要靜脈,其次是肘正中靜脈。測量從預穿刺點到右胸鎖關節再回到第三肋間的長度,并記錄為經外周靜脈置入中心靜脈導管插入長度。根據選定的靜脈直徑確定經外周靜脈置入中心靜脈導管型號后建立最大的無菌區,按7步清洗法洗手,佩戴一次性無菌口罩。檢查經外周靜脈置入中心靜脈導管的完整性,護士打開經外周靜脈置入中心靜脈導管穿刺專用敷料袋,戴無菌手套,助手以穿刺點為中心,按順時針、逆時針、順時針順序對患者手臂進行消毒,以穿刺點為中心的消毒直徑不小于20 cm,待手臂干燥。經外周靜脈置入中心靜脈導管插入術護士將無菌治療包放在患者手臂下方,將無菌巾放在患者上臂,并露出經外周靜脈置入中心靜脈導管穿刺點,隨后要建立最大的無菌區,應嚴格按照打開無菌物品的方法,通過外周插管打開超聲血管穿刺包、中心靜脈導管包及附件、塞丁格爾(Seldinger)穿刺包和無菌注射器,并將其交給插管護士,由插管護士將無菌物品有序地放置在無菌區。放置預沖洗經外周靜脈置入中心靜脈導管及試劑盒:經外周靜脈置入中心靜脈導管護士用20 mL無菌注射器吸取無菌生理鹽水,預沖洗經外周靜脈置入中心靜脈導管,觀察經外周靜脈置入中心靜脈導管是否完整;導管外側注入生理鹽水。放置無菌探頭蓋:在助手的幫助下,插管護士在超聲探頭上涂抹適量的無菌耦合劑,打開無菌探頭蓋在超聲探頭上。檢查無菌蓋與無菌探頭之間無氣泡后,導管插入室護士用無菌橡皮筋固定無菌蓋,助手協助經外周靜脈置入中心靜脈導管插入,護士將無菌蓋包裹的探頭連接線正確放置在無菌區。導針器的安裝:插管護士根據靜脈評估結果,選擇最佳的導針器型號,將導針正確安裝在探頭的突出部分上,保持穿刺針針尖的斜面向上,并將其輕輕插入導針槽中,護士為患者系上了無菌止血帶,在穿刺點附近均勻涂抹適量的無菌耦合劑,穿刺前,在超聲引導下再次評估和確定穿刺靜脈,并將選定的靜脈固定在超聲血管儀顯示屏上綠色標記的中心位置。靜脈穿刺:插管護士一只手固定探頭,另一只手進行靜脈穿刺,并用眼睛觀察血管超聲屏幕,當血管超聲儀顯示屏上靜脈出現亮點,暗紅色血液從針尾緩慢流出時,說明穿刺針前端已進入靜脈,插管成功。推導絲:靜脈穿刺成功后,導管插入室護士一只手固定超聲探頭,另一只手將導絲從穿刺針尾部伸入靜脈,導絲順利進入靜脈后,緩慢減小穿刺針的進針角度,然后繼續緩慢、輕柔地推動導絲,當導絲進入靜脈約10 cm時,將穿刺針與探頭分離,取出探頭,固定導絲,拔出穿刺針,松開止血帶后緩慢均勻地推動導絲。如果推動過程中有阻力,則不能強行推動。如果導絲推不動,導管插入護士應及時將導絲與穿刺針一起拉出體外,以避免切斷穿刺針前端的導絲,導致導絲在體內折斷。局部麻醉及皮膚擴張:助理協助護士用0.10~0.20 mL 2%利多卡因,在穿刺點皮下注射,對穿刺點周圍的局部組織進行臨時麻醉,注射完成后,將無菌紗布放在導絲下,護士用手術刀在穿刺點切開皮膚,達到擴大穿刺部位的效果,使插管鞘沿導絲順利插入靜脈,皮膚切開時,手術刀應與導絲保持平行。取出擴張器和導絲:插管鞘沿導絲插入靜脈后,擴張器與插管鞘分離,取出擴張器和導絲,然后用拇指堵住插管鞘口,以減少出血,然后檢查導絲的完整性,緩慢且均勻地將導管通過插管鞘置入靜脈。當導管插入靜脈約15 cm時,要求患者面向放置導管的護士一側,并將下頜閉合至穿刺側肩部,護士繼續將導管引入靜脈,直到測量長度,然后取下插管護套和支撐導絲,護士用無菌紗布壓迫穿刺點以達到止血和固定導管的效果,然后緩慢、平直地抽出支撐導絲,修剪導管并安裝連接器,在離體外穿刺點6 cm處將連接器的金屬手柄與導管連接,并確保導管完全覆蓋金屬手柄,沖洗、固定導管,置管護士整理用物、洗手、摘一次性口罩、帽子,填寫患者PICC置管記錄并整理保存。試驗組:在dongsoft pads工作站上打開患者圖像,選擇三維重建圖像讀取患者數據。采用美國bard公司生產的單腔三通閥型外周中心靜脈置管導管治療兩組患者。導管采用硅膠制成,規格4DR,長度65 cm。兩組均在超聲引導下采用Seldinger技術。同一臺夏普7型B超機用于導管治療。收集本院患者的CT資料并由本院放射科固定專職人員采集患者的影像資料。在CT上測量右胸鎖關節到心臟陰影右上緣的垂直距離,并記錄值。在試驗組中,患者呈仰臥位,手臂伸出呈85°角。護士測量從穿刺點到右胸鎖關節的CAJ值,再加上CT測量的CAJ值。插管后,攝X線片多層CT層析成像技術定位導管。氣管隆凸下0.80~2.00胸椎單位數標準可作為上腔靜脈1/4下段的參考范圍。90例CT掃描多層CT層析成像技術定位圖確定外周中心靜脈置管最佳位置的標準準確率為90.8%[5]。鑒于接受外周中心靜脈置管導管治療的患者每日大部分時間保持直立或仰臥位,外周中心靜脈置管導管治療終點的確定是基于靜態直立位胸片的X線多層CT層析成像技術定位。本研究以一次穿刺成功為基礎,比較兩種方法的準確性。
1.4 試驗指標 比較兩組肺癌患者術中外周中心靜脈置管置入一次到位率以及患者滿意度,并比較肺癌患者術后患機械性靜脈炎人數。
1.5 統計學分析 采用SPSS18.0對數據進行分析,計數資料用率(%)表示,組間比較采用χ2檢驗,P<0.05差異有統計學意義。
2 結果
試驗組肺癌患者術中外周中心靜脈置管置入一次到位率以及患者滿意度高于對照組肺癌患者(P<0.05),試驗組機械性靜脈炎人數低于對照組(P<0.05)。見表1。
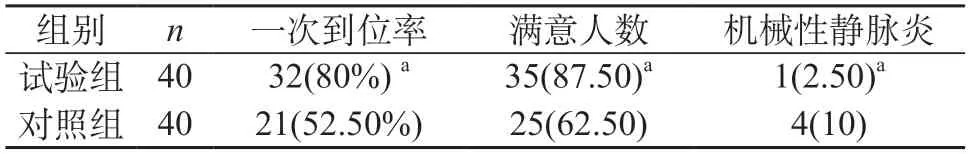
表1 兩組患者觀察指標比較[n(%)]
3 討 論
經外周靜脈置入中心靜脈導管是一種導管置入技術,其中使用引導針通過外周靜脈(貴要靜脈,肱靜脈,頭靜脈)置入一根由硅膠材料制成的中心靜脈導管。經外周靜脈置入中心靜脈導管上有刻度標記,能夠進行放射顯影,使其尖端位于上腔靜脈,自1973年以來,經外周靜脈置入中心靜脈導管技術作為一種營養支持方式,在國外進入臨床市場。自1983年以來,經外周靜脈置入中心靜脈導管一直用于靜脈治療。經外周靜脈置入中心靜脈導管于1988年首次應用于臨床實踐。目前,經外周靜脈置入中心靜脈導管已超越其他類型的長期靜脈通路,成為對患者外周大靜脈輸液的首選方法,截至目前,經外周靜脈置入中心靜脈導管的使用僅次于急診中的中心靜脈導管。自1996年以來,經外周靜脈置入中心靜脈導管插入術已在中國實施。經外周靜脈置入中心靜脈導管是一種用途廣泛的長期中心靜脈導管,可用于臨床藥物治療、血樣采集、全腸外營養、血液透析等方面。此外,有我國臨床研究人員發現,惡性胸腔積液患者經外周靜脈置入中心靜脈導管引流和藥物注射后,可以提高患者生活質量,減少或消除患者由胸腔積液引起的不適;有研究學者采用經外周靜脈置入中心靜脈導管腹腔置管聯合卡托普利或氯沙坦治療肝硬化頑固性腹水,取得了良好的臨床治療效果。由于經外周靜脈置入中心靜脈導管治療復發率低,并發癥少,與其他治療方法相比,經外周靜脈置入中心靜脈導管具有明顯的優勢。經外周靜脈置入中心靜脈導管可放置在放射科床邊的靈活位置,需要患者的知情同意,并由特殊具有經外周靜脈置入中心靜脈導管專科培訓證書的放射科醫師或專科護士放置。由于經外周靜脈置入中心靜脈導管易于操作,具有多種用途和臨床應用,并且在住院患者中,外周置入中心靜脈導管(經外周靜脈置入中心靜脈導管)的使用急劇增加,因此準確定位經外周靜脈置入中心靜脈導管尖端非常重要。美國靜脈輸液協會建議經外周靜脈置入中心靜脈導管尖端應位于上腔靜脈下方1/3處,理想位置是上腔靜脈和右心房的連接處。由于上腔靜脈較短,其下1/3范圍較小,只有2~3 cm。然而,由于患者和疾病的個體原因,經外周靜脈置入中心靜脈導管容易在小范圍內脫落,容易使經外周靜脈置入中心靜脈導管尖端離開美國靜脈輸液協會推薦的位置,從而增加經外周靜脈置入中心靜脈導管相關并發癥的發生率。同時,經外周靜脈置入中心靜脈導管尖端位置太深或太淺,可能導致患者發生嚴重的經外周靜脈置入中心靜脈導管相關并發癥,如心律失常。經外周靜脈置入中心靜脈導管相關并發癥增加了患者臨床時間和成本,如果臨床醫護人員不注意導管相關并發癥,其可能會導致嚴重后果,甚至死亡。臨床為了將這些導管相關并發癥的發生率降至最低,并最大限度地提高經外周靜脈置入中心靜脈導管的治療效果,經外周靜脈置入中心靜脈導管的尖端應置于上腔靜脈的下1/3處,或右心房。大多數經外周靜脈置入中心靜脈導管由護士放置在患者床邊,在使用導管之前,需要放射科醫師對經外周靜脈置入中心靜脈導管末端位置進行X射線確認。當經外周靜脈置入中心靜脈導管置于床旁時,經外周靜脈置入中心靜脈導管尖端異位率可達37.23%。例如,經外周靜脈置入中心靜脈導管尖端進入對側無名靜脈或頸靜脈,因此臨床需要重新調整經外周靜脈置入中心靜脈導管位置,并可能需要X射線再次確認。由于經外周靜脈置入中心靜脈導管尖端的位置不正確,需要一種新的經外周靜脈置入中心靜脈導管引導技術來輔助床邊經外周靜脈置入中心靜脈導管插管。然而,所有當前的引導技術,對經外周靜脈置入中心靜脈導管來說都有其固有的局限性,因為臨床試圖根據生理測量,或體表標記,找到患者血管的解剖位置。因此,臨床需要一種基于血管解剖學的非X射線方法,來準確指導床旁經外周靜脈置入中心靜脈導管置管的操作。目前臨床隨著靜脈治療發展,國內許多學者都采用多種體表預測方法結合X-ray多層CT層析成像技術定位來確定患者導管尖端的位置[6]。為避免體表測量的誤差,國外一直采用ECC多層CT層析成像技術定位法來確定導管尖端的最佳位置,我國一些科研單位也開發了這項技術,但采用ECC多層CT層析成像技術定位法來確定導管尖端的最佳位置,這一技術未得到充分的發展[7]。然而,ECC多層CT層析成像技術定位法技術可用于指導導管插入術來預測患者心電圖中P波導管尖端位置,但ECC多層CT層析成像技術針對目前各種外周中心靜脈置管預測中存在的問題,對P波無法誘發的患者仍有局限性[8]。筆者科室使用患者原始的CT影像資料,不增加患者的費用和再輻射,對一些特殊的人群也可以很好地測量導管的長度,增加患者的舒適度并降低患者的費用[9-10]。兩組患者導管尖端到位率、機械性靜脈炎發生率及患者滿意度均有顯著性差異。這種測量方法可以實現對某些特殊疾病患者的精確測量。由于部分患者的脊柱側凸和肋間隙因疾病因素而增大或減小,胸部體表面積的測量不能滿足這部分人群的需要[11]。綜上所述,對肺癌患者來說,CT技術應用于胸鎖關節到心臟陰影右上緣的垂直距離來預測外周中心靜脈置管置入長度的效果較好,可以有效改善肺癌患者一次到位率和改善肺癌患者臨床滿意度,故對肺癌患者應采取CT技術應用于肺癌患者來預測外周中心靜脈置管置入長度。

