煙草抗冷相關基因在兩種不同育苗方式下的低溫應答差異分析
陳千思,方 明,李澤鋒,劉金燕,周會娜,侯建林,李 軍,吳文信,李思軍
1.中國煙草總公司鄭州煙草研究院,鄭州高新技術產業開發區楓楊街2號 450001 2.湖南省煙草公司郴州市公司,湖南省郴州市北湖區燕泉北路61號 423000
漂浮育苗技術具有育苗成本低、質量好和產量高的優點,是我國煙草生產中采用的一種主要育苗方式[1-3],但該方法存在抗逆抗病性差、苗期延長和根系發育遲緩等問題[4]。在我國南方的部分煙區,煙苗移栽前后氣溫偏低、光照不足,故這些問題尤為明顯[5]。湘南煙區在漂浮育苗技術的基礎上通過長期實踐探索發展出水旱兩段式育苗技術,該技術能顯著促進烤煙苗期不定根的生長,提高壯苗率、縮短緩苗期、提高成苗質量,還能有效降低倒春寒的低溫天氣對烤煙苗期生長的不利影響,提高其在低溫脅迫下的成活率和抗逆性[1,6-8],在湖南郴州、永州等煙區得到了大面積推廣。
低溫是限制植物生長的主要環境脅迫之一,可導致植物細胞膜固化,破壞蛋白質復合物的穩定性并影響光合作用,導致作物減產[9]。植物通過激活相關的低溫響應基因,調節脂質組成、糖和可溶性蛋白含量、植物激素水平來適應低溫環境[10-11]。其中CBF轉錄因子又稱為脫水響應元件結合蛋白1(Dehydration Responsive Element Binding 1,DREB1),在高等植物冷馴化中發揮關鍵作用[12]。CBF家族成員CBF1~CBF3串聯排列在擬南芥基因組第4號染色體的8.7 kb區域[13],Maruyama等[14]發現CBF1基因表達受低溫脅迫誘導,過表達CBF1基因的擬南芥植株具有較強的抗凍性。Gilmour等[15]發現過表達CBF3基因的轉基因植株具有更高的干旱、鹽和冰凍脅迫耐受性。此外,一些冷誘導相關轉錄因子與CBF類似,它們在低溫脅迫下誘導COR基因的表達,從而提高植物的耐寒性[16]。目前的CBF通路模型為CBF1~CBF3響應低溫快速誘導,隨后CBF靶向基因CBF-regulon的表達發生改變,抗凍性提高[17]。研究表明,多個CBF-regulon轉錄因子受First wave基因(如HSFC1、ZAT12、ZAT10、ZF和CZF)的誘導,其中HSFC1、ZAT12、ZF和CZF基因可獨立于CBF途徑啟動植物抗低溫應答[18]。NtbHLH123轉錄因子可激活NtCBF、活性氧(Reactive Oxygen Species,ROS)清除相關基因(NtAPX、NtSOD和NtCAT)和脅迫應答基因(NtLEA5、NtERD10C和NtERD10D),作為抗低溫的正調節因子,提高煙草抗凍性[19]。然而,目前水旱兩段式育苗方式提高煙苗抗低溫脅迫能力的分子機制尚不明確。為此,基于實時熒光定量PCR(Quantitative Real-time PCR,qRT-PCR)技術,系統分析兩種育苗方式(水旱兩段式育苗和漂浮式育苗)煙草CBF和抗冷相關轉錄因子基因在低溫脅迫下的表達模式差異,旨在篩選煙草受低溫響應的關鍵轉錄因子,明確兩種育苗方式在低溫脅迫下的響應模式差異,為闡明水旱兩段式育苗提高煙草抗低溫能力的分子機制提供理論依據。
1 材料與方法
1.1 材料、試劑和儀器
試劑:EASYspin Plus植物RNA快速提取試劑盒(Lot No.RN3802,北京艾德萊生物科技有限公司);反轉錄試劑盒Transcriptor First Strand cDNA Synthesis Kit(Lot No.04897030001)和qRT-PCR試劑 盒FastStart Essential DNA Green Master(Lot No.06924204001)(瑞士羅氏公司)。
儀 器:LightCycler 96實時 定 量PCR儀(Lot No.05815916001,瑞士羅氏公司),勁力冷藏柜(Lot No.G1000LSF,中山市勁力冷凍設備制造有限公司)。
引物合成:生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 煙草材料種植
實驗材料按照湖南省煙草公司郴州市公司《烤煙水旱兩段式育苗技術規程》[Q/CZYC-J-ZD-JS-02(2018)]和《烤 煙 漂 浮 育 苗 技 術 規 程》[Q/CZYC-J-ZD-JS-01(2018)]進行育苗。育苗在國家煙草基因研究中心溫室進行,溫度25℃,相對濕度40%,光周期為16 h光照/8 h黑暗。
1.2.2低溫處理和樣品采集
實驗設置4組處理(漂浮式育苗、水旱兩段式育苗、冷處理漂浮式育苗、冷處理水旱兩段式育苗),3次生物學重復,每個重復至少6株。每株取頂部的第3和第4片真葉,取樣后液氮速凍,-80℃保存。冷處理流程:在煙苗長至八葉一心(約60 d)時,對煙苗進行低溫(模擬冷害)處理,時長為3 h,溫度為4℃,相對濕度為95%,低溫處理后轉移至室溫,16 h光照/8 h黑暗交替條件下生長,不使用化學調控劑。
此模塊包括學校人事檔案信息管理、教學檔案信息管理、科研項目與成果檔案信息管理、各職能部門相關政策文件檔案信息管理等子系統。各類檔案數據信息都以相對獨立又可通過關聯字段相互關聯的關系數據庫文件形式存在,其數據庫結構由前述各職能部門的管理信息系統結構設計時一并形成,其庫中數據多由前述各子系統運行中自動歸檔而成,也有部分由本模塊管理員依據實情審核后上傳。
1.2.3 煙草中CBF基因家族
根據文獻[13,20-23]選取擬南芥(Arabidopsis thaliana)CBF基因及其蛋白序列,并參考Zhao等[19]的方法,選取煙草CBF基因及其蛋白序列(ftp://ftp.solgenomics.net/genomes/Nicotiana_tabacum/)。
利用TBtools軟件(https://github.com/CJ-Chen/TBtools/releases)對獲得的煙草CBF蛋白的氨基酸序列進行比對。
1.2.4 煙草中CBF基因系統發育分析
使用ClustalX V2.0軟件并用其默認參數對篩選出的煙草CBF基因的氨基酸序列與擬南芥CBF基因的氨基酸序列進行CBF蛋白的多序列比對。
使用MEGA 7.0軟 件,采 用鄰 近 法(NJ,Neighbor-Joining method)構建系統發育進化樹,采用p-distance模型,校驗參數(Bootstrap)設置為1 000,其余均為默認參數。
1.2.5 煙草中CBF基因結構分析
使用在線基因結構顯示軟件Gene Structure Display Server v2.0(GSDS:http://gsds.cbi.pku.edu.cn/)繪制煙草CBF基因家族基因的內含子-外顯子結構顯示圖。利用MEME(http://meme-suite.org/tools/meme)在線分析軟件,使用默認參數查詢、分析由煙草CBF基因編碼的蛋白質中的保守結構域,使用TBtools軟件繪制保守結構域圖。
1.2.6 煙草中CBF基因啟動子順式作用元件分析
提取CBF基因上游2 000 bp,利用在線工具PlantCARE對順式作用元件進行搜索鑒定(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)[24]。其中,NtCBF1上游序列過短,未開展相關分析。
1.2.7 煙草中抗冷相關基因qRT-PCR分析
對冷處理前后兩種育苗方式煙草中CBF、CBF-regulon相關基因及非CBF-regulon相關基因等抗冷相關基因進行qRT-PCR分析。將1.2.2節中采集的樣品用液氮冷凍研磨成粉末,使用植物RNA快速提取試劑盒和反轉錄試劑盒進行RNA抽提和反轉錄,將反轉錄的cDNA稀釋至400 ng/μL。選取基因特異引物[19](表1),利用qRT-PCR方法,取1 μLcDNA用于基因定量分析的模板,用煙草EF1α基因(GenBank ID:NM001326165)作為內參,3次技術重復。依照qRT-PCR試劑盒說明書的操作步驟和反應程序,使用qRT-PCR儀對抗冷相關基因進行定量分析。數據分析采用2-ΔΔCT方法進行,并進行3次生物學重復。利用GraphPad軟件(Version 9.3.0)繪制實時柱形圖,并分析顯著性。

表1 引物信息Tab.1 Primer information

表1 (續)
2 結果與討論
2.1 煙草CBF基因家族的結構特征、保守結構域及啟動子順式作用元件分析
對煙草的21個CBF基因和擬南芥的6個CBF基因的全長氨基酸序列進行了多重序列比對,并構建進化樹,結果表明,煙草NtCBF15、NtCBF16、NtCBF17、NtCBF18、NtCBF19、NtCBF20和NtCBF21基因與擬南芥的CBF5和CBF6基因進化關系較近,而其余的煙草CBF基因則與擬南芥CBF1、CBF2、CBF3和CBF4基因進化關系相近(圖1)。為研究煙草CBF基因家族成員的基因結構,分析了煙草CBF基因家族的外顯子/內含子結構和保守基序,結果表明煙草CBF家族成員中除了NtCBF14基因含有一個內含子和兩個外顯子以外,其余成員均只含有一個外顯子(圖1)。
比較分析煙草CBF基因的全長蛋白質序列,確定蛋白結構域。結果顯示,煙草CBF基因家族的所有成員均具有Motif 1、Motif 2、Motif 4和Motif 5這些保守的蛋白結構域(圖2),表明煙草CBF基因家族在進化過程中較為保守。

圖1 煙草CBF基因的系統發育進化樹和基因結構Fig.1 Phylogenetic tree and gene structures of NtCBFs
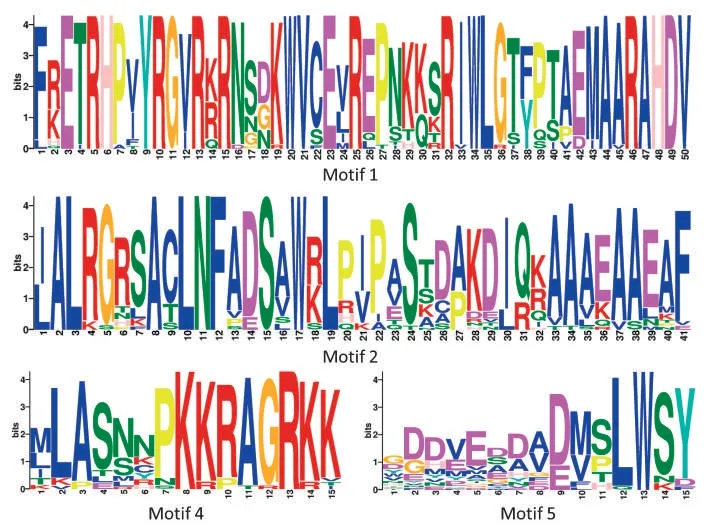
圖2 煙草CBF基因的蛋白結構域Fig.2 Protein domains of NtCBFs
對煙草CBF基因啟動子序列進行順式作用元件分析,發現煙草CBF基因上游啟動子區存在生長發育、激素響應和脅迫響應等相關的順式作用元件,其中光響應相關元件最多,其次為脫落酸響應、茉莉酸甲酯響應及厭氧誘導等相關元件。NtCBF3、NtCBF4、NtCBF5、NtCBF6、NtCBF10、NtCBF13、NtCBF14和NtCBF18等8個基因啟動子序列分布有低溫響應相關元件(圖3)。

圖3 煙草中CBF基因啟動子順式作用元件Fig.3 Cis-acting elements of CBF promoters in tobacco
2.2 兩種育苗方式下的煙草CBF基因家族的低溫應答分析


圖4 冷處理后兩種育苗方式的煙草CBF基因表達量分析Fig.4 Expression levels of NtCBFs under two seedling cultivation methods after cold treatment
分析低溫處理前后兩種育苗方式下煙草CBF基因家族表達量的變化(圖4),發現相較常規漂浮育苗,水旱兩段式育苗中NtCBF2、NtCBF3、NtCBF4、NtCBF5、NtCBF6、NtCBF9、NtCBF10、NtCBF11、NtCBF12、NtCBF13、NtCBF14、NtCBF20和NtCBF21基因的表達量顯著提高,表明水旱兩段式育苗中NtCBFs基因表達量更高;而低溫處理后,相較常規漂浮育苗,水旱兩段式育苗中NtCBF5、NtCBF12和NtCBF13基因的表達量顯著提高,推測NtCBF5、NtCBF12和NtCBF13基因可能與水旱兩段式育苗的抗低溫脅迫能力的提高有關。
2.3 兩種育苗方式下的煙草CBF-regulon基因的低溫應答分析
對煙草CBF-regulon基因NtRD29A、NtRD29B和NtGOLS3在兩種育苗方式下的低溫應答進行分析(圖5),發現相較常規漂浮育苗,水旱兩段式育苗中NtGOLS3和NtRD29A基因的表達量顯著升高;而低溫處理后,相較常規漂浮育苗,水旱兩段式育苗中NtGOLS3、NtRD29A和NtRD29B基因的表達量均顯著升高。推測水旱兩段式育苗可通過調控CBF-regulon基因NtGOLS3、NtRD29A和NtRD29B提高水旱兩段式育苗的抗寒能力。

圖5 冷處理后兩種育苗方式的CBF-regulon相關基因表達量分析Fig.5 Expression levels of CBF-regulon related genes under two seedling cultivation methods after cold treatment
2.4 煙草非CBF-regulon相關基因的低溫應答分析
對8個煙草非CBF-regulon基因在兩種育苗方式下的低溫應答進行分析(圖6A),發現水旱兩段式育苗的NtERD10C表達量比常規漂浮育苗顯著降低,而其他7個基因均無顯著差異。同時,對5個First wave基因在兩種育苗方式下的低溫應答進行分析(圖6B),低溫處理后,水旱兩段式育苗的NtZAT12表達量比常規漂浮育苗顯著降低,其他4個基因均無顯著差異。綜上,未發現有非CBF-regulon基因表達量在兩段式育苗中高于常規漂浮育苗,推測水旱兩段式育苗抗寒能力的提高可能不依賴于非CBFregulon途徑。

圖6 冷處理后兩種育苗方式的非CBF-regulon相關基因表達量分析Fig.6 Expression levels of non-CBF-regulon related genes under two seedling cultivation methods after cold treatment
3 結論
系統分析21個煙草CBF基因進化關系、基因結構、蛋白質保守結構和啟動子的順式作用元件,發現煙草CBF基因進化上相對保守,可響應生長發育、激素響應和脅迫等多種信號,其中NtCBF3、NtCBF4、NtCBF5、NtCBF6、NtCBF10、NtCBF13、NtCBF14和NtCBF18等8個基因具有低溫響應元件。低溫脅迫下基因表達模式分析結果顯示,煙草NtCBF5、NtCBF12和NtCBF13及CBF-regulon相 關基因NtRD29A、NtRD29B和NtGOLS3在低溫處理后表達量顯著升高,在煙草水旱兩段式育苗的抗低溫脅迫過程中發揮了重要作用。

