基于整合藥理學策略及藥效驗證探討交泰丸抗心律失常分子機制*
陳金紅,劉志超,樊博雅,梁嘉鈺,鄧芳雋,李曉鳳,叢紫東,杜武勛**
(1. 濰坊醫學院康復醫學院 山東 261053;2. 天津中醫藥大學研究生院 天津 301617;3. 天津中醫藥大學第二附屬醫院 天津 300150)
1 引言
心律失常是一種由心臟電傳導系統引起的心臟電生理活動異常,從而導致心臟興奮頻率或節律異常的疾病,主要表現有心悸、心慌、胸悶、頭暈等[1-2]。心律失常的出現常提示潛在的心臟疾病,或是非心臟病變。當今社會隨著生活和工作壓力增大,心律失常發病率呈逐年增長趨勢,病死率也日漸攀升[3]。流行病學調查顯示,通過24 h 或48 h 動態心電圖檢測,室早的檢出率高達40%-75%[4]。此外,2016 年、2017 年和2018 年心房顫動導管消融占總消融手術的比例分別為23.1%、27.3%和31.9%[5]。近幾十年來,雖然射頻消融術等非化學藥物治療方法不斷涌現,但藥物治療仍然是最常用的治療方法。然而,抗心律失常藥物的致心律失常作用亦不容忽視[3],其間,中醫藥因其療效顯著,且不良反應少而在抗心律失常方面發揮著越來越重要的作用[6]。
心律失常屬于中醫“心悸”“怔忡”“驚悸”范疇,現代醫學將心悸分為心虛膽怯證、心脾兩虛證、陰虛火旺證、心陽不振證、水飲凌心證、瘀阻心脈證、痰火擾心證等證型[7]。交泰丸為心腎不交證的代表方劑,其中黃連苦寒,入心經,降心火;肉桂辛熱,入腎經,暖腎水,如此交通心腎,治療心火燔盛、腎陽不足導致的怔忡、心悸、失眠等疾病。《素問·六微旨大論》言:“出入廢則神機化滅,升降息則氣立孤危。故非出入,則無以生長壯老已;非升降,則無以生長化收藏。”“升降出入,無器不有。”可見氣機的升降出入是生命活動的基本形式,如肺主肅降,腎主納氣,脾主升清,胃主降濁,心火下潛,腎水上騰,肝氣升發,膽汁降泄等等。由于升降有序,出入衡常,故能動靜相召,上下相臨,陰陽交泰,氣血和暢,生生化化,品物咸章。“一氣周流”理論是黃元御學術思想的高度概括,《四圣心源》是其在精熟《黃帝內經》、《難經》、《傷寒論》、《金匱要略》等經典基礎上,結合自身臨證經驗著成的代表著作。《四圣心源·神驚》[8]有:“神發于心而交于腎,則神清而不搖,神不交精,是生驚悸,其原由于膽胃之不降。”脾氣左升,膽火右降,則上下水火相濟,陰陽和合,神清而心寧。若脾陷胃逆,相火浮動,灼傷心陰,致心火外泄,腎水不溫,使上下分崩,一氣不能循環周流,終致心神被擾,發為心悸。由此看來,心腎不交是導致心律失常的重要機制,以黃連-肉桂為代表的藥對組合,其意在“心”與“腎”水火陰陽的相互交通,清上溫下,使心火下潛,腎陽固藏,從而使心神有根而得以養。
2 研究思路與方法
整合藥理學是揭示多組分藥物的多靶標作用特征背后的復雜藥理機制的方法之一[9]。眾所周知,中藥復方因其具有多種成分,可通過多種靶向作用發揮其臨床功效,因此具有多種藥理作用[10]。導師杜武勛教授多年來致力于氣化理論及該理論指導下的對心律失常治療作用的機制研究,在中藥臨床有效性的基礎上,深入開展中藥復方對心律失常作用機制的挖掘和評價。為了系統的從分子水平揭示交泰丸治療心腎不交型心律失常的作用機制,建立藥物-靶標-疾病之間的模塊關聯,本文通過中醫藥整合藥理學研究平臺,從微觀生物層面篩選交泰丸抗心律失常的關鍵活性成分和靶標,對交泰丸治療心律失常的分子機制進行探討及分析,并結合動物實驗分析其在關鍵藥效機制上相關分子水平,以闡釋其新的研究方向(圖1)。
3 研究與分析
3.1 基于TCMIP的交泰丸抗心律失常分子機制研究
3.1.1 數據庫的建立
利用整合藥理學平臺[11](http://www.tcmip.cn/)的中藥活性成分數據庫,結合2015年版《中國藥典》規范藥材命名及成分名稱,進行虛擬數據資料建庫。檢索“黃連”“肉桂”,保留活性成分與靶點,自主命名數據,作為備用。
3.1.2 中藥化學成分來源及靶標預測
通過TCMIP 中“中藥靶標預測及功能分析”模塊及手工檢索目標藥物活性成分,收集交泰丸中黃連、肉桂的化學成分,并將其二維結構(mol)與DrugBank(https://www. drugbank. ca/)數據庫中認證藥物(approved)進行化學指紋比對,利用Tanimoto 系數對結果進行評分,選定評分>0.8 的作為交泰丸的潛在機制靶標[12]。
3.1.3 疾病、證候靶標預測
以“Arrhythmia”為疾病關鍵詞,在GeneCard(https://www.genecards.org/)數據庫、DisGENET 數據(https://www. disgenet. org/)、DrugBank 數 據 庫(https://www.drugbank.ca/)、OMIM 數據庫(https://omim.org/)檢索疾病相關靶標,利用Uniprot 數據庫(https://www.uniprot.org/uniprot/)轉換蛋白名稱,獲取基因名稱。最后利用Microsoft Office Excel 進行合并去重,建立疾病數據庫。
再以“Arrhythmia”作為疾病關鍵詞錄入整合藥理學平臺疾病/證候靶標數據庫中進行檢索,證素輸入:“心悸”“心煩”“頭暈”“耳鳴”“不寐”“舌紅少苔”“脈細數”等關鍵詞,提取相應證候靶標信息。
3.1.4 PPI網絡構建、關聯網絡可視化及分析
通過整合藥理學平臺的網絡分析模塊蛋白互相作用網絡進行拓撲分析,選取中藥靶點-疾病基因的關鍵節點(hubs),作為交泰丸活性成分的潛在靶點。通過TCMIP 分析平臺對關鍵靶基因進行GO 功能富集分析和KEGG 富集分析,選取統計值P 值排名前20 的通路,構建完整的“中藥-證素-疾病-靶標-通路”多維網絡。利用Jvenn(http://www.bioinformatics.com.cn/static/others/jvenn/example.html)在線繪圖[13],獲取韋恩圖。
3.1.5 結果
(1) 交泰丸化學成分、靶標預測結果及分析
TCMIPV2.0 平臺對黃連、肉桂化學成分的分析結果:黃連共收集了14個化學成分,包括小檗堿(Berberine)、木蘭花堿(Magnoflorine)、黃連堿(Jatrorrhizine)等,其中潛在靶標212 個。肉桂共收集了9 個化學成分,為肉桂醛(Cinnamaldehyde)、丁香酚(Eugenol)、棕櫚油酸(Zoomaric acid)等,其中潛在靶標61個。
對黃連、肉桂候選靶標進行基因功能分析和通路富集分析,發現其具有的功能信息主要有調節胺的運輸、對含氧化合物的反應、腺苷酸環化酶調節性G 蛋白耦聯受體信號通路、兒茶酚胺分泌的調節、血清素受體信號通路、血液循環等。富集到的通路主要有神經活性配體-受體相互作用、鈣信號通路、cAMP 信號通路、花生四烯酸代謝、葉酸生物合成等。
(2) 心律失常疾病靶標及相關基因
研究者將心律失常疾病靶標合并去重后共收集到靶標850個。其中與交泰丸密切相關的共同靶向基因共計9個,如韋恩圖(圖2)。這些靶點的作用機制主要從調控氧化應激[14]、電壓門控K+通道[15]、電壓門控Na+通道[16]、內側前額葉皮層(mPFC)的激活[17]、蛋白激酶A(PKA)[18]、維持結締組織合成與降解之間的平衡[19]、調節鈣離子水平[20]等共同調節作用下發揮作用。

圖2 心律失常疾病靶標及相關基因韋恩圖
(3) 心律失常心腎不交證證素靶標
根據中醫學對心腎不交證的描述,劃分證素包括心悸、心煩、頭暈、耳鳴、不寐、舌紅少苔、脈細數等。其中心悸、心煩包含56 個相關靶標,頭暈、耳鳴、不寐包含111 個相關靶標,舌紅少苔、脈細數包含21 個相關靶標。
(4) 交泰丸治療心律失常的GO富集分析
對交泰丸治療心律失常的候選靶標進行基因功能分析,羅列出P值前20位的條目(表1),其基因功能主要包括基因表達的正調控、MAPK 級聯激活、SRP 依賴的共翻譯蛋白靶向膜、細胞因子介導的信號通路、調節心室心肌細胞動作電位、通過心臟傳導調節心率等方面。

表1 交泰丸治療心律失常的候選靶標的GO富集分析
(5) 交泰丸治療心律失常的KEGG富集分析
對交泰丸治療心律失常的候選靶標進行KEGG富集通路分析,羅列出P值前20位的條目(表2),可見其主要與促紅細胞生成素激活RAS、下游信號轉導、RAF激活、酪氨酸激酶受體2(tyrosine kinase receptor 2,Tie2)信號通路、樹突狀細胞膜表面的一種新型凝集素受體(dendritic-cell specific ICAM-3 grabbing no nintegrin,CD209(DC-SIGN))信號、通過干細胞因子-酪氨酸激酶受體(stem cell factor,SCF- tyrosine kinase receptor,KIT)發出信號等通絡相關。
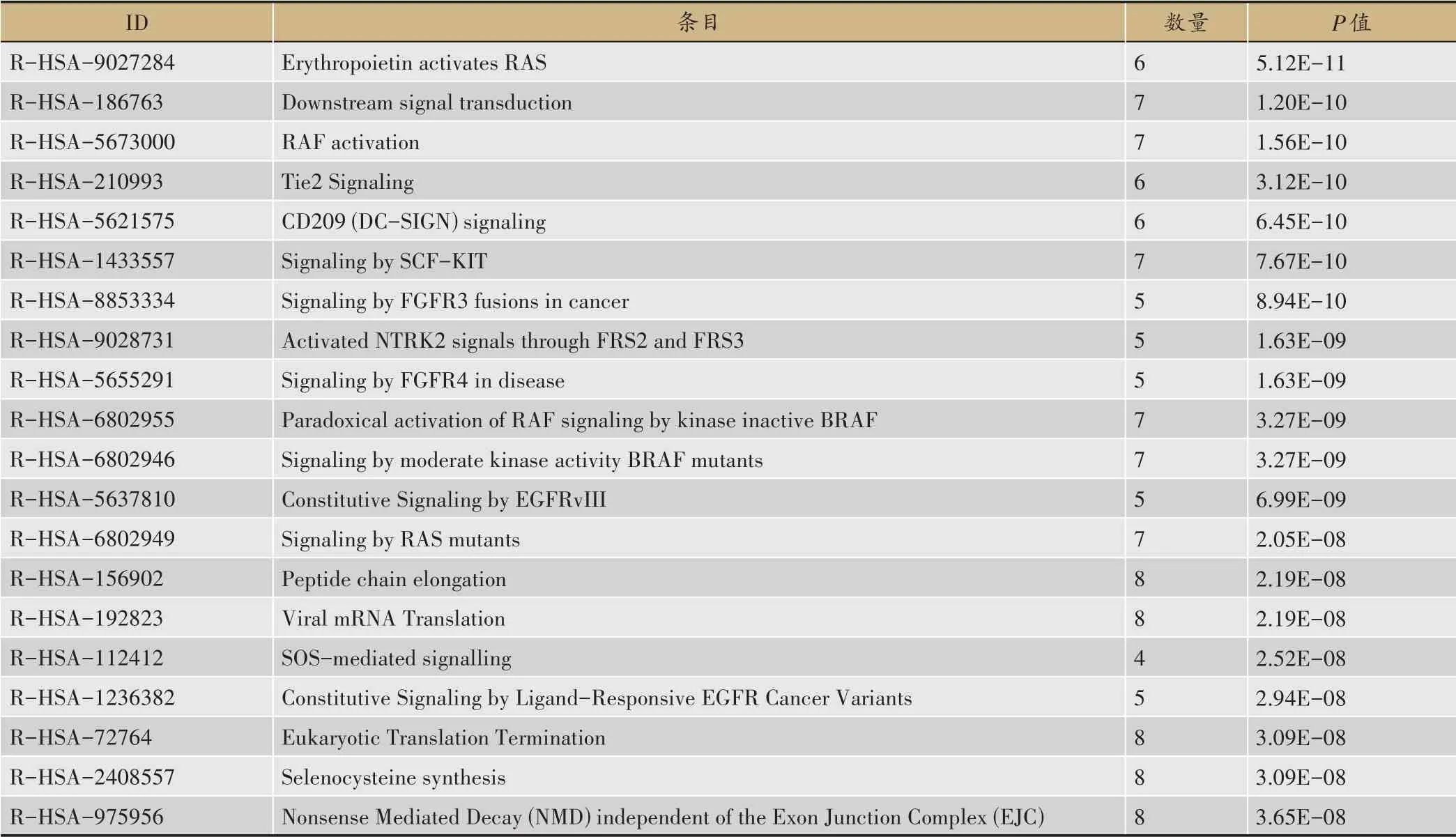
表2 交泰丸治療心律失常候選靶標的KEGG富集分析
(6) 交泰丸治療心律失常的“中藥-證素-疾病-靶標-通路”可視化多維關聯網絡
應用整合藥理學平臺V2.0“中醫藥關聯網絡挖掘”功能,選擇“疾病-證候-方劑”模塊,構建可視化多維關聯網絡(圖3),不同顏色的節點是按照基因間相互作用的緊密度進行聚類。由圖3 可以看出,交泰丸中黃連-肉桂藥對作用于59 個潛在靶標,其通過HRAS、TP53、VHL、PIK3CA、CASR、CREBBP、RAF1、JAK2等核心靶標參與了促紅細胞生成素激活RAS、下游信號轉導、RAF 激活、Tie2 信號通路、CD209(DCSIGN)信號、通過SCF-KIT 發出信號等27 個信號通路。
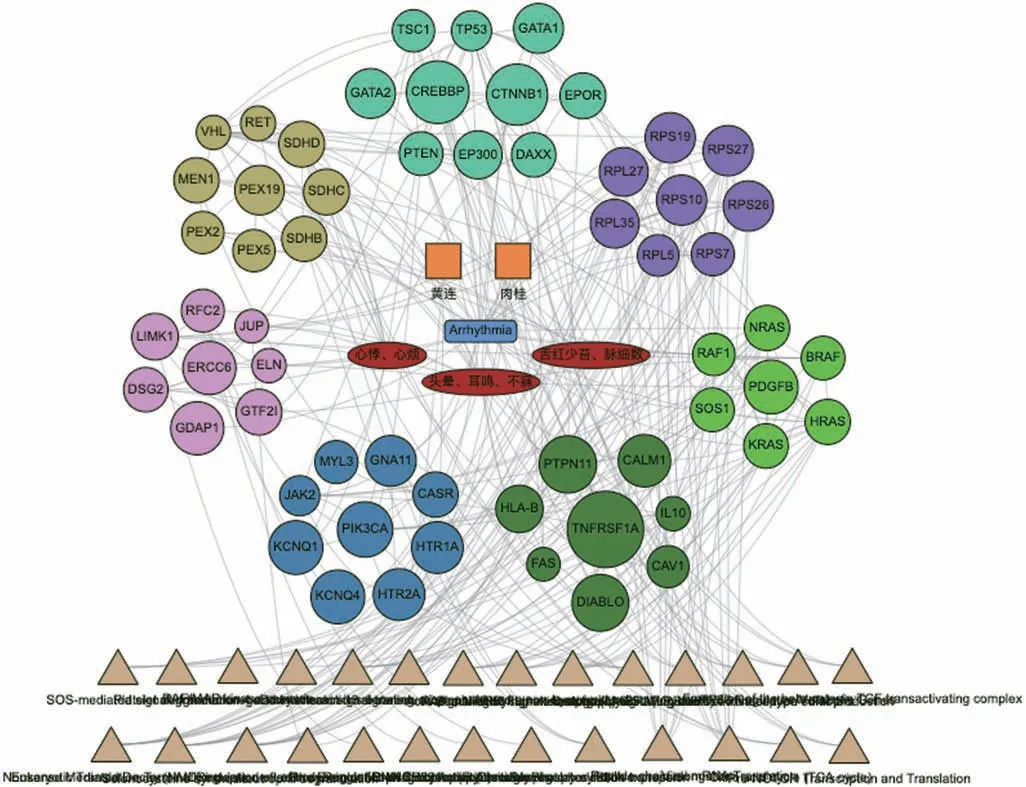
圖3 交泰丸治療心律失常的“中藥-證素-疾病-靶標-通路”可視化多維網絡關聯
3.2 交泰丸通過調控RAS 系統及交感神經活性干預心律失常的藥效研究
3.2.1 實驗材料與動物模型建立
SPF 級健康雄性SD 大鼠32 只(200-240 g),由中國人民解放軍軍事醫學科學院實驗動物中心提供,合格證號SCXK(京)2019-0010,在天津市放射研究所實驗動物中心飼養,適應性喂養1 周后進行實驗。大鼠隨機分為對照組(N)、模型組(M)、交泰丸組(J)、陽性藥組(Meto)4組,每組8只。大鼠給藥劑量按照成人口服劑量進行等效劑量換算[20]:N 組及M 組按10 mL/kg/天灌胃0.9%生理鹽水;J 組按1.7 g/kg/天灌胃黃連(15 g)肉桂(1.5 g)水煎液;Meto 組按2.57 mg/kg/天灌胃酒石酸美托洛爾片(倍他樂克)水溶液。各組于造模前14 天開始按10 mL/kg/天灌胃給藥。最后1 次給藥后30 min,除N 組外,其余各組大鼠稱重,用20%烏拉坦5 mL·kg-1(1 g·kg-1)腹腔注射麻醉,對大鼠進行心電圖監測。記錄基線心電圖10 min 后,以32 μg·kg-1體重尾靜脈推注腎上腺素(Epi)[22],制造心律失常模型,繼續監測心電圖10min。采用酶聯免疫吸附法(ELISA)測定血管緊張素Ⅱ(AngⅡ)、兒茶酚抑素(CST)、神經肽Y(NPY),試劑盒均購買于天津津科生物科技有限公司。
3.2.2 樣本采集
心電圖監測結束后,各組大鼠經眼球后靜脈叢取靜脈血0.5 mL,置于肝素化EP 管中,4℃,3000 rpm 下離心10 min,分離血漿,ELISA 法測定AngⅡ、CST、NPY。
3.2.3 統計學方法
采用SPSS26.0 進行統計學分析,實驗數據以均數±標準差(±s)表示,組間比較采用單因素方差分析,P<0.05表示差異有統計學意義。
3.2.4 結果
(1) 交泰丸抑制Epi誘導心律失常的AngⅡ高表達
與對照組相比,模型組大鼠AngⅡ明顯升高(P<0.01)。交泰丸預處理后,AngⅡ表現出明顯回調趨勢(P<0.01)。倍他樂克預處理后,AngⅡ水平下降(P<0.05)。交泰丸組、陽性藥組與對照組相比已無明顯差異(P>0.05),表明兩組治療后AngⅡ趨于正常范圍,且交泰丸組療效最明顯。
(2) 交泰丸抑制Epi誘導心律失常的CST高表達
與對照組相比,模型組大鼠CST 明顯升高(P<0.01)。交泰丸預處理后,CST 水平呈下降趨勢(P<0.05)。倍他樂克預處理后,CST 水平回調(P<0.05)。交泰丸組與對照組相比已無明顯差異(P>0.05),表明交泰丸治療后CST趨于正常范圍,療效最明顯。
(3) 交泰丸抑制Epi誘導心律失常的NPY高表達
與對照組相比,模型組大鼠NPY 明顯升高(P<0.01)。交泰丸預處理后,NPY 水平呈下降趨勢(P<0.05)。但陽性藥組并未表現出明顯回調(P>0.05)。交泰丸組與對照組相比已無明顯差異(P>0.05),表明交泰丸治療后NPY趨于正常范圍(表3、圖4)。
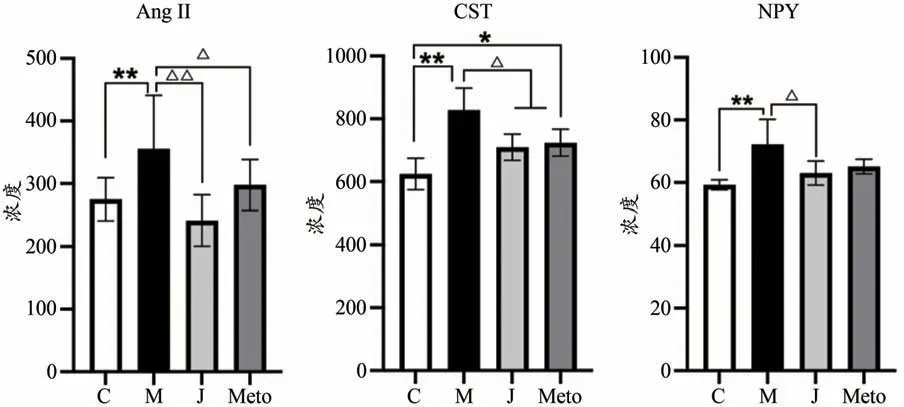
圖4 交泰丸抑制Epi誘導心律失常的AngⅡ、CST、NPY高表達
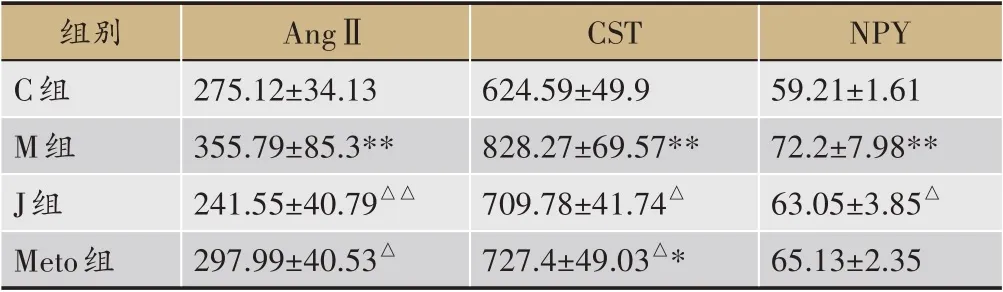
表3 交泰丸抑制Epi誘導心律失常的AngⅡ、CST、NPY高表達
4 討論
黃連已被廣泛應用于各種心腦血管系統疾病中[23],其成分小檗堿的抗心律失常作用在1989 年被首次報道[24]。研究發現,黃連中的小檗堿是有效的抗氧化劑和消炎劑,它可以抑制NOX 2,4的過表達,并在炎性刺激下降低巨噬細胞和內皮細胞中ROS 的產生[25-26]。現代藥理學研究表明,肉桂可以通過增加冠脈流量改善冠脈循環及心肌營養狀況,對冠心病、心律失常等心血管疾病有防治作用[27]。Hwa 等[28]從肉桂中鑒定并提取化合物2-甲氧基肉桂醛(2-MCA),通過實驗證實該化合物能改善成年大鼠缺血再灌注模型的局部缺血/再灌注(I/R)損傷,其機制可能是通過降低TNF-α 活化的內皮細胞中血管細胞黏附分子1(VCAM-1)的表達以及誘導血紅素氧合酶1(HO-1)的生成來實現的。同時,交泰丸可以調控大鼠血液和組織中神經遞質的含量,如促腎上腺皮質激素(ACTH)、促腎上腺皮質激素釋放因子(CRF)、腎上腺分泌的皮質酮(CORT)、5-羥色胺(5-HT)、多巴胺(DA)、去甲腎上腺素(NE)和腎上腺素(E)[29-30],這可能是其實現交通心腎的作用機制之一。此外,本次整合藥理學結果表明,交泰丸不僅可以調節兒茶酚胺的分泌,且與腎素-血管緊張素系統(RAS)關聯密切,RAS是體內重要的內分泌調節系統之一,對心血管系統內環境的穩定有重要影響[31]。血管緊張素Ⅱ(AngⅡ)是RAS 的主要活性成分,局部增多的血管緊張素Ⅱ(AngⅡ)直接或間接刺激交感神經,增強對冠脈和心肌的收縮作用,增加心肌耗氧量,以致能量耗竭,細胞內鈣超載,造成心律失常[32]。不少研究證據表明,抑制RAS 系統可以降低心律失常的風險[33-35]。
基于上述結果,本研究以RAS 系統關鍵活性成分AngⅡ,以及交感神經活性抑制因子CST、神經遞質NPY 為觀察指標,初步驗證交泰丸干預心律失常的藥效途徑。AngⅡ可誘發室性心律失常,參與房顫的發生與維持[36]。多項研究表明,心律失常患者血漿和心臟AngⅡ濃度均較高,阻斷體內AngⅡ生成是緩解心律失常重要環節之一[37-39]。AngⅡ作用于AT1 受體,通過激活重要靶點PKC抑制心肌細胞Ikr/HERG,對心臟電活動和心肌肥厚心衰的發展產生作用[40]。還有研究發現AngII 可以減小Ito電流密度,使心肌復極化變緩,最終導致心律失常[41],多項研究都證實了AngII是心律失常病理生理改變的關鍵環節。本項研究發現模型組大鼠推注腎上腺素后血漿AngⅡ明顯升高,交泰丸相比陽性藥可以更好的抑制這一現象。CST是一種可有效抑制兒茶酚胺釋放與分泌的內分泌神經肽類物質,隨著交感神經系統激活而釋放增加,通過調節心臟副交感和交感神經活性,起到調整心臟功能的作用[42-44]。人類心室肌的神經纖維主要以交感神經為主,交感神經系統活性的升高是室性心律失常發生的重要環節[45-47]。交感神經興奮時,心肌興奮性增加,進而提高心率及血液中兒茶酚胺含量,相關研究表明CST通過作用于孤束核的突觸發揮調節自主神經活性作用,從而改善壓力感受器敏感性和心率變異性[48]。CST的異常改變可通過調節影響心臟功能而加重房顫等心律失常的發病率[49-50]。本項研究發現模型組大鼠推注腎上腺素后血漿CST 明顯升高,說明交感神經被顯著激活,而交泰丸組CST 更接近正常組水平,證明其在病理情況下對交感神經有抑制作用。NPY 是交感神經末梢分泌的神經遞質之一,廣泛分布于神經系統中,與精神類相關疾病密切相關,其作用于突觸前膜Y1、Y2 受體,進而影響心肌自律性,其中主要表現為抑制迷走神經興奮時減慢心率的作用[51-52]。有研究提示血漿NPY 水平是影響心衰患者死亡率的獨立因素[53]。本項研究發現模型組大鼠推注腎上腺素后血漿NPY 明顯升高,提示腎上腺素導致交感神經系統過度興奮,經交泰丸治療后,NPY 水平明顯回調,說明其對自主神經系統有自穩調節功能。
上述幾種物質不是單一作用,而是相互聯系。如AngII 與受體結合后可通過交感神經末梢的正反饋使NPY 分泌增加,交感神經興奮釋放NPY 后,又可誘導CST 的生成[54]。RAS 與交感神經系統是心血管疾病中的重要調節機制和維持動態自穩的核心調控系統,通過調節RAS 系統又可以對交感神經的激活產生影響[55]。近年來越來越多的證據表明兩者在心律失常等心血管疾病診斷治療中的作用[56-57],為心血管疾病的監測與調控提供了新思路。
5 結論
近年來,心律失常成為心源性猝死發生的主要因素之一[58]。導師杜武勛教授在臨證診療中以氣化理論為基礎,以交泰丸為底方,對心律失常具有較好的臨床療效。本研究借助中醫藥整合藥理學研究平臺V2.0 和國際通用靶標、基因數據庫,結合了中藥成分、證候要素、疾病靶標的多層次研究,較為完善的完成了中藥-證素-疾病-靶標-通路的銜接性研究,從分子角度闡釋中藥復方療效內涵。同時,通過腎上腺素誘導大鼠制造心律失常模型,進一步證實交泰丸通過調控RAS 系統與交感神經系統干預心律失常的分子機制,為臨床診療提供思考方向和依據。