光能變價離子鈦對3種馬鈴薯致病菌的抑制作用
肖秋菊,唐 雪,譚 曉,肖星月,童麗穎,邵歡歡,陶 向,雍 彬
(四川師范大學生命科學學院,成都 610101)
【研究意義】馬鈴薯(SolanumtuberosumL.)是世界第四大作物,其種植面積和產量僅次于水稻、小麥和玉米,全球消費量僅次于水稻和小麥。作為世界上馬鈴薯種植面積最大國家之一[1-2],中國近年已將馬鈴薯列為主糧,該作物的安全生產事關國家糧食安全。馬鈴薯生產實踐中多采用塊莖營養繁殖,但營養繁殖會造成致病菌代代相傳并不斷積累,目前已報道的馬鈴薯病害有100多種,每年因病害減產10%~30%,嚴重時減產超過70%。由致病疫霉(Phytophthorainfestans)引發的晚疫病是一種全世界范圍內絕大多數馬鈴薯種植區均有發生的最具毀滅性的病害,曾造成1845—1950年間的愛爾蘭大饑荒[3-5],瘡痂鏈霉菌(Streptomycesscabiei)、茄科雷爾氏菌(Ralstoniasolanacearum)等也會對馬鈴薯安全生產造成嚴重威脅,茄科雷爾氏菌造成的青枯病是馬鈴薯生產中的第二大病害[6-7]。馬鈴薯瘡痂病是一種世界性土傳病害,可由S.scabies、S.acidiscabies、S.turgidiscabies、S.galilacus等多種鏈霉菌引發[8-9]。這3種病害均對馬鈴薯安全生產造成嚴重威脅,有效防控病害是保障馬鈴薯產量及質量的重要途徑。長期以來馬鈴薯病害防控主要依靠噴施農藥,加上我國農業基礎設施建設落后,農民安全用藥意識薄弱,大量使用化學農藥與化學肥料,造成嚴重的農殘超標、土壤殘留、病原菌抗藥性增強和生態環境破壞等問題,環境友好型抑菌農藥的研制極為迫切。為此,我國在農業“十三五”規劃中明確提出化學肥料和農藥“雙減”目標,推動農業可持續發展和食品安全生產。靶向馬鈴薯病害的化學農藥替代品的研發與應用可為保障我國農業綠色生產及實現國家“雙減”目標提供產品和技術支撐。【前人研究進展】鈦(Titanium,Ti)是一種過渡金屬元素,在地殼中的含量超過0.6%,在生物體、水體中亦廣泛存在[10]。鈦具有“親生物”特性,對人體無害,是WHO唯一允許植入人體的金屬。已有研究證明,鈦能刺激人體內吞噬細胞提升機體免疫力,并具有一定抑菌能力[11-12]。近年來,已將鈦應用于農業生產中,并證明鈦能提高植物體內多種酶的活性[13-14],促進植物對養分的吸收和利用[15]。焦湞等[16]在煙草種子中注入低劑量的鈦離子,發現種子的發芽率以及葉片中的鉀含量均有提升。鈦除了對農作物的產量品質、生長發育產生積極的影響之外,在病蟲害防治方面也發揮著重要作用。鈦可有效抑制黃瓜霜霉病菌、白粉病菌、番茄和玫瑰的細菌性葉斑病菌的生長[17-19]。然而,自然界中的鈦元素常以氧化物、硅酸鹽結合態或鈦鐵礦等形式存在,難以為植物利用[20]。而離子狀態的鈦通常是鈦與鹵素生成的易揮發高價鈦鹵化物,且存在不穩定、遇水易發生反應等問題。光能變價離子鈦(Titanium ion of variable valence with light energy,TIVL)中的鈦是一種穩定的新型鈦離子制劑[專利:US8308840B2;20151077 3354.4],其中的鈦元素以離子(Ti4+與Ti3+)形式存在,于環境友好。已有田間試驗顯示低濃度的TIVL可以提高光合作用效率、提高作物產量與品質,使大豆籽粒中的蛋白質含量和產量分別增加1.61%和16.34%[21],顯著提升煙葉的香氣、口感等[22];低濃度的TIVL還可防止低溫冷害顯著提高牧草、煙草等植物種子的發芽率、促進植株根系生長[23];另外TIVL能降低作物發病率與發病癥狀,李洪浩等[24]通過田間試驗發現使用TIVL(675 mL/hm2)對馬鈴薯晚疫病的防效可達40%以上。據此推測TIVL具有抑制馬鈴薯致病菌生長的功能。【本研究切入點】擬于培養基中加入不同濃度的TIVL培養致病疫霉、茄科雷爾氏菌和瘡痂病鏈霉菌3種馬鈴薯致病菌,分析TIVL對3種致病菌的影響。【擬解決的關鍵問題】明確TIVL是否具有抑制馬鈴薯病原菌生長的作用,尋找適宜的TIVL抑菌濃度,為TIVL應用于馬鈴薯病害防控領域提供理論基礎。
1 材料與方法
1.1 供試材料
光能變價離子鈦(TIVL)采購于鈦谷(天津)科技有限公司,該制劑未添加其他金屬元素,鈦離子濃度為4 mg/mL。致病疫霉菌(P.infestans)由四川省農業科學院植物保護研究所提供,瘡痂鏈霉菌(CGMCC 4.1765)、茄科雷爾氏菌(CGMCC 1.2839)于中國普通微生物保藏管理中心購買。
1.2 培養基制備
1.2.1 瘡痂鏈霉菌培養基(SP-2培養基) 稱取酵母提取物4.0 g,麥芽提取物10.0 g,葡萄糖4.0 g,以蒸餾水定容1.0 L并調節pH至7.3(固體培養基加瓊脂粉15.0 g),115 ℃高壓滅菌35 min。
1.2.2 茄科雷爾氏菌培養基(營養肉汁培養基) 稱取蛋白胨10.0 g,牛肉浸取物3.0 g,NaCl 5.0 g,以蒸餾水定容1.0 L并調節pH至7.0(固體培養基加瓊脂粉15.0 g),121 ℃高壓滅菌20 min。
1.2.3 致病疫霉菌培養基(黑麥培養基) 稱取黑麥10 g加入100 mL水中,121 ℃高壓滅菌40 min,4層紗布過濾去除殘渣,于上清液中加入2 g蔗糖和1.5 g瓊脂粉定容至100 mL,121 ℃再次高壓滅菌20 min。
1.3 供試菌種活化
將4 ℃冰箱保存的瘡痂鏈霉菌和茄科雷爾氏菌分別劃線接種至固體SP-2和營養肉汁培養基,置于28和30 ℃培養,待長出單菌落后備用。從4 ℃冰箱保存的致病疫霉菌黑麥平板切取直徑5 mm的菌餅接種到黑麥培養基中央,18 ℃黑暗培養5~7 d。
1.4 菌液濃度選擇
挑取瘡痂鏈霉菌和茄科雷爾氏菌單菌落于1 mL無菌水中,以移液器吹打使之分散均勻,記為103倍稀釋菌液;依次吸取100 μL菌液加入900 μL無菌水中,吹打均勻,梯度稀釋至1010倍。分別取每個稀釋梯度下的菌液100 μL均勻涂布于固體SP-2或營養肉汁培養基,置于28和30 ℃培養至長出單菌落,選擇可清晰統計單菌落數量的梯度稀釋菌液作為最適稀釋濃度用于后續試驗。
1.5 平板抑菌實驗
固體培養基經高壓滅菌后冷卻至50 ℃左右,分別添加濃度為4 mg/mL的TIVL母液,使TIVL濃度為0、4、8、16 mg/L,輕輕搖勻后倒平板。
挑取瘡痂鏈霉菌單菌落于1 mL無菌水中,經梯度稀釋并涂布于SP-2培養基,發現1010倍稀釋菌液培養60 h后可清晰統計單菌落數量,因此選擇1010倍稀釋菌液用于后續實驗。
挑取茄科雷爾氏菌單菌落于1 mL無菌水中,經梯度稀釋并涂布于營養肉汁平板培養基,發現茄科雷爾氏菌單菌落稀釋1010倍后,涂布于營養肉汁平板培養3~4 d能清晰統計單菌落數量,因此選擇1010倍稀釋菌液用于后續實驗。分別取最適稀釋濃度的瘡痂鏈霉菌和茄科雷爾氏菌各100 μL均勻涂布于含不同濃度TIVL的固體培養基上,置于相應溫度條件下培養(瘡痂鏈霉菌28 ℃培養60 h,培茄科雷爾氏菌30 ℃培養108 h),于不同時間拍照記錄菌落生長情況。
從4 ℃冰箱保存的致病疫霉菌黑麥平板切取直徑5 mm的菌餅,接種到含有不同濃度TIVL的黑麥平板中央,18 ℃黑暗培養5~7 d,拍照記錄致病疫霉菌圈生長情況。以田間生產中常用的馬鈴薯晚疫病防治農藥福帥得(氟啶胺500 g/L,日本石原產業株式會社)對致病疫霉的抑制效果作為對照,分析TIVL的抑菌效果:黑麥培養基中加入稀釋1000倍(0.5 g/L氟啶胺)和500倍(1.0 g/L氟啶胺)的福帥得,并切取5 mm直徑的菌餅置于平板中央,18 ℃黑暗培養7 d,拍照記錄致病疫霉菌圈生長情況。
1.6 透射電子顯微鏡樣品制備與觀察
將含有8 mg/L TIVL的致病疫霉固體培養基上生長的致病疫霉的菌絲輕輕刮下,置于1.5 mL尖底EP管內。菌絲體積不小于米粒大小,沿管壁加入由Sorensen緩沖液配置的5%的戊二醛固定液,不沖散菌絲,于4 ℃冰箱內固定過夜,0.1 mol/L磷酸緩沖液清洗3次,置入1%鋨酸后固定1.5 h,磷酸緩沖液漂洗3次,經50%、70%、80%、90%乙醇逐級脫水(每次15 min),90%丙酮脫水15 min,再經100%丙酮脫水3次(每次15 min),Embed 812樹脂滲透并包埋,60 ℃高溫聚合24 h后修塊,采用超薄切片機(徠卡UC7)切片,經2%醋酸雙氧鈾染色液——檸檬酸鉛染色液雙重染色法染色(各25 min,每種染色劑染色后均用蒸餾水漂洗數次),晾干,置于Tecnai G2 F20 S-TWIN透射電鏡觀察。
2 結果與分析
2.1 TIVL對致病疫霉菌的抑制作用
切取致病疫霉菌餅接種至含有不同濃度TIVL的黑麥培養基上,培養第5天時,0 mg/L TIVL平板上致病疫霉已有較好的長勢,而4和8 mg/L TIVL的平板上致病疫霉菌才開始生長,且長勢較弱,16 mg/L TIVL平板上未見病菌生長跡象(圖1)。經測量,培養5 d時0、4、8 mg/L TIVL黑麥平板上菌圈直徑分別為(3.77±0.06)、(3.67±0.12)和(3.13±0.15)cm;培養6 d時菌圈直徑分別為(4.83±0.15)、(4.60±0.10)和(4.03±0.15)cm;培養第7天時菌圈直徑達到(6.40±0.10)、(6.17±0.06)和(5.20±0.36)cm(表1)。16 mg/L TIVL黑麥平板直至第7天時仍未見菌圈。添加了福帥得的黑麥培養基培養第7天時同樣未見明顯的致病疫霉菌圈形成。表明TIVL可顯著抑制致病疫霉的生長,當TIVL濃度達到16 mg/L時,抑菌效果與福帥得相當。
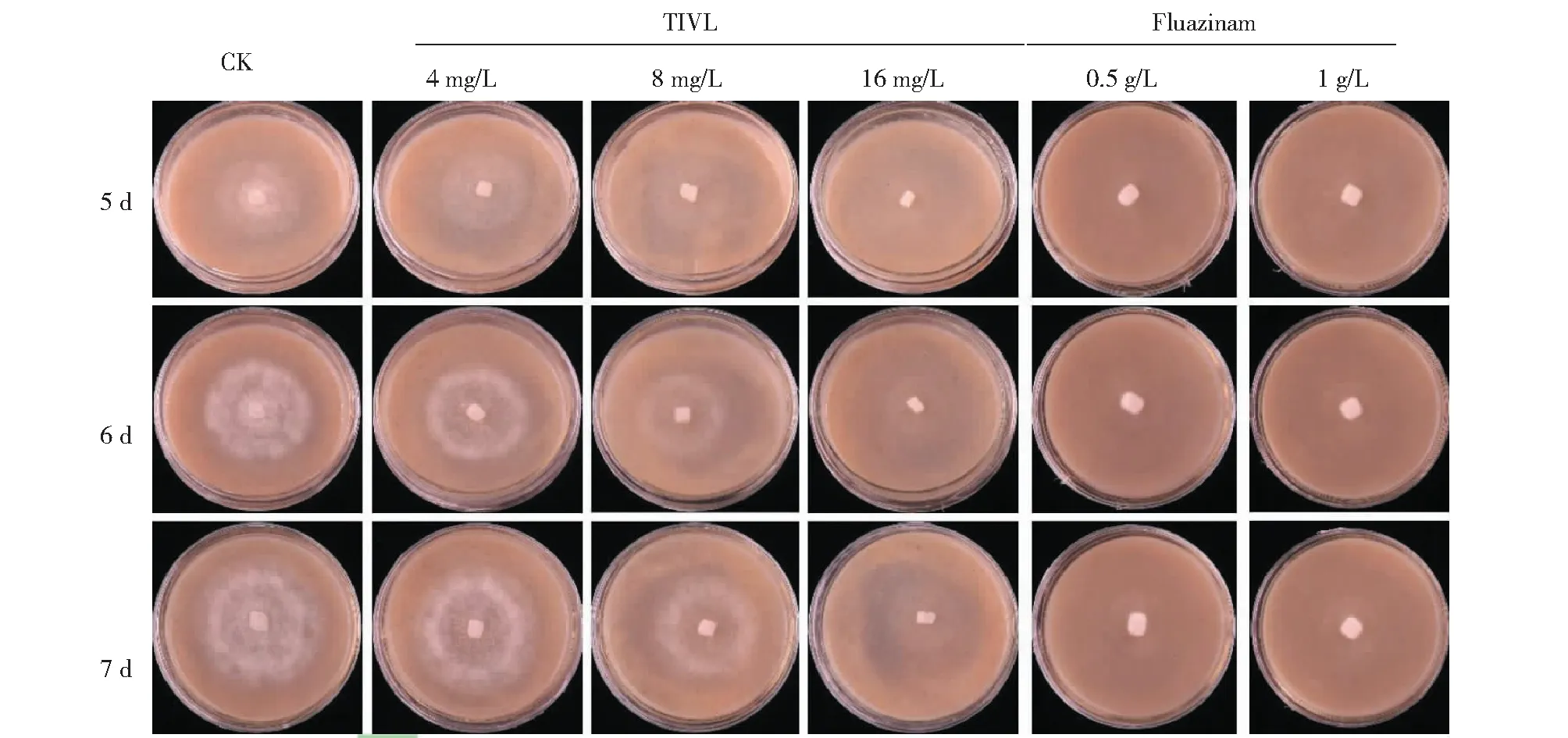
圖1 不同濃度TIVL與Fluazinam對致病疫霉生長的影響Fig.1 Effect of different TIVL and fluazinam concentrations on the growth of Phytophthora infestans
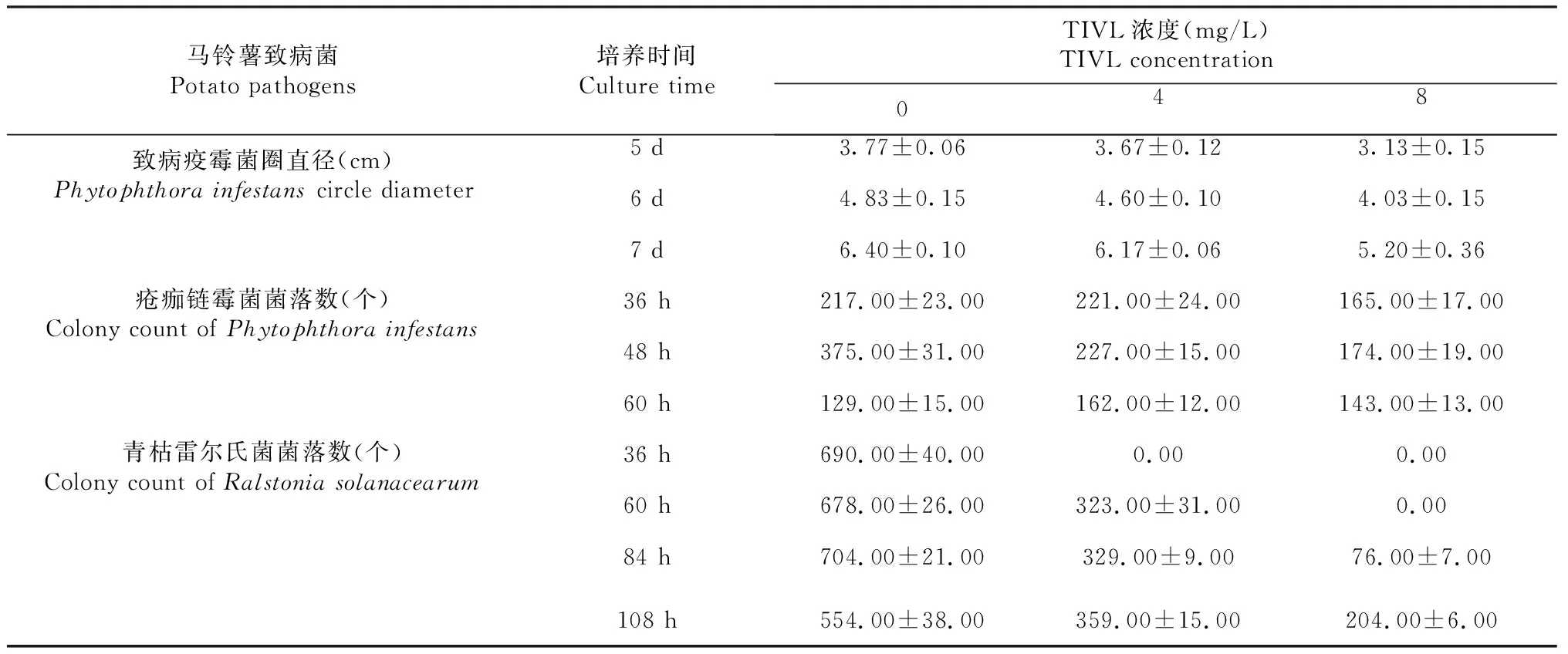
表1 不同濃度TIVL對3種病原菌的菌落數和菌圈直徑的影響
2.2 TIVL對瘡痂鏈霉菌的抑制作用
將瘡痂鏈霉菌涂布在含有不同TIVL濃度的平板上,其生長狀況如圖2所示,培養36 h時,含0和4 mg/L TIVL的培養基上瘡痂鏈霉菌生長趨勢差別較小,分別含有(217±23)、(221±24)個菌落;含8 mg/L TIVL的培養基上菌落則明顯少于0和4 mg/L的TIVL平板,只有(165±17)個單菌落;而含16 mg/L TIVL的培養基上則未見單菌落長出(表1)。培養48 h時,0和4 mg/L TIVL平板上部分單菌落已出現“融合”現象,而8 mg/L的平板上仍可清晰分辨單菌落,菌落數分別為(375±31)、(227±15)和(174±19)個(表1)。培養60 h時,8 mg/L的平板上亦出現單菌落的融合,而16 mg/L TIVL平板上仍未見單菌落長出,表明TIVL可顯著抑制瘡痂鏈霉菌的生長。
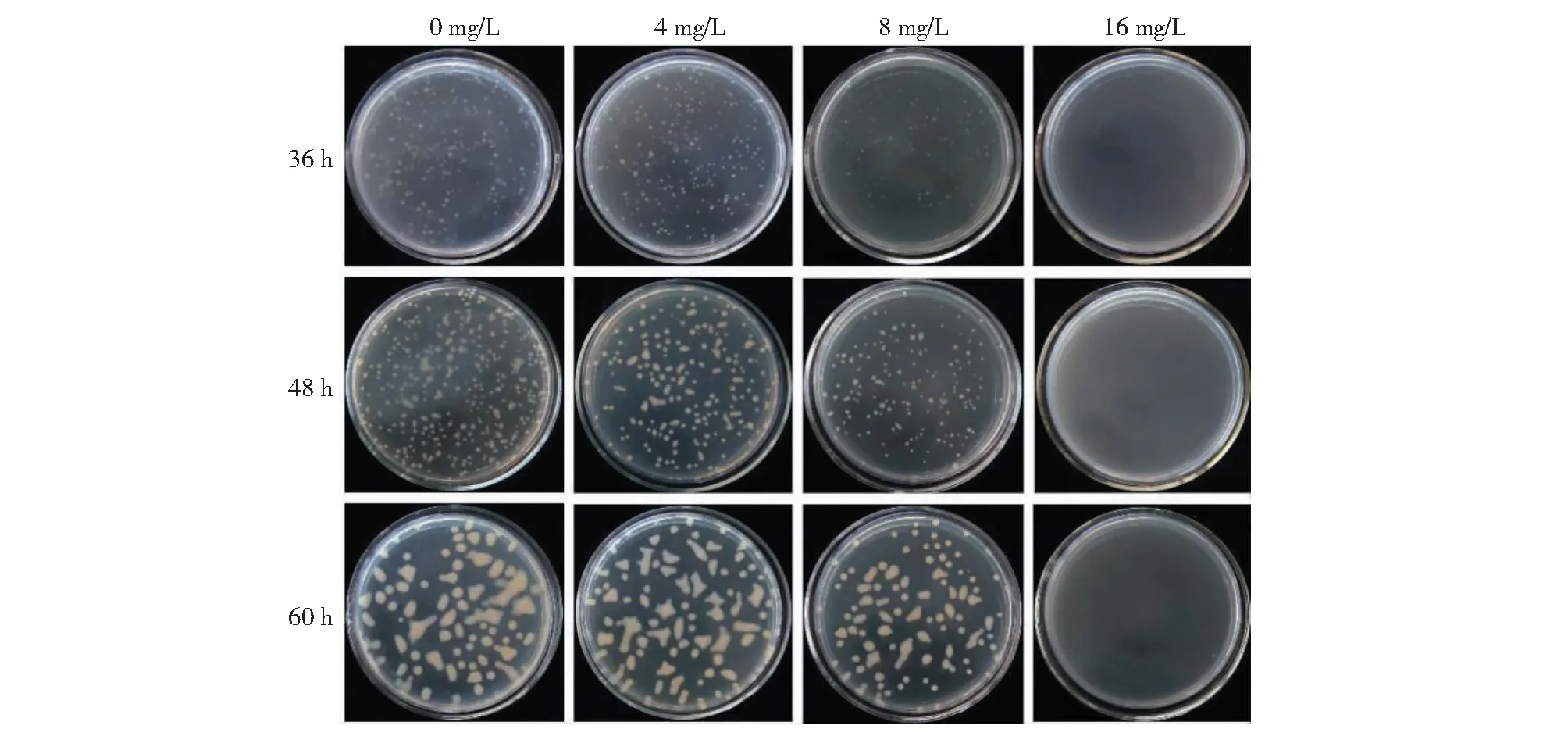
圖2 不同濃度TIVL對瘡痂鏈霉菌生長的影響Fig.2 Effect of different TIVL concentrations on the growth of Streptomyces scabiei
2.3 TIVL對茄科雷爾氏菌的抑制作用
將茄科雷爾氏菌涂布于含有不同TIVL濃度的平板上觀察菌落生長情況(圖3)。培養36 h時,0 mg/L的TIVL平板上有菌落(690±40)個,4和8 mg/L TIVL濃度下均未見明顯菌落;培養60 h時,0 mg/L的TIVL平板上長出(678±26)個單菌落,4 mg/L TIVL濃度下有菌落(323±31)個,而8 mg/L TIVL平板上單菌落數仍為0個;84 h時,8 mg/L濃度下亦可見菌落長出,數量為(76±7)個,但明顯少于0 mg/L[(704±21)個]和4 mg/L[(329±9)個];108 h時,3種TIVL濃度下的菌落數分別為(554±38)、(359±15)、(204±6)個。表明TIVL可顯著抑制茄科雷爾氏菌的生長。
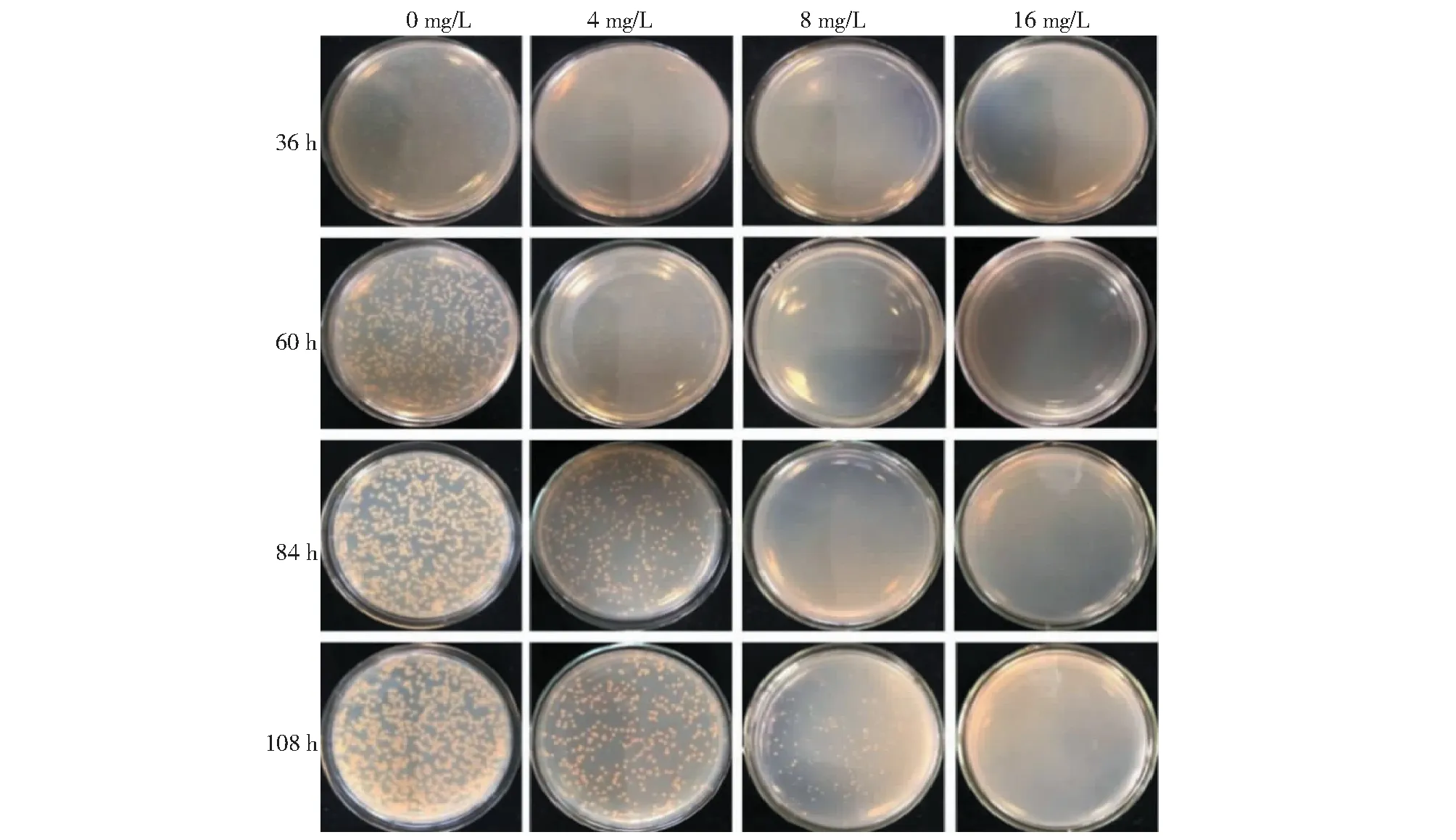
圖3 不同濃度TIVL對茄科雷爾氏菌生長的影響Fig.3 Effect of different TIVL concentrations on the growth of Ralstonia solanacearum
2.4 TIVL對致病疫霉影響的顯微特征觀察
以透射電鏡觀察含8 mg/L TIVL的培養基培養致病疫霉菌,在2000倍放大倍數下可見加入8 mg/L TIVL黑麥平板培養的致病疫霉菌體的形態、大小均發生改變,多數菌體變得不規則(圖4-A,4-D);放大至25 000倍時,可觀察到菌絲的細胞質發生收縮,液泡變大(圖4-B,4-E);在50 000倍放大倍數下,可見致病疫霉細胞質和周質內出現較多黑點(圖4-C,4-F)。上述結果表明TIVL的抑菌作用可能因為鈦離子進入細胞內并破壞細胞結構。
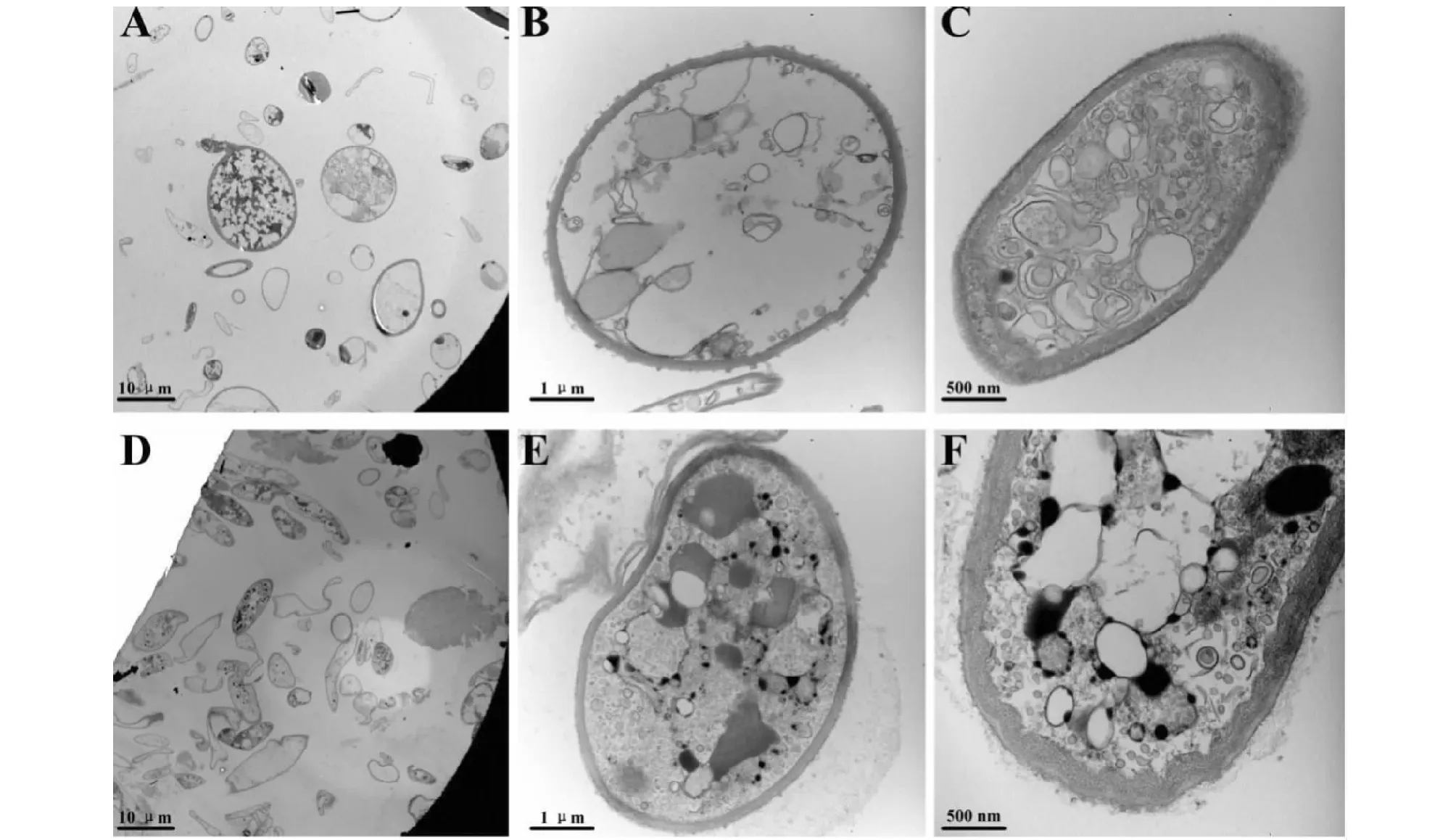
A、D.放大2000倍;B、E.放大25 000倍;C、F.放大50 000倍A, D.2000 times magnification; B, E.25 000 times magnification; C, F.50 000 times magnification圖4 TIVL對致病疫霉細胞結構的影響Fig.4 Effect of TIVL on the cellular structure of Phytophthora infestans
3 討 論
作為WHO唯一允許植入人體的金屬,鈦在農業領域具有較好的應用前景。近年來,已有研究證明鈦不僅具有一定的促生作用[13-15],在作物病害防控方面也能發揮作用[17-19]。本研究所用的TIVL中鈦以離子形式存在,相比自然存在的氧化物、硅酸鹽結合態或鈦鐵礦形式,易于被植物吸收利用。已有的研究表明TIVL同樣具有較好的促生和抑菌作用[21-24],但目前尚未見TIVL抑制馬鈴薯致病菌生長的報道。本研究以含有4、8、16 mg/L的TIVL的培養基培養致病疫霉、瘡痂鏈霉菌、茄科雷爾氏菌3種馬鈴薯病原菌,發現16 mg/L的TIVL完全抑制3種病原菌的生長。其中16 mg/L TIVL對致病疫霉的抑菌效果與馬鈴薯大田生產中常用的農藥福帥得(有效成分氟啶胺)的抑菌效果相當:固體培養基培養5~7 d,無菌圈長出。針對馬鈴薯瘡痂病和青枯病病原菌,含16 mg/L TIVL的固體培養基分別培養60和108 h,均未見單菌落。范延芬等[25]曾以不同濃度TIVL的固體營養肉汁培養基培養茄科雷爾氏菌,同樣發現16 mg/L TIVL對茄科雷爾氏菌有顯著的抑菌作用。但范延芬等所用茄科雷爾氏菌分離自黃瓜青枯病株,該菌株能否引發馬鈴薯青枯病尚不得而知。因此,本研究選用能引發馬鈴薯青枯病的茄科雷爾氏菌為材料,通過抑菌實驗證明TIVL濃度越大對馬鈴薯青枯病病原菌的生長的抑制效果越明顯,濃度達到16 mg/L時完全抑制病菌的生長,說明TIVL能有效抑制馬鈴薯病原菌,具有作為農用殺菌劑在田間生產中推廣應用的前景。
抑菌劑通常是通過破壞細胞壁、細胞膜等細胞結構或干擾新陳代謝而達到抑菌效果。TIVL作為一種新型農用制劑,其抑菌機理鮮見報道。但TiO2抑菌相關研究已取得一定進展:TiO2具有光催化活性,可催化產生O2-及·OH等活性自由基,在溶液中O2-可與2分子·OH產生的H2O2反應,生成·OH、OH-與O2,而·OH 與O2可將有機質氧化成CO2與H2O,這種氧化能力可破壞微生物細胞膜導致細胞破裂,從而達到抑菌效果[26-28]。TIVL中的鈦以Ti4+與Ti3+形式存在,接收光能后鈦可在三價和四價之間發生價位跳躍,產生活性自由基,形成強氧化能力。因此推測TIVL對致病疫霉、茄科雷爾氏菌和瘡痂鏈霉菌的抑菌作用機理可能與TiO2相似。楊薇薇等[29]在假單胞菌中添加鈦離子后通過透射電子顯微鏡圖可觀察到細胞質和周質內均有黑點產生,通過EDS對納米粒子分析證明黑點為鈦粒子。在本研究中以含有TIVL的培養基培養的致病疫霉胞內亦有黑點出現,表明鈦離子已進入到致病疫霉胞內,并在胞內通過氧化還原反應對細胞結構造成破壞,發揮抑菌作用。
4 結 論
TIVL對致病疫霉、茄科雷爾氏菌和瘡痂病鏈霉菌3種馬鈴薯致病菌均有較好的抑菌作用,當TIVL 濃度達到16 mg/L時3種供試菌株已完全不能生長。TIVL進入致病菌胞內,通過氧化還原反應破壞細胞超微結構,抑制病菌正常生長,實現抑菌作用。本研究可為馬鈴薯綠色生產和實現化學肥料與化學農藥“雙減”目標提供產品和技術支撐。

