辣椒CAMTA 基因家族生物信息學分析
蔣宏華 李 麗 李雪峰*
(1 湖南省農業科學院蔬菜研究所,湖南長沙 410125;2 湖南省農業科學院科研基地管理中心,湖南長沙 410125)
植物主要是通過分子機制來優化生長和改善對環境約束的耐受性(Iqbal et al.,2020)。在生物和非生物脅迫下的植物生長發育中,鈣離子(Ca)作為第二信使在真核生物中普遍存在(Galon et al.,2010),且發揮重要作用(Kudla et al.,2010;Reddy et al.,2011)。鈣信號被認為是許多適應性過程和發育過程的核心調節信號,由鈣調素(CaM)等一系列鈣結合蛋白進行傳輸和解析。這些蛋白質通過調節轉錄因子(TFs)進一步傳播信號以產生特定的下游反應(Xiao et al.,2021)。目前,至少有90 種轉錄因子被鑒定為CaM結合蛋白,如CAMTA、MYB、WRKY、NAC、bZIP 和MADS-box 蛋 白(Reddy et al.,2002;Popescu et al.,2007;Kim et al.,2009;Galon et al.,2010)。在這些轉錄因子中,鈣調素結合轉錄激活因子(CAMTA)是1 個保守家族,也是與鈣調素相關的最具特征的轉錄因子(Bouché et al.,2005;Finkler et al.,2007;Xiao et al.,2021),在Ca/CaM 驅動的模式中通過調節植物應激反應和整體發育發揮了重要作用(Bouché et al.,2002;Galon et al.,2010;Liu et al.,2015;Shkolnik et al.,2019)。
CAMTA 轉錄因子家族具有相同的功能結構域CG-1,這是1 個與DNA 結合有關的特異性結構域,可以激活下游基因的轉錄。Tig(transcription factor immunoglobulin)參與TFs 中的非特異性DNA 相互作用(Aravind &Koonin,1999),也參與蛋白質二聚化(Müller et al.,1995)。ANK 重復序列(ankyrin repeat)是多種真核生物蛋白質中約33 個氨基酸的串聯重復模塊,與蛋白質間的相互作用有關(Sedgwick &Smerdon,1999;Rubtsov &Lopina,2000)。串聯重復的IQ 基序(IQ motif)以不依賴于Ca的方式與CaM 相互作用。在擬南芥()受到低溫脅迫時,基因可誘導100 多個基因的表達(Vogel et al.,2005;Maruyama et al.,2010),其 中CAMTA 的CG-1 結構域可以與基因啟動子中的CM2 順式作用元件特異性結合,調控的表達,當和發生功能突變時,會抑制的表達;此 外,、和均可以誘導、和表達,并增強植物的抗凍性(Doherty et al.,2009)。擬南芥中的已被證實與種子萌發早期的鈉(Na)穩態有關,突變體積累較少的NaCl,并表現出對鹽分和ABA 的耐受性(Shkolnik et al.,2019)。突變體損害了光合作用效率和水分利用效率,植物含水量相對較低,生長遲緩,易受干旱脅迫影響(Pandey et al.,2013)。在其他物種中,也廣泛參與了非生物脅迫的反應,在玉米()中,響應低溫脅迫、鹽脅迫、干旱脅迫(Yue et al.,2015);在小麥()中,響應低溫脅迫、高溫脅迫、鹽脅迫、干旱脅迫(Yang et al.,2020);草莓()在高溫、低溫、鹽脅迫下的表現也受到的調控(Leng et al.,2015)。
在擬南芥、水稻()等模式植物中均有報道,但在辣椒(L.)中還沒有進行全面的研究。本試驗通過PlantTFDB 數據庫的信息獲得5 個辣椒CAMTA 家族基因成員,通過分析這5 個CAMTA 家族成員的蛋白理化性質、蛋白保守結構域、基因結構及構建系統進化樹,同時分析其在幾種非生物脅迫與組織發育過程中表達量的變化等信息,為辣椒CAMTA家族基因在非生物脅迫與組織發育過程中信號轉導與調控表達的功能研究提供理論基礎,為辣椒抗逆研究提供新思路。
1 材料與方法
1.1 試驗材料與基因表達量數據來源
試驗材料為辣椒高代自交系6421,由湖南省農業科學院蔬菜研究所提供,對炭疽病、菌斑病和青枯病具有抗性。基因在非生物脅迫與不同組織發育階段的表達量數據下載于PepperHub(http://pepperhub.hzau.edu.cn/;Liu et al.,2017)。
1.2 試驗方法
1.2.1 基因表達量分析 ①激素和非生物脅迫處理。6421 種子用5%次氯酸鈉溶液表面消毒15 min,清水洗滌,然后播于裝滿蛭石的200 孔育苗盤中。將育苗盤放置在30 L 的避光塑料箱上,箱內裝滿日本花園試驗營養液,pH 值6.0。幼苗生長溫度為25 ℃/18 ℃(晝/夜),光照/暗周期為16 h/8 h,相對濕度為60%~70%,光照強度為6 000 lx。
對播種40 d 后的幼苗進行激素和脅迫處理,在營養液中添加最終濃度為10 μmol · L茉莉酸甲酯(MeJA)作為激素處理,在營養液中添加最終濃度為200 mmol · L的NaCl 作為鹽脅迫,在營養液中添加最終濃度為30 mmol · L的HO作為氧化脅迫,對照植株添加相應量的營養液。低溫脅迫處理,將幼苗轉移到10 ℃恒溫的生長室中,光照/暗周期、相對濕度和光照強度與對照植株相同。采集脅迫處理后0、0.5、1、3、6、12、24 h 和對照植株葉片和根組織。考慮到生物鐘對植物基因表達的影響,所有處理和對照植株的樣本采集分別從脅迫處理第1 天的8:00、8:30、9:00、11:00、14:00、20:00 和第2 天的8:00 開始。每個樣品4 次生物學重復,取樣后迅速放入液氮中冷凍,并在-80 ℃下保存,用于RNA 提取。
② 組織不同發育時期。幼苗生長溫度為白天25~29 ℃,夜間16~20 ℃。采用盆栽方式,每天通過滴灌系統補充復合肥料(N、P 和K)。為了采集不同發育階段的果實樣品,在開花當天對第4 分杈處的花進行標記。開花后3、7、10、15、20、25、30、35、40、45、50、55、60 d 采集標記花生長的果實。對于在開花后3、7 d 采集的果實,將整個果實研磨以提取RNA;而對于在開花后10 d 及其后采集的果實,將其切割并分為果肉、胎座和種子進行研磨提取RNA。每個樣品由10個果實組成。根據花蕾的大小,在花蕾出現后2、5、10、15、20、25、30、40、50 d 收集花蕾,并將花蕾出現后60 d 時完全開放的花分為花瓣、帶柱頭的子房和雄蕊。在葉片出現后2、5、10、15、20、25、30、40、50、60 d 采集相同葉位的葉片樣本。每個樣品4 次生物學重復,取樣后迅速放入液氮中冷凍,并在-80 ℃下保存,用于RNA 提取。
1.2.2 RNA 測序取樣本總RNA 0.5~5.0 μg,用作RNA 樣本制備的輸入材料。使用NEBNext Ultra Directional RNA Library Prep Kit(Illumina,#E7420L,NEB,USA)生成測序庫,并將索引代碼添加到每個樣本的屬性序列中。使用Qubit 3.0中的Qubit DNA 檢測試劑盒測定文庫濃度,然后將其稀釋至1 ng · μL。使用Bioanalyzer 2100 system(Agilent Technologies)評估文庫中的插入大小,并使用StepOnePlus Real-Time PCR System(Applied Biosystems,Carlsbad,CA,USA)準確定量具有合格插入大小的文庫。使用HiSeq SR Cluster Kit v4 cBot HS(Illumina,San Diego,CA,USA)在cBot 群集生成系統上對索引庫進行聚類。聚類生成后,使用150 bp 配對末端模型在Illumina Hiseq 4000 平臺上對文庫進行測序。
1.2.3 mRNA 序列數據處理質量控制 使用FastQC 軟件(Babraham Bioinformatics,http://www.Bioinformatics.Babraham.ac.uk)評估RNA 序列數據的質量。
1.2.4 映射和表達 使用hisat2 程序(Kim et al.,2015)將所有干凈讀取的片段映射到辣椒的參考基因組(http://peppersequence.genomics.cn;Qin et al.,2014)Zunla 和CM334(http://peppergenome.snu.ac.kr;Kim et al.,2014)中,設置為“max intronlen 15000—dta-cuラinks—rna-strandness RF”(Kim et al.,2015)。就映射到染色體錨定基因組的讀取率而言,與基因組Zunla 的比對結果略好于CM334,因此在后續分析中選擇Zunla 基因組作為參考。提取所有與Zunla 對齊的唯一映射讀取,然后使用samtools 將其轉換為排序的bam 文件(Li et al.,2009)。通 過HTSeq(Anders et al.,2015)計算映射到每個基因外顯子的片段數量來量化基因表達。使用內部perl 程序將基因長度估計為所有外顯子的長度之和,使用每千個堿基每百萬個映射片段的片段數(fragments per kilobase million,FPKM)對每個基因的片段計數進行歸一化,每個基因的表達水平計算為3 次生物復制的平均值。
1.2.5 鄰近法系統進化分析 在PlantTFDB 網站(http://planttfdb.gao-lab.org/)得到辣椒5 個、擬南芥10 個、玉米10 個、水稻7 個、番茄()7 個CAMTA 基因家族的成員,使用MEGA 11 對得到的CAMTA 基因家族成員的氨基酸序列構建系統進化樹,方法為鄰近法(neighborjoining,NJ)。進行Clustal W 多重序列比對,并采用自展法(Bootstrap)進行檢驗,其中Bootstra 設置為1 000。
1.2.6 順式作用元件分析 使用Plant Care 網站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)對辣椒的5 個CAMTA 家族基因的啟動子進行在線預測,并篩選相關的順式作用元件,使用TBtools 對順式作用元件進行可視化。
1.2.7 蛋白理化性質與基因結構分析 利用ExPASy Proteomics Sever(https://www.expasy.org/)對獲得的辣椒CAMTA 家族蛋白進行理化性質分析。利用GSDS(http://gsds.gao-lab.org/)對基因結構進行分析與可視化。使用MEME 網站(https://meme-suite.org/meme/tools/)對蛋白的保守序列進行分析,并使用TBtools 進行可視化。使用NCBI 網站(https://www.ncbi.nlm.nih.gov/)對蛋白序列進行分析,并使用TBtools 對功能結構域進行可視化。
2 結果與分析
2.1 辣椒CAMTA 基因家族信息及蛋白理化性質分析
辣椒5 個基因通過Protparam 進行定位分析表明(表1):5 個基因分別分布在4 條染色體上,且大小差異明顯,基因全長最小,為270 bp;基因全長最大,為13 814 bp。CaCAMTAs 氨基酸數目在89~1 023 個之間;Capana01g002305 氨基酸數目最少,為89 個;Capana00g001755 氨基酸數目最多,為1 023 個。Capana01g002305 相對分子質量最小,為10.686 35 kD;Capana00g001755 相對分子質量最大,為115.200 58 kD。各基因的等電點分布較廣,在5.81~9.10 之間,且5 個蛋白的不穩定系數均大于40,表明其編碼產物并不穩定。
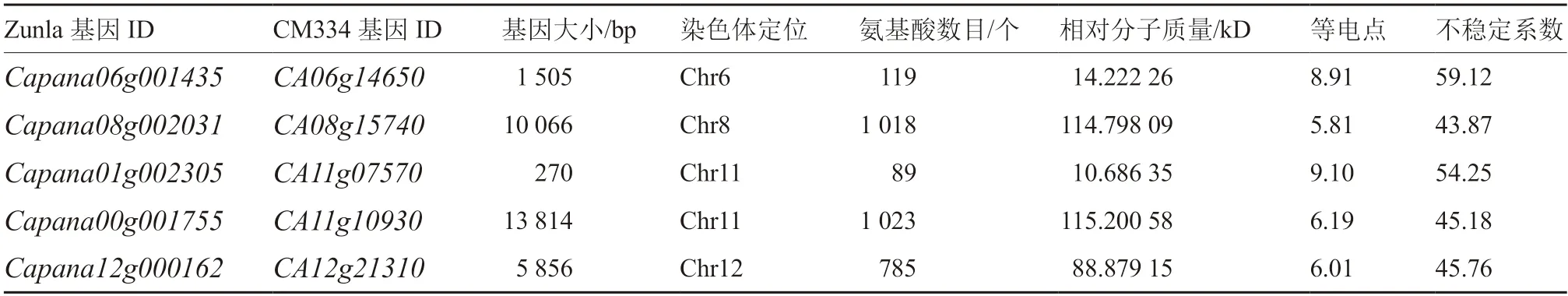
表1 辣椒CAMTA 基因家族信息及蛋白理化性質
2.2 辣椒CAMTA 基因家族基因結構分析
通過在線軟件GSDS 對辣椒CAMTAs 基因結構進行可視化分析(圖1),辣椒CAMTAs 基因不僅在長度上存在差異,而且在內含子與外顯子數目上也存在差異。只有1 個外顯子,含有3 個外顯子,含有12 個外顯子,和均含有13 個外顯子。
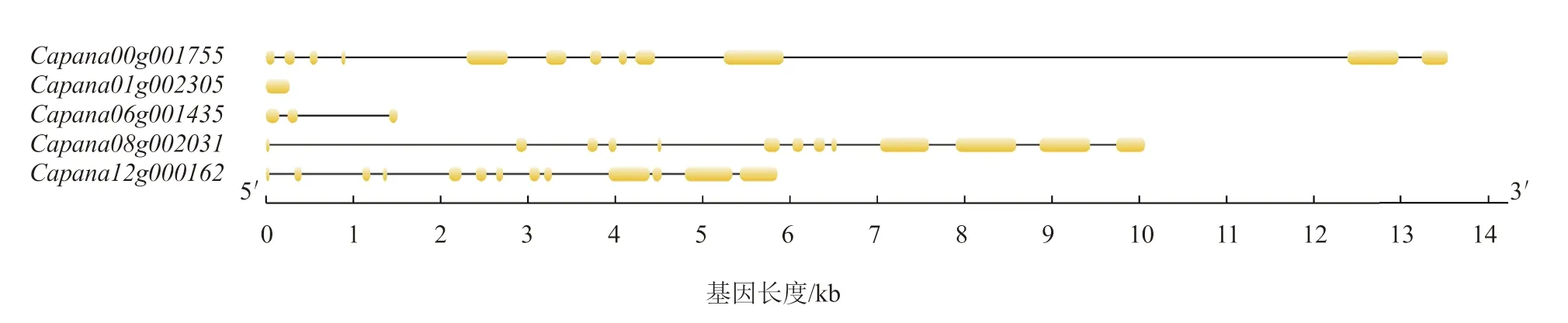
圖1 辣椒CAMTA 基因家族基因結構分析結果
2.3 辣椒CAMTA 基因家族系統進化、保守基序和結構域分析
系統進化樹分析顯示(圖2-A),辣椒CAMTA基因家族可以分為3 類,、和為I 類,為Ⅱ類,為Ⅲ類。
辣椒基因的蛋白質序列中共鑒定獲 得5 個Motif(Motif1~Motif5),蛋白質序 列相對保守(圖2-B),其位置與圖2-C 結構域吻合。辣椒CAMTA 蛋白結構域分析結果如圖2-C所示,該家族所有蛋白在N 端均含有CG-1 結構域,是與DNA 結合有關的特異性結構域,可以激活下游基因的轉錄。還有其他不保守的結構 域,如Capana08g002031 和Capana00g001755共有的TIG 結構域,Capana08g002031 獨有的CBD 結構域,Capana00g001755 獨有的IQ 結構 域,Capana08g002031、Capana00g001755 和Capana12g000162 共有的ANK 結構域。
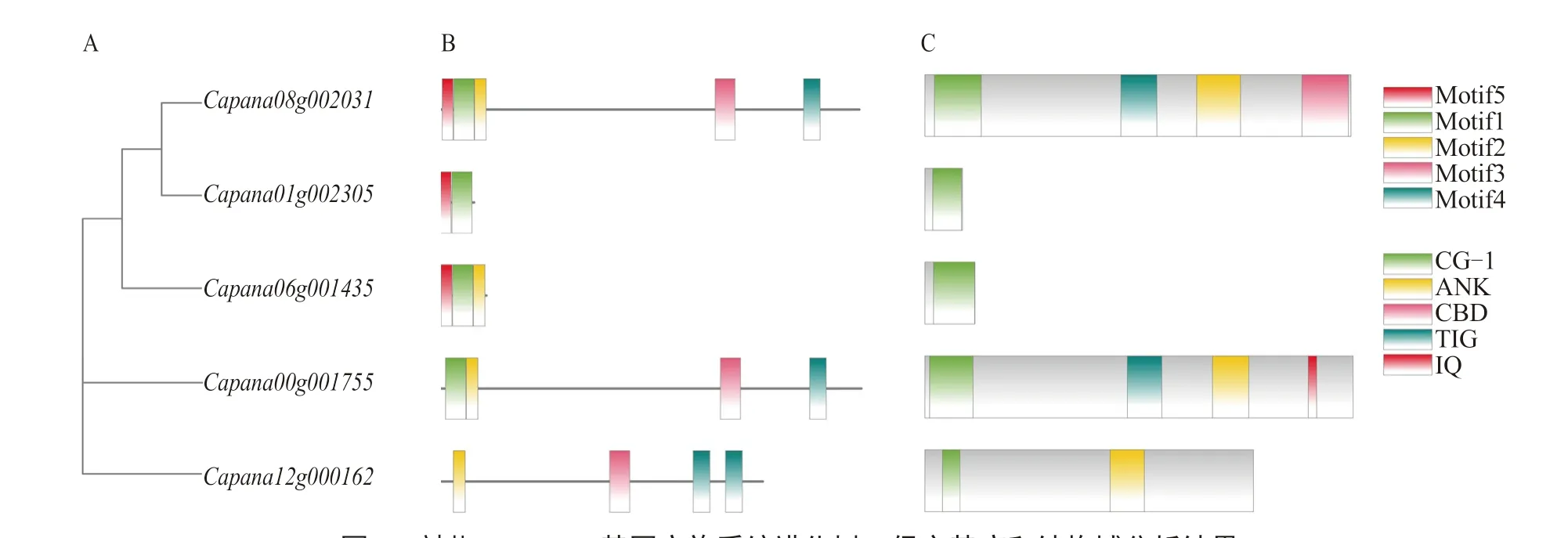
圖2 辣椒CAMTA 基因家族系統進化樹、保守基序和結構域分析結果
通過在線軟件Swiss Model 對CaCAMTAs 家族蛋白進行三級結構預測,結果如圖3 所示,辣椒CAMTA 家族蛋白構象并不完全相同,這與蛋白質的一級結構和二級結構有關,其中兩條最小的蛋白Capana06g001435 和Capana01g002305 僅含有CG-1 結構域,其三維構象相仿。
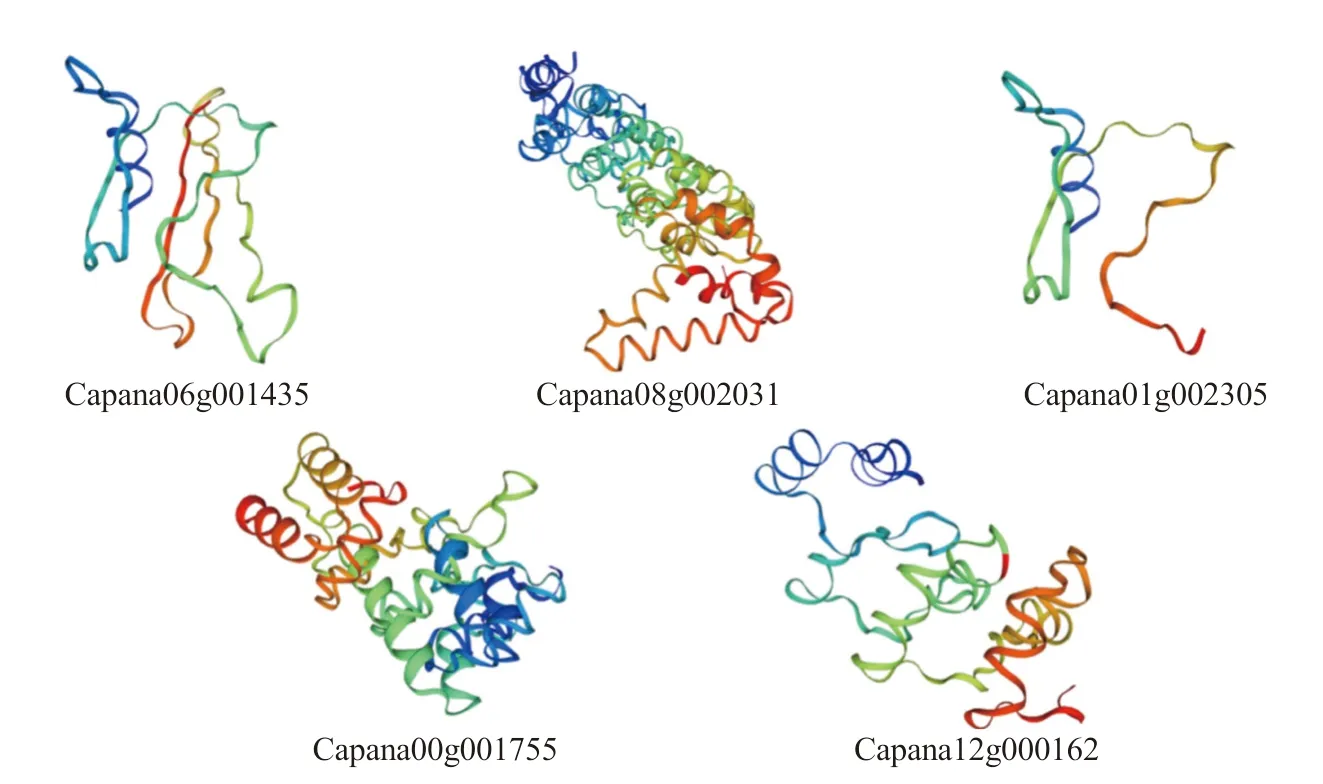
圖3 辣椒CAMTA 基因家族蛋白質三級結構預測
2.4 辣椒CAMTA 基因家族系統進化分析
通過構建系統進化樹,將辣椒與擬南芥、玉米、水稻、番茄的CAMTA 基因家族進行系統發育分析,結果如圖4 所示。辣椒的5 個CAMTA可以分為3 個亞家族,Capana08g002031、Capana06g001435 和Capana01g002305 分 為1 組,Capana00g001755與Capana12g000162各自為1組。辣椒Capana08g002031 與番茄Solyc01g105230 親緣關系最近,與擬南芥AT5G09410、AT5G64220 較近;辣椒Capana06g001435 與番茄Solyc01g057270親緣關系較近;辣椒Capana01g002305 與水稻Os07g43030、玉米GRMZM2G431243 親緣關系較近;辣椒Capana00g001755 與番茄Solyc05g015650親緣關系最近,與番茄Solyc12g035520、擬南芥AT1G67310 親緣關系較近;辣椒Capana12g000162與番茄Solyc12g099340 親緣關系最近,與擬南芥AT4G16150、AT3G16940 親緣關系較近。
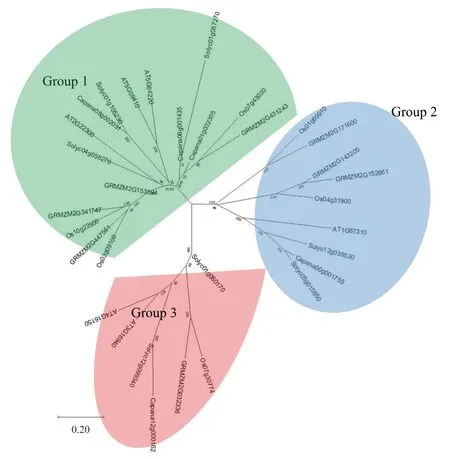
圖4 辣椒、擬南芥、玉米、水稻和番茄CAMTA 基因家族系統進化分析結果
2.5 辣椒CAMTA 基因啟動子順式作用元件分析
通過辣椒CAMTA 基因啟動子順式作用元件分析,找出常見的順式作用元件,包括防御應激反應元件和脅迫響應元件,結果如圖5 所示。辣椒CAMTA 家族基因有9 種順式調控元件,激素類的響應元件主要包括水楊酸響應元件(Salicylic acid responsiveness)、赤霉素響 應元 件(Gibberellin-responsiveness)、茉莉酸甲 酯響應元件(MeJA-responsiveness)、脫落酸響應元件(Abscisic acid responsiveness)、生長素響應元件(Auxin responsiveness),脅迫響應元件主要包括厭氧誘導響應元件(Anaerobic induction responsiveness)、防御和應激響應元件(Defense and stress responsiveness)、低溫響應元件(Low temperature responsiveness)、干旱誘導的MYB 結合位點(MYB binding site)。表明辣椒基因與響應辣椒的非生物脅迫關系密切。
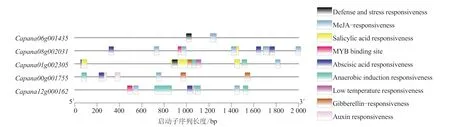
圖5 辣椒CAMTA 基因啟動子順式作用元件分析結果
2.6 激素和脅迫處理下辣椒CAMTA 基因表達分析
通過定量分析辣椒CAMTA 家族基因在激素和非生物脅迫處理下的表達情況,基因表達量變化如圖6 所示。在低溫脅迫下,與對照相比,表達量下調,、在葉片中表達量上調,在根中處理12 h 時下調表達。NaCl 脅迫下,在葉片中處理6 h 后就開始上調表達,在根中處理24 h 時下調表達,在葉片中處理3 h 后開始上調表達,在葉片中處理6 h 后上調表達,在根中處理1.5 h 后上調表達。HO脅迫下,表達量上 調,表達量在葉片中處理6 h 后上調,在根中處理3 h 時下調表達,處理12 h 后上調表達,變化不顯著。MeJA處理后,、與表達量均下調,而與表達量低且變化不明顯。辣椒在低溫、NaCl、HO與MeJA處理后,、與表達量均有不同程度的變化,表明辣椒CAMTA 基因家族參與了脅迫后的信號轉導過程。
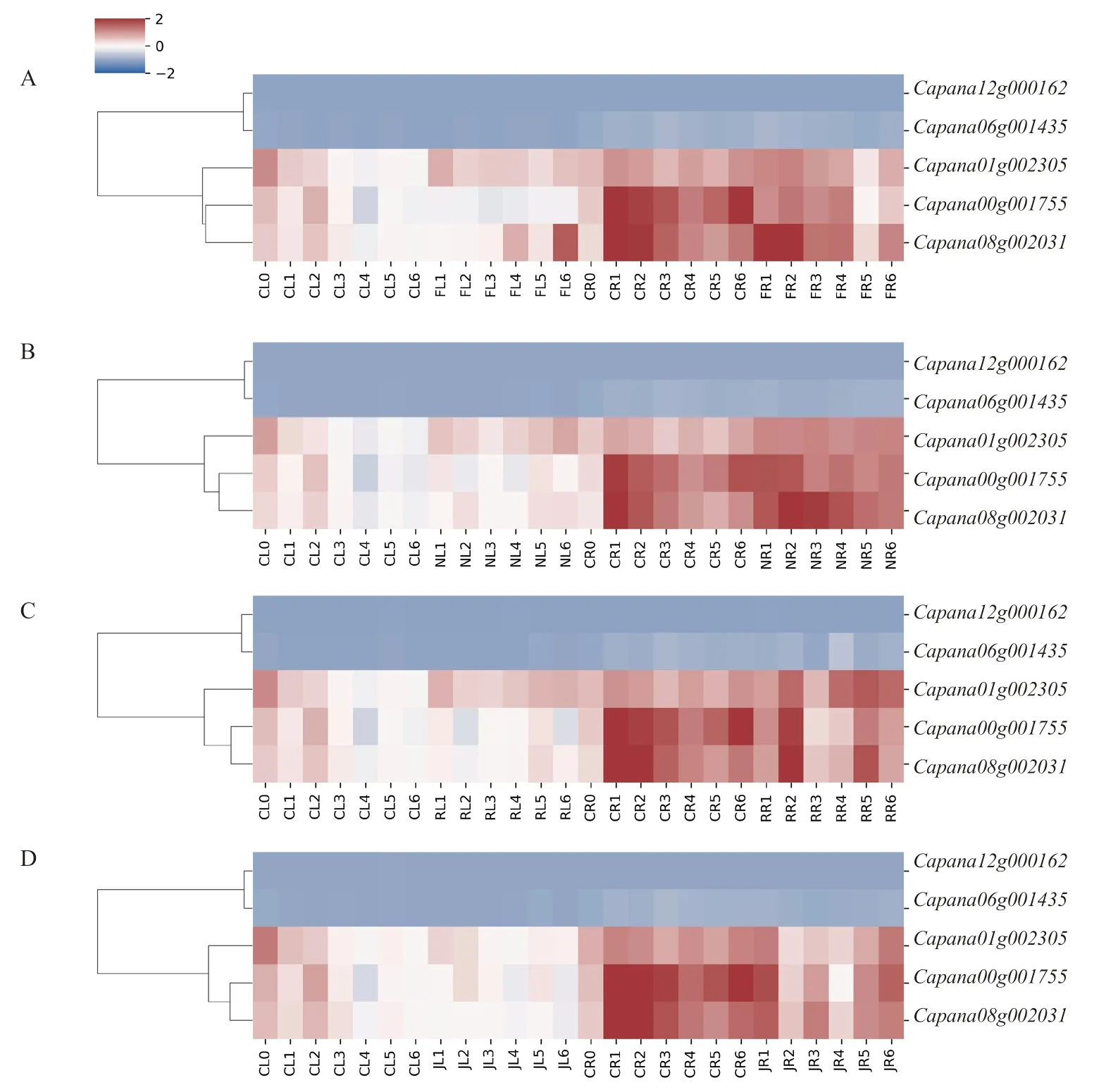
圖6 CaCAMTA 基因在不同處理后的表達量變化
2.7 組織不同發育時期辣椒CAMTA 基因表達分析
為探究辣椒CAMTA 基因家族是否在組織發育過程中發揮了作用,對辣椒在葉片、花、果實不同發育時期的表達量進行了分析。在整個發育階段表達量低且無明顯變化,只在花蕾發育的2~10 d(圖7-A)、胎座發育的40 d(圖7-B)上調表達,而在其他組織的發育過程中變化不明 顯。、和表達模式類似,在葉片、花蕾發育過程中有明顯的表達量變化,在子房、花瓣、雄蕊中的表達量依次降低(圖7-A)。在果肉、胎座、種子、早期的種子與胎座的發育過程中均有明顯的表達量變化,種子發育的前期表達量較高,隨后下調表達,這表明、和對種子發育的調節作用主要發揮在早期(圖7-B)。
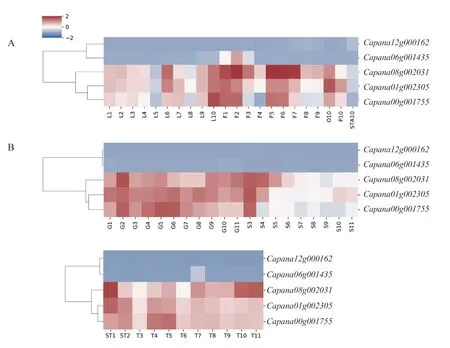
圖7 CaCAMTA 基因在葉片、花、果實中不同時期的表達量變化
3 結論與討論
了解植物對脅迫響應的分子機制對分析植物的生命活動具有重要意義,并進一步影響農業生產。CAMTA 家族作為鈣調素轉錄激活因子,在植物受到脅迫信號轉導過程中必然發揮著重要的作用。5 個辣椒CAMTA 基因分布在4 條染色體上,基因大小差異極大,內含子外顯子數目也不盡相同,表達的蛋白質等電點變化范圍較大且不穩定系數大于40,表明其表達產物并不穩定,唯一共同點是其共有的CG-1 結構域,可與DNA 特異性結合,并激活下游基因轉錄。對其啟動子分析發現,CAMTA基因家族含有多個與脅迫相關的順式作用元件,表明其在脅迫響應過程中的重要作用。在其他物種中的大量研究也已有證明。例如,在擬南芥中,、與協同工作,直接結合在的啟動子上誘導表達,從而提高植物的抗凍性(Kim et al.,2013);也通過調節一些應激反應基因來積極應對干旱反應,包括、(Pandey et al.,2013)。本試驗通過測定低溫、鹽、過氧化氫與茉莉酸甲酯處理后辣椒基因表達量的變化,表明在辣椒中CAMTA同樣參與了多種非生物脅迫的響應。CAMTA 基因家族對脅迫的響應并不局限于非生物脅迫,在非生物脅迫產生的調控過程中同樣發揮著重要作用,如可以作為植物免疫的負調節因子,通過激活介導的水楊酸(SA)信號來調節病原體防御反應(Du et al.,2009);可能是小麥條銹病防御反應的負調節因子,病毒誘導基因沉默(VIGS)后小麥的抗性增強。
本試驗中,對葉片、花、果實中不同發育時期的表達量變化分析表明,辣椒CAMTA 基因家族在組織的發育過程中同樣發揮了作用。在其他植物中,同樣有報道基因表達的空間差異與植物生長和發育有關(劉文宇 等,2021)。在擬南芥花粉發育過程中,和可以增強在花粉中的特異性表達(Li et al.,2005)。在煙草中過表達基因(),葉片和花瓣出現早衰的表型,這意味著CAMTA 參與了發育調節(Yang &Poovaiah,2000)。本試驗結果可以為辣椒CAMTA 基因家族成員的生物學功能研究與分子機制研究提供參考,同時為分子育種提供方向。

