合并HIV感染肝細胞癌肝切除的回顧性分析—單中心7年數據總結
陳晹,萬來憶,朱益軍,李葉晟,劉嬌,張猛,曾東,馮艷玲,黃楊卿
(上海市公共衛生臨床中心,上海 201508,1.肝膽外科,2.胸外科,3.病理科)
肝細胞癌(hepatocellular carcinoma,HCC)是主要威脅我國國民健康的惡性腫瘤之一[1],絕大多數患者合并有病毒性肝炎為主的慢性肝病[2]。人類免疫缺陷病毒(human immunodeficiency virus,HIV)感染患者在全球呈上升趨勢[3],此類患者往往合并有肝炎病毒感染或其他慢性肝病,因此也會發展為肝硬化甚至HCC。文獻提示HIV陽性患者發生HCC的風險是陰性患者的7倍[4]。隨著高活性抗逆轉錄病毒治療(high active antiretroviral therapy,HAART)的有效性提高,HCC的患病率并沒有顯著下降[4-6],其中一個原因是HIV感染患者因為相關并發癥死亡的幾率逐漸降低,壽命延長,合并病毒性肝炎導致的HCC發生風險反而呈上升趨勢[4,7]。目前關于這類患者我們僅有病例報道和區域小樣本的結果提供參考,而且絕大多數的數據都來自于西方國家丙型肝炎病毒(hepatitis C virus,HCV)感染背景下的HCC患者,這與我國HCC患者絕大多數合并乙型肝炎病毒(hepatitis B virus,HBV)感染背景有很大差異[2,8]。針對此類患者從篩查、診療方案、預后等方面是否與HIV陰性患者或者是西方患者存在異同點,目前還沒有相應的數據支持,更嚴重缺乏針對此類患者的診療規范或指南來指導其診療過程。因此本研究總結分析了上海市公共衛生臨床中心過去7 年合并HIV感染肝癌肝切除術患者臨床資料,與國內外相關文獻資料進行比較,初步探討此類患者的臨床特征和進一步研究的方向。
1 資料和方法
1.1 一般資料
上海市公共衛生臨床中心2000年1月至2021年12月開展38例HIV陽性HCC肝切除手術患者,剔除資料不完整者5 例,共33 例納入研究,手術時間為2014 年6 月至2021 年12 月。患者平均年齡(51.7±10.2)歲,男31 例,女2 例;腫瘤中位最大徑5 cm(1.5~18.0 cm),BCLC分期[9]0~A期28例(84.85%),CNLC分期[10]Ⅰa~Ⅱa期29 例(87.88%),合并微血管侵犯(microvascular invasion,MVI)19 例(57.58%)。HIV初診17 例(51.52%),HIV-RNA陽性14例(42.42%)。合并感染:HBV感染30例(合并HCV感染1例),單純HCV感染1例,無病毒性肝炎2例。Calvien-Dindo分級[11]作為術后并發癥分級的定義,其中1~2級為輕度,3~5級為重度。肝切除范圍≥3 個肝段定義為大部肝切除。患者臨床及腫瘤特征、手術及預后情況詳見表1。

表1 HIV陽性的HCC肝切除手術患者臨床資料(n=33)
1.2 治療方法
所有患者均施行根治性肝切除術,并符合《原發性肝癌診療指南(2022 年版)》[10]關于手術切除技術的要求,即解剖性肝切除,切緣≥1cm或鏡下切緣陰性,合并門脈癌栓者取凈癌栓或完整切除癌栓所在血管分支。患者術前均接受抗病毒治療(覆蓋HIV及HBV/HCV,由感染科及肝病科醫師制定方案)至少一周,術后持續用藥,隨訪未發生自行停藥或間斷用藥的情況。手術采取開腹或腹腔鏡方式,術中行全肝入肝血流阻斷、選擇性肝葉/肝段阻斷或不阻斷入肝血流方式控制出血。所有患者術后1 個月由介入科給予輔助性經肝動脈插管化療栓塞(transcatheter arterial chemoembolization,TACE),動脈造影及影像學檢查無復發及轉移者未再行治療,定期復查。復發或轉移者部分接受了相應治療,其中有2例患者接受索拉非尼/侖伐替尼治療,1例接受侖伐替尼聯合PD-1抑制劑治療。
1.3 隨訪方法
隨訪時間截至2022年3月,中位隨訪時間36個月(3~92個月)。患者完成術后輔助性TACE后間隔3~6個月來本院復查一次,不能來本院的在當地醫院復查,電話隨診。復查包括生化指標、腫瘤標志物、病毒相關指標及影像學檢查。影像學檢查包括肝膽胰B超、增強上腹部MRI及胸部平掃CT,確保至少半年完成一次增強上腹部MRI及胸部平掃CT。若B超檢查可疑復發,需要增加一次上腹部MRI檢查。以上隨訪直至患者腫瘤復發或轉移為止。發生腫瘤復發或轉移,根據治療情況采取相應后續隨訪方案,直至患者死亡或隨訪結束。
1.4 統計學分析
采用SPSS 26.0 作為統計軟件。定量資料符合正態分布用()表示,非正態分布用中位數表示;定性資料用百分比表示。采用Kaplan-Meier生存分析無瘤生存(disease free survival,DFS)、總生存(overal survival,OS)及單因素分析影響患者DFS和OS的危險因素。單因素分析影響術后嚴重并發癥發生的危險因素,因病例數較少,未做多因素分析。P<0.05認為差異有統計學意義。
2 結果
2.1 DFS時間和DFS率
至隨訪結束,復發22例(66.67%),中位DFS時間:10(95%CI0.516~19.484)個月。6個月、1年、2年、3年DFS率分別為:54.1%、44.5%、30.8%、30.8%。BCLC 0~A期患者(n=28)中位DFS時間:12(95%CI0.638~23.362)個月。6個月、1年、2年、3年DFS率分別為:60.2%、48.9%、36.7%、36.7%。CNLCⅠa~Ⅱa組患者(n=29)中位DFS時間:13(95%CI6.671~19.329)個月。6個月、1年、2年、3年DFS率分別為:64.5%、53.1%、36.8%、36.8%。見圖1。
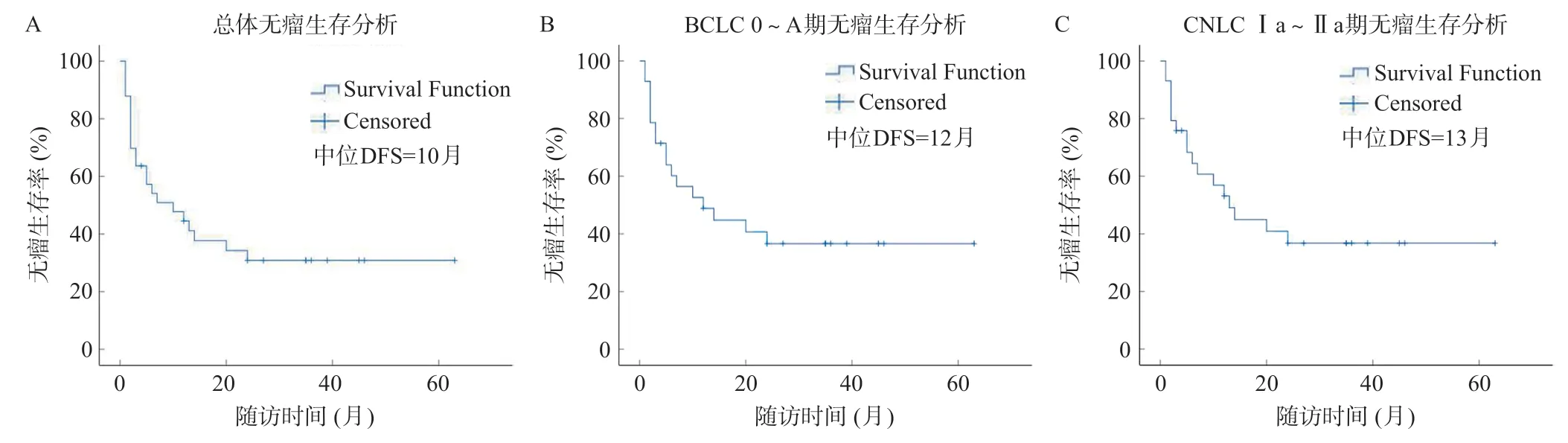
圖1 全部患者(A)、BCLC 0~A期患者(B)及CNLC Ⅰa~Ⅱa期患者(C)DFS曲線
2.2 OS時間和OS率
至隨訪結束,死亡14 例(42.42%),中位OS時間:未達到。6 個月、1 年、2 年、3 年OS率分別為:93.5%、66.9%、56.3%、50.7%。BCLC 0~A期患者(n=28)中位OS時間:未達到。6個月、1年、2年、3年OS率分別為:96%、72%、64%、57.6%。CNLCⅠa~Ⅱa期患者(n=29)中位OS時間:未達到。6個月、1 年、2 年、3 年OS率分別為:96.2%、73.1%、61.5%、55.4%。見圖2。

圖2 全部患者(A)、BCLC 0~A期患者(B)及CNLC Ⅰa~Ⅱa期患者(C)OS曲線
2.3 影響患者DFS及OS的危險因素
影響DFS的危險因素是:腫瘤最大徑≥5 cm、門靜脈癌栓、MVI、BCLC分期、CNLC分期、大部肝切除。影響OS的危險因素是:腫瘤多發、MVI、BCLC分期、CNLC分期、出血量≥1 000 mL,腫瘤復發及大部肝切除,表2。其中HIV-RNA陽性、CD4+細胞計數<200 μL不是影響預后的危險因素,前者存在趨勢,但無統計學差異(均P>0.05)。見圖3~4。
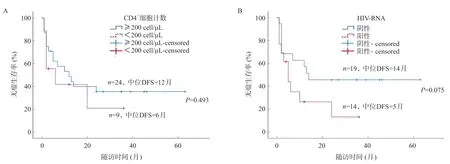
圖3 CD4+細胞計數(A)及HIV-RNA(B)對術后DFS的影響
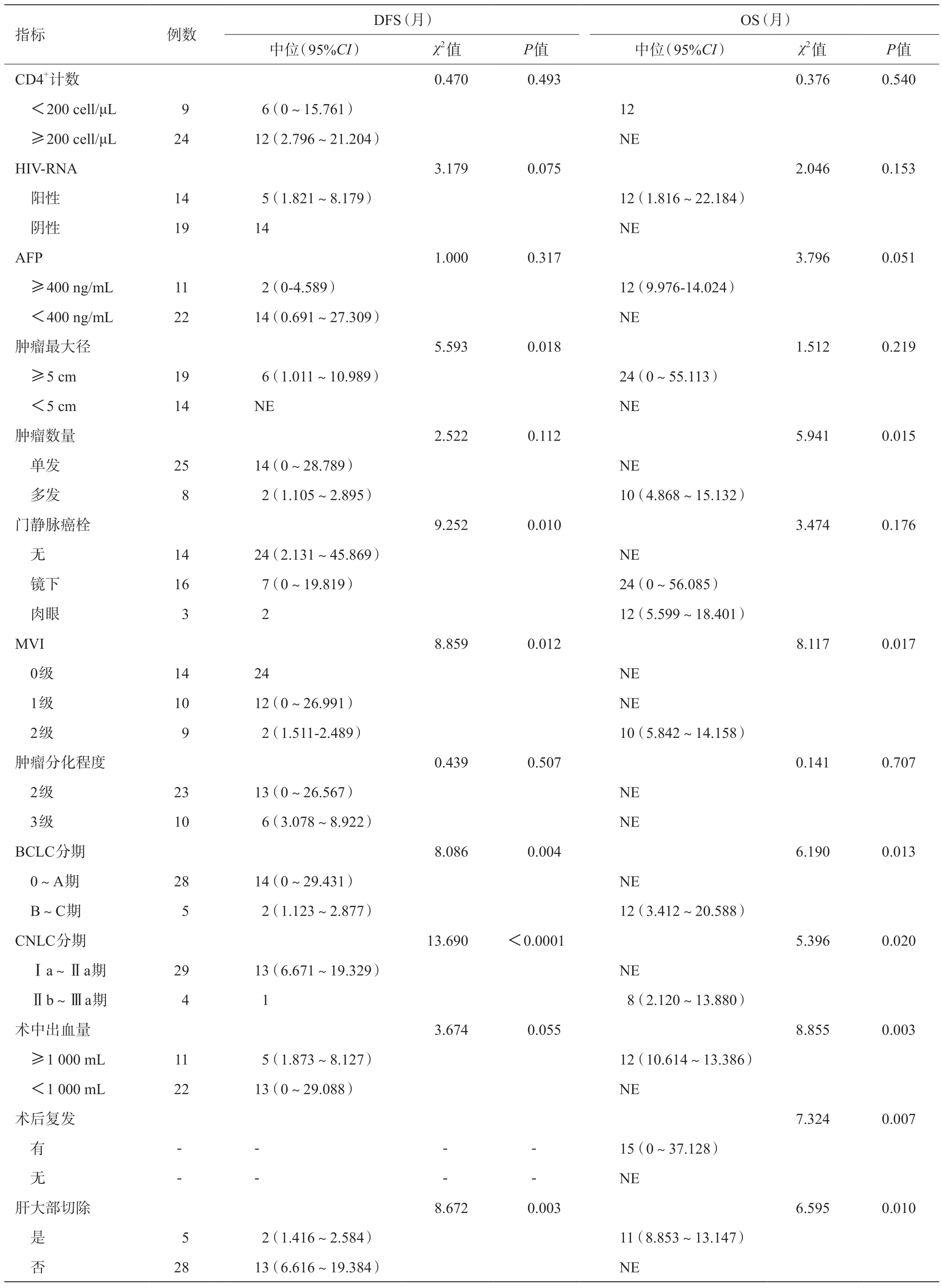
表2 單因素分析影響肝切除術預后的危險因素
2.4 影響術后發生嚴重并發癥的危險因素
影響術后發生嚴重并發癥的危險因素是出血量≥1 000 mL及輸血量≥500 mL,HIV-RNA陽性及CD4+細胞計數<200 cell/μL對術后嚴重并發癥的發生沒有顯著性影響,見表3。
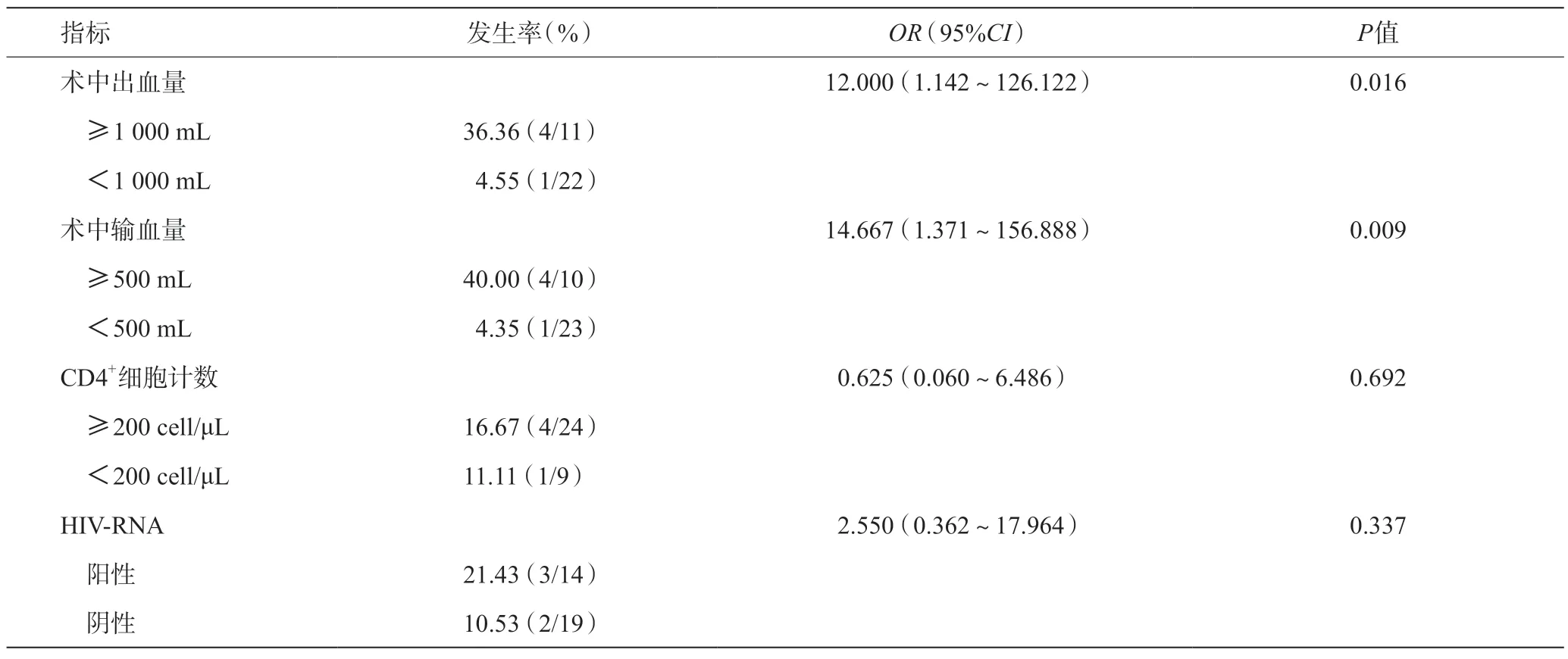
表3 單因素分析影響肝切除術后發生嚴重并發癥的危險因素
3 討論
合并HIV感染HCC患者是一類特殊人群,隨著HAART治療的有效性逐漸提高,患者生存時間延長,HCC發病率有上升趨勢。這類患者的臨床還有較多問題尚不清楚,尤其是此類患者手術治療的預后具有什么特點?與HIV陰性患者是否存在顯著性的差異?中國患者的臨床特征是否與國外存在差別?是否需要制定專門的診療指南使這一特殊人群獲得更準確的診治?這類問題都需要深入研究。
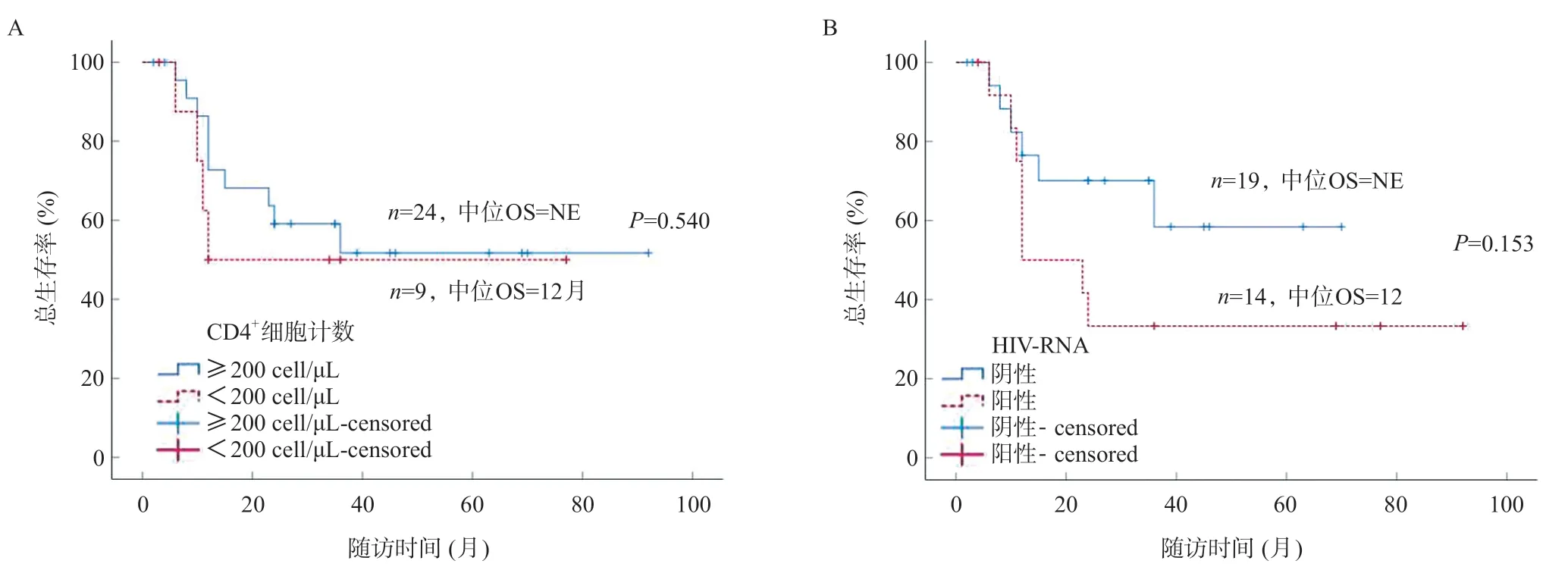
圖4 CD4+細胞計數(A)及HIV-RNA(B)對OS的影響
目前能檢索到的文獻基本都是國外的數據,并且大多數都是病例報道或小樣本量的單中心結果。文獻顯示HIV陽性的病毒性肝炎患者更容易發生肝硬化,更早發生肝癌并且HCC具備更高的侵襲性[12]。唯一多中心大樣本的回顧性研究來自意大利四個中心588例HCC患者(HIV陽性者104例,占比17.7%)[13]。該研究提供了幾個有意義的結論:(1)HIV-HCC患者多為男性,較為年輕,BCLC分期靠前,HCC診斷時間較陰性患者更早;(2)HIV陽性患者較陰性患者預后差,中位OS分別為35個月及59個月(P=0.048);(3)HIV陽性患者接受根治性治療的意愿高于陰性患者,兩組接受根治性治療(手術切除、射頻消融或TACE聯合射頻消融)的預后無統計學差異。中位OS分別為52 個月及62 個月(P=0.901);(4)HIV陽性患者復發后治療意愿顯著低于陰性患者;(5)影響OS的預后除了我們熟悉的腫瘤學特征以外,HIVRNA陽性是不良預后的獨立危險因素,而CD4+細胞計數與OS無關。以上的數據基于患者肝炎背景絕大多數為丙肝,這與我國乙肝為主的肝炎背景有差別,因此需要探索符合我們國情的HIV肝癌相關臨床數據。根據本中心長期隨訪的結果顯示:中國患者的肝炎背景主要是乙肝(本研究為94%),HIV診療療程、腫瘤分期分布與國外的數據相似,但患者復發后再治療的意愿高于國外(77.2%vs61.01%)。我們還報道了合并MVI的情況,本組患者MVI發生率(57.58%)高于文獻報道的陰性患者[41.98%(288/686)][14],低于國內病理科專家報道的單中心HIV陽性患者結果[69.2%(18/26)][15]。本研究同時分析了MVI的分級情況,1級和2級分布相當(10∶9)。患者整體的DFS、OS結果與文獻報道的陰性患者結果相似[9-10,16],也表現出分期越早預后越好的特點。遺憾的是本研究并未獲得中位OS時間,需要進一步延長隨訪周期。不過,基于本研究的中位隨訪時間達到36個月,說明本組患者的中位OS也將超過這一時間段,顯示出不差于HIV陰性患者的結果。國外部分文獻認為HIV-RNA陽性及CD4+細胞計數是影響預后的危險因素[3-4],本研究結果并未給出相似的統計學的陽性結論(即使有生存曲線差異的趨勢),可能與樣本量較小有關。
通過本項研究,發現HIV陽性HCC肝切除手術患者的一些臨床特征:(1)疾病發生更為早期,因此要加強隨訪,可能需要3個月的隨訪間期,而非指南的6個月[10];(2)此類患者給予有效的HAART治療,提高CD4+細胞計數能改善手術的安全性,包括醫務人員的安全;(3)影響此類患者預后的危險因素主要還是腫瘤的生物學特性和潛在的患者HIV-RNA水平的風險;(4)HIV陽性患者HCC預后與陰性患者相差并不是很大,因此不應該輕易放棄根治性治療,并且規律的隨訪和積極的復發后治療可以獲得更好的長期預后;(5)目前抗病毒療效明顯,遵循指南進行肝切除術前安全性評估排除手術禁忌的患者,手術操作(如術中出血量和輸血量)成為影響手術安全的主要因素,而不是過去認為的病毒載量或CD4+細胞計數。
本研究也存在一些不足:(1)回顧性及單中心研究,限制了循證醫學證據的級別;(2)樣本量相對較小,雖然時間跨度較長,但因為這類患者容易被忽視,真正接受治療尤其是手術切除的比例不高,并且本研究納入病例主要是在2017年之后,隨訪時間相對不長。所以本研究的部分結論雖然看到趨勢,但沒有統計學差異。為此下一階段我們將擴大樣本量、有條件開展多中心研究,并與HIV陰性患者比較,以獲得更高質量的研究結論;(3)目前此類患者尚缺乏靶向藥物、PD-1抑制劑之類新藥臨床研究的數據,所以臨床上沒有大量應用的療效和安全結果的報道(本研究中有3例患者使用了靶向治療單藥或聯合PD-1抑制劑治療,沒有出現3級以上不良事件的情況),基于此亟需要相關的前瞻性研究探索其確切的治療和預后的臨床結局,以使這類患者能獲得與陰性患者同步治療的機會。